肥胖低通气综合征患者的肺动脉高血压患病率的前瞻性分析
雍文穆 王婧 邓淑娇
肥胖低通气综合征(obesity hypoventilation syndrome, OHS)是指排除其它疾病所致的先天性中枢性肺泡低通气综合征、严重的阻塞性气道疾病、胸壁疾病等高碳酸血症后,病态肥胖(BMI≥30 kg/m2)合并清醒状态下的CO2潴留(动脉血二氧化碳分压(PaCO2)≥45 mmHg),是病理性肥胖最严重的并发症之一[1-2]。OHS临床特征包括肥胖、日间高碳酸血症、低氧血症等,随着人们生活方式的改变,肥胖发病率显著上升,OHS的发病率也呈明显增加趋势[3]。肺动脉高血压(pulmonary hypertension, PH)是指多种原因累及肺血管床,导致肺血管阻力呈进行性升高,最终超过个体耐受值而发生的综合病理性症状,是OHS常见的严重并发症[4]。PH早期缺乏典型的临床表现,如果治疗不及时,将导致患者昏厥、心绞痛、右心衰竭,严重者甚至可致患者死亡[5]。目前,OHS合并PH的报道相对较少,且仅有的文献也是停留在横断面研究,而关于OHS与PH关系的前瞻性队列研究更是少见。本研究通过对OHS患者进行3年的前瞻性队列研究,旨在了解OHS患者PH的患病率,并进一步探讨OHS与PH的关系,为临床防治OHS患者的PH提供参考依据。
资料与方法
一、一般资料
前瞻性随访2012年9月至2014年9月我院呼吸科收治的127例未合并PH的OHS患者,其中男76例,女51例;年龄39~82岁,平均62.8岁。纳入标准:①符合OHS诊断标准[6]:体重指数(BMI)≥30 kg/m2,日间PaCO2≥45 mmHg,或伴有PaO2下降;②符合PH诊断标准[7]:心脏彩超检查肺动脉收缩压≥40 mmHg。排除标准:①孕产妇以及哺乳期的妇女;②肝、肾功能障碍者;③支气管哮喘、慢性阻塞性肺疾病等肺部疾病;④心肌梗死、严重心力衰竭、心肌病变、心脏瓣膜病以及心脏介入手术患者;⑤高血压、糖尿病等慢性疾病;⑥恶性肿瘤患者。
二、研究方法
采用自制调查问卷收集OHS患者的以下资料:①基本资料:性别、年龄、民族、身高、体重、吸烟史、饮酒史、疾病史等。吸烟史定义为患者每天吸烟至少1支,连续超过6个月,不吸烟定义为既往不吸烟,或者吸烟超过1年戒烟超过6个月;饮酒史定义为每周摄取频次超过2次的白酒、红酒等,每次≥100 ml,不饮酒定义为既往不饮酒,或者饮酒超过1年戒酒超过6个月; ②所有患者均接受7 h夜间多导睡眠图检查(Polysmith多导睡眠检测仪,美国Neurotronics),检查指标包括OHS相关指标:睡眠呼吸暂停低通气指数(apnea-hypopnea index, AHI)、血氧饱和度(oxygen saturation, SpO2);③根据实时三维超声心动图(RT-3DE)技术,采用Philips IE33彩色多普勒显像仪测量右心室的容积,并根据三尖瓣反流法对肺动脉收缩压进行估测:依据连续多普勒在四腔心切面测定三尖瓣的反流峰值流速,参考Bernoulli公式以及估测得到的右房压力综合得到肺动脉收缩压(pulmonary artery systolic pressure, PASP)。
3年的随访期内,不对患者实施干预,也不强行进行治疗。
三、统计学方法
结 果
一、随访情况
对127例OHS患者随访3年,所有患者均完成随访,其中13例OHS患者发生PH,OHS患者的PH患病率为10.24%。OHS合并PH组患者BMI指数大于OHS组,吸烟史和饮酒史发生率高于OHS组,差异均有统计学意义(P<0.05),两组患者性别构成比、年龄比较,差异无统计学意义(P>0.05),见表1。
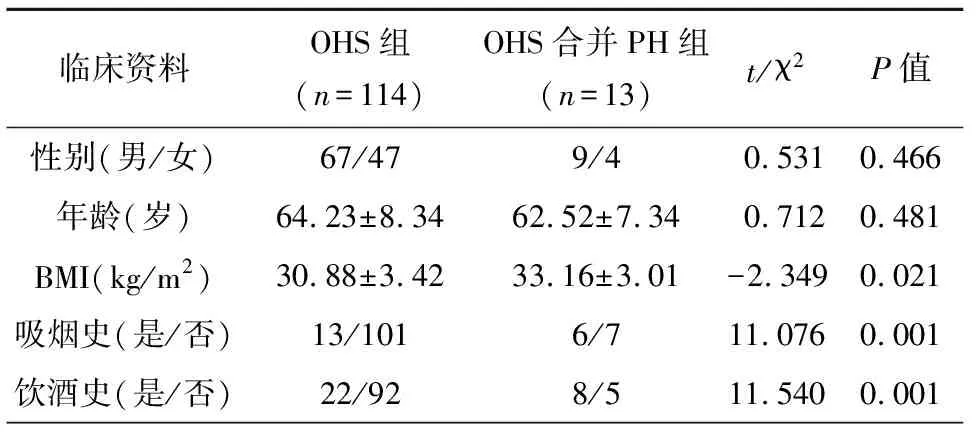
表1 比较两组患者的基线资料
二、两组患者AHI、SpO2、PASP水平比较
OHS合并PH组患者AHI、PASP水平高于OHS组,SpO22水平低于OHS组,差异有统计学意义(P<0.05),见表2。

表2 两组患者AHI、SpO2、PASP水平比较
三、OHS患者AHI、SpO2与PASP相关性分析
经Pearson积矩相关分析,OHS组患者AHI、SpO2与PASP无明显相关性(P>0.05),OHS合并PH患者,AHI与PASP呈正相关关系(r=0.539,P<0.05),SpO2与PASP呈负相关关系(r=-0.492,P<0.05)。
四、单因素Logistic回归分析
以OHS患者是否发生PH为因变量,以AHI、SpO2作为自变量分别进行单因素Logistic回归分析,结果显示,AHI为OHS患者PH发生的危险因素,且存在剂量-反应关系,AHI越大,PH风险越大;SpO2为OHS患者PH发生的保护因素,且存在剂量-反应关系,SpO2越大,PH风险越小,见表3。
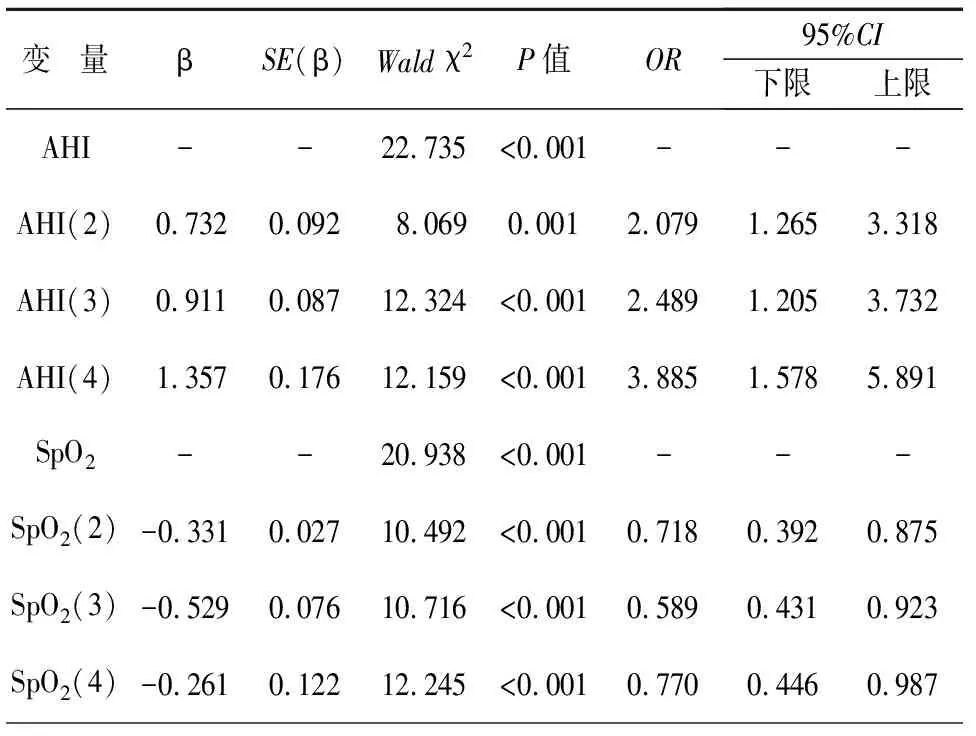
表3 单因素Logistic回归分析
五、OHS患者PH危险因素的Logistic回归分析
以OHS患者是否发生PH为因变量,以BMI、吸烟史、饮酒史、AHI、SpO2为自变量进行多元Logistic回归分析(α入=0.05,α出=0.10),结果显示,BMI、AHI是OHS患者PH发生的独立危险因素(OR=1.879、2.526,P<0.05),SpO2是OHS患者PH发生的保护因素(OR=0.723,P<0.05),见表4。
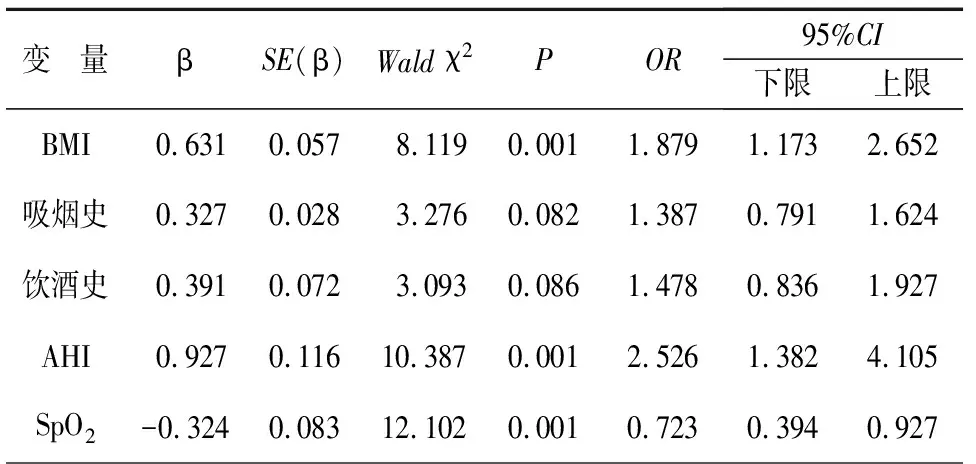
表4 OHS患者PH危险因素的Logistic回归分析
讨 论
随着经济水平的升高以及人们生活方式的改变,肥胖发生率显著升高,OHS的发生率随肥胖程度呈明显增加趋势。报道显示[8-9],在阻塞性睡眠呼吸暂停综合征患者中,OHS的发病率约为10%~20%,在BMI指数>35 kg/m2的住院患者中,OHS的发病率可高达31%。在普通人群中,OHS的发病率尚不清楚,Balachandran等[10]研究估计在0.15%~0.60%之间。OHS的发病机制主要与病理性肥胖有关,即患者肥胖损伤呼吸功能、增加呼吸系统的机械负荷、阻塞呼吸道导致睡眠呼吸发生紊乱、改变呼吸中枢驱动力、瘦素抵抗等,上述病理生理过程共同作用导致OHS的发生[11-12]。OHS典型的临床特征包括同时存在日间低氧血症和明显的高碳酸血症,另外常见的临床表现还有肥胖、呼吸节律发生紊乱、睡眠打鼾、容易疲劳和注意力不集中、日间嗜睡等[13-14]。
PH是指运动状态下肺动脉平均血压>30 mmHg,或者静息状态时>25 mmHg,轻度PH无明显症状,随着病情的持续发展,可有乏力、劳力性呼吸困难、晕厥、胸痛或心绞痛等临床表现,严重可发生心力衰竭而引起患者死亡[15-16]。Almeneessier等[17]对77例OHS患者的前瞻性研究发现,女性OHS患者PH的发生率约为71.4%,男性接近61.9%。但是在我国,相关的研究文献几乎没有,而关于OHS发生PH的机制及高危因素更是缺少证据支持。
本文对127例OHS患者随访3年,所有患者均完成随访。结果显示,OHS患者PH患病率为10.24%。OHS合并PH患者的BMI指数明显大于OHS患者,而吸烟史和饮酒史比例也高于OHS患者,推测可能肥胖、吸烟饮酒史对PH的发生具有影响。AHI是指每小时内呼吸暂停加低通气的次数,SpO2是指血液中氧合血红蛋白比例的参数,是反映低氧血症的重要指标,AHI和SpO2可在一定程度上反映OHS病情严重程度,AHI越大即呼吸暂停或者低通气次数越多,OHS病情越严重;SpO2越小即低氧血症越严重,OHS病情越严重[18-19]。PASP是反映肺动脉高血压的重要指标,静息状态下PASP正常值为18~25 mmHg,PASP越高提示肺动脉高血压越严重。本文结果发现,OHS合并PH患者的AHI、PASP水平高于OHS患者,SpO2水平低于OHS患者。OHS合并PH患者的AHI、PASP更高,SpO2更低,说明合并PH的OHS患者病情更严重。进一步Pearson积矩相关分析,显示OHS合并PH患者AHI与PASP呈正相关,SpO2与PASP呈负相关提示,AHI、SpO2可作为反映PASP的重要指标,AHI越高、SpO2越低,PH越严重。
将AHI、SpO2分类进行单因素分析,结果显示,AHI为OHS患者PH发生的危险因素,且存在明显的剂量-反应关系,AHI分类越高,PH发生风险越大,SpO2为OHS患者PH发生的保护因素,且剂量-反应关系明显,SpO2越大,PH发生风险越小。上述结果提示,AHI、SpO2可能是PH发生的影响因素。为进一步排除混杂因素对结果的影响,对变量进行校正,采用多因素Logistic回归分析结果显示,BMI、AHI是OHS患者PH发生的独立危险因素,其中AHI每升高一个等级,PH高风险增加2.526倍,推测可能是因为AHI水平越高,低氧血症越严重,而低氧血症可导致肺动脉出现肺血管结构重建、肺血管收缩以及形成原位血栓,是引起肺动脉高压的重要危险因素。BMI≥32 kg/m2发生PH的风险是BMI<32 kg/m2的1.879倍,可能是因为肥胖引起低通气而产生更多的二氧化碳,加重二氧化碳分压,导致高碳酸血症形成,而高碳酸血症可引起肺血管产生收缩,以及使肺动脉血管对低氧状态的反应性增强,进一步引起肺动脉高血压。SpO2是OHS患者PH的保护因素,即SpO2每增加一个等级,PH发病风险减少27.7%。
综上所述,本文通过前瞻性随访发现,本组OHS患者PH患病率为10.24%,AHI、SpO2是PH发生的影响因素,OHS与PH的发生密切相关,是促进PH发生重要因素。

