血管性痴呆动物模型中应用补肾健脑汤对大鼠海马神经元谷氨酸转运体的影响研究*
冀秀萍,汶 鉴,马骋宇,王建军,张 蓓
1.西安医学院第一附属医院 中医科(西安 710000);2.西安医学院第一附属医院 急诊科(西安710000); 3. 西安医学院第一附属医院 神经内科(西安 710000)
血管性痴呆是以显著的认知功能(如学习和记忆功能等)下降为表现的一种较常见的老年疾病,是由各种脑血管病引起的获得性认知功能损害[1-2],在痴呆的病因中名列第二。随着生活水平的提高,脑血管疾病在老年人中的发病率日益增长,血管性痴呆已引起国内外的广泛关注。近年来,有研究[3]发现,在脑缺血情况下,毒性氨基酸释放的主要由于谷氨酸转运体(excitator aminoacid transporters,EAATs)的表达改变引起。而中医可有效治疗血管性痴呆所致的学习及记忆障碍。本课题通过建立大鼠血管性痴呆模型,分别从学习记忆能力、神经元EAATs方面研究补肾健脑汤对血管性痴呆的影响,发现其疗效及可能的机制,为提高临床治疗效果提供理论依据。
1 材料与方法
1.1 实验材料
30只SPF级健康雄性SD大鼠,体质量240~290 g。OPJ-1B型切片机购置于上海珂准仪器有限公司;80i正置显微镜购于日本奥林巴斯;Morris水迷宫由安徽正华生物仪器设备有限公司专业研制。补肾健脑汤(熟地15 g、黄精15 g、制首乌15 g、菟丝子15 g、仙灵脾15 g、益智仁12 g、枸杞子15 g、丹参10 g、川芎10 g、石菖蒲10 g、郁金10 g,桔梗10 g)。
1.2 实验分组
将各组大鼠养殖于同样实验条件下,使大鼠在笼子里适应1周,将上述大鼠随机分为3组:假手术组、模型组和药物组。药物组和模型组采用国际公认的方法建立大鼠血管性痴呆模型(双侧颈总动脉反复缺血-再灌注法)。
1.3 动物模型的制备
用10%水合氯醛麻醉大鼠,进行颈前正中位切口,分离双侧颈总动脉,给予大鼠腹膜内注射硝普钠溶液(2.5 mg/kg)。然后,双侧颈总动脉用非侵入性钳夹闭10 min,再灌注10 min,重复3次后缝合伤口。假手术组双侧颈总动脉仅分离,无闭塞或注射,其余治疗方法与模型组相同。术后第2天,药物组给予补肾健脑汤灌胃,剂量3 μg/g/d,而假手术组和模型组只给予等体积的生理盐水灌胃。
1.4 大鼠行为学观察
1.4.1 大鼠的一般状况观察 术后每天观察各组大鼠对外界的反应以及行为改变等。术后57 d各组大鼠分别进行Morris水迷宫试验、跳台试验,将测试成绩定为学习成绩;将术后58 d的测试成绩定为记忆成绩。
1.4.2 跳台试验 中国医学科学院药物研究所研制的60 cm×12 cm×33 cm的被动回避反应槽被用作跳台试验装置。黑色塑料片将其分成两个相等的部分,且在底部放置通电铜栅。直径和高度为4.5 cm的绝缘橡胶垫放置在设备的右侧,用作大鼠的安全平台,以避免电击。电压调节器用于调节电压。将大鼠放置在跳跃装置中适应3 min,然后打开40 V交流电电击大鼠。大鼠跳到安全平台,避免触电。大鼠跳跃的时间记录为响应时间。若大鼠再从安全台上跳下并触及铜栅即为错误反应。实验期间,错误次数和反应时间被认为是其学习成绩。24 h后,重复测试。将大鼠置于安全平台上并施加电流。大鼠在5 min内从安全平台跳到铜格栅的时间为潜伏时间。潜伏时间,错误次数被认为是记忆成绩。
1.4.3 Morris水迷宫试验 Morris水迷宫试验装置是一长宽高分别为1.1、0.7、0.4 m的棕色有机玻璃槽,玻璃槽的一侧为阶梯,装置中仅有一条路可至阶梯,大鼠爬上阶梯并因此获得休息。玻璃槽内呈迷宫状,装置中的大鼠不能看到阶梯,迷宫多处有盲端且有自动感应装置;自动控制记录仪记录数据;实验条件为水深10 cm、水温23 ℃,记录时间3 min。测试前先诱导训练各组大鼠游Morris水迷宫,记录其游完全程时间、进入盲端次数即为错误次数,3 min内不能游出迷宫者按3 min计。术后57 d的测试成绩记录为学习成绩。术后58 d的测试成绩记录为记忆成绩。
1.5 形态学观察海马神经细胞
行为学试验结束后,每组随机抽取数只大鼠,用5 %戊巴比妥(350 mg/kg)麻醉后将其断头取脑,获得海马,并在4%多聚甲醛中固定。用乙醇脱水并用石蜡包埋后,制成5 μm切片后进行苏木精和伊红染色,在光学显微镜(CKX41,Olympus,Tokyo,Japan)下观察海马CA1区域。
1.6 免疫组织化学染色
每组随机取5只大鼠脑组织(视交叉至乳头体之间的部分),按照常规脱水、透明、浸蜡,连续冠状切片,厚6 μm,实验步骤为孵育、冲洗、抗原修复、封闭、加一抗、冲洗、显色、复染、脱水、封片。
1.7 观察标本
取各组大鼠大致一致部位的两张切片,在200倍光镜下分别测量每个视野中 EAAT1和 EAAT2阳性细胞的光密度值,且取其平均值作为该张切片的平均光密度值,以此代表抗原表达量。
1.8 统计学方法
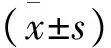
2 结果
2.1 大鼠跳台试验
观察学习测试结果,模型组与假手术组大鼠相比,跳台实验的反应时间明显延长,错误次数明显增多(P<0.05);与模型组相比,药物组跳台试验反应时间明显缩短,错误次数明显减少(P<0.05)。从记忆测试结果观察,与假手术组相比,模型组潜伏期明显缩短,错误次数明显增加(P<0.05) ; 与模型组相比,药物组潜伏期明显延长,错误次数明显较少(P<0.05)(表1~2)。
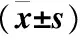
表1 各组大鼠跳台试验学习测试结果
注:与假手术组比较,aP<0.05;与模型组比较,bP<0.05
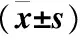
表2 各组大鼠跳台试验记忆测试结果
注:与假手术组相比较,aP<0.05;与模型组相比较,bP<0.05
2.2 大鼠水迷宫试验
模型组与假手术组大鼠相比,游泳时间、错误次数明显增加(P<0.05);药物组与模型组相比,游泳时间、错误次数明显减少(P<0.05)(表3~4)。

表3 不同实验组大鼠水迷宫试验学习测试结果
注:与假手术组比较,aP<0.05;与模型组比较,bP<0.05

表4 不同实验组大鼠水迷宫试验记忆测试结果
注:与假手术组比较,aP<0.05;与模型组比较,bP<0.05
2.3 大鼠海马CA1区HE染色结果
在假手术组中,观察到大量海马CA1神经元紧密整齐地填充,具有圆形核,核仁突出,染色质均匀(图1A)。在模型组中,海马CA1神经元数量减少,显示无组织排列。神经细胞核被深染和固定,具有大的不规则形状的胶质细胞(图1B)。模型组海马CA1神经元的数量与药物组(图1C)数量相比明显减少,排列不规则。 此外,观察到模型组神经胶质细胞数量增加,被强烈染色和形状不规则;仅观察到少量正常神经元。
2.4 大鼠海马CA1区EAAT1和EAAT2免疫组化染色结果
与假手术组相比,模型组大鼠脑海马CA1区EAAT1和EAAT2表达明显下降(P<0.05)。药物组与模型组相比,EAAT1和EAAT2表达明显增加(P<0.05)(图2)。
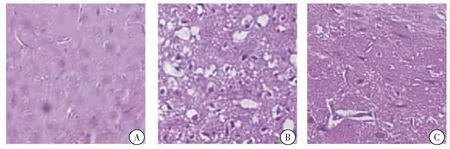
图1 大鼠海马CA1区HE染色结果
3 讨论
血管性痴呆疾病全球发病率日益增长,痴呆症患者总数约5 000万,中国约1 000万,记忆和认知功能障碍是血管性痴呆的主要表现,通常由脑缺血和缺氧损伤引起。但其具体机制尚不清楚。有研究[4]发现,机体在学习和记忆时会引起神经元和突触部位的某些神经递质、受体等蛋白质变化。因此,研究它们在学习、记忆中的机制尤为重要。中医认为,血管性痴呆与伏邪内生、损害元神,肾精亏虚、瘀血阻窍、浊毒壅塞、败坏脑络有关,因此,治疗时以补益肝肾、活血化瘀等方面全面调理。健脑益智汤(熟地15 g、黄精15 g、制首乌15 g、菟丝子15 g、仙灵脾15 g、益智仁12 g、枸杞子15 g、丹参10 g、川芎10 g、石菖蒲10 g、郁金10 g,桔梗10 g)具有补肾益智、活血化瘀的功效,前期研究已证明该药方治疗血管性痴呆有显著效果。
海马是机体学习和记忆的重要部位,同时也是脑缺血常见累及部位,并常因各种脑血管疾病而导致或加重缺血性脑损伤和血管性痴呆的发生[5]。有研究发现,在脑缺血情况下,毒性氨基酸释放主要是由于EAATs的表达改变引起。有报道发现,脑缺血时EAATs表达下降或是转运能力下降,引起谷氨酸在突触间隙中停留并持续对神经细胞产生毒性影响[3,6]。神经递质谷氨酸不仅是兴奋性神经递质,又是隐匿的神经毒素[7]。近年来大量缺血性动物实验发现,大量的神经毒素停留在突触间隙并结合突触后膜受体,导致细胞内一系列损伤机制,最终导致血管性痴呆的形成[8]。所以减轻兴奋性氨基酸的毒性结合对于减轻缺血缺氧性脑损伤尤为关键。神经细胞上的EAATs通过再次摄取谷氨酸阻止其在突触中产生毒性反应[9]。因此,EAATs的表达影响突触间隙中谷氨酸的清除,从而影响各个神经元细胞的突触传递。有研究发现,EAATs在脑缺血缺氧的机制和治疗中产生重要作用,它主要通过减少突触间隙中的神经毒素谷氨酸发挥作用。在脑缺血时,位于神经元和神经胶质细胞膜上的EAATs表达下降,从而影响突触间隙谷氨酸的清除,高浓度的内源性神经毒素谷氨酸最终导致神经细胞坏死或凋亡[10]。发生主要作用的EAATs(包括EAAT1和EAAT2)具有接近的分子结构[11-13]。有报道称,EAAT1和EAAT2是神经细胞最引起关注的兴奋性氨基酸转运体之一。
国内已有大量报道[14]显示,补肾健脑汤可提高血管性痴呆患者的认知、记忆、计算、操作能力,改善患者日常生活能力和精神体力。本研究也发现,血管性痴呆大鼠饲养补肾健脑汤后,学习和记忆能力比模型组强,但其机制并不清楚。本研究通过制备血管性痴呆模型发现,与模型组相比,药物组海马CA1区神经细胞的凋亡、坏死明显改善,且在免疫组化染色结果上,药物组EAAT1和EAAT2表达量明显多于模型组,但药物组与假手术组相比,神经细胞的凋亡、坏死仍较重,EAAT1和EAAT2的表达也少于假手术组,这可能是由于补肾健脑汤只能部分改善血管性痴呆大鼠海马区CA1区缺血、缺氧时的组织坏死、凋亡。
综上所述,补肾健脑汤可改善血管性痴呆大鼠的学习和记忆障碍,其机制可能是影响内源性神经毒素清除的EAATs的表达有关。
[1]殷明刚. 血浆同型半胱氨酸水平与老年血管性痴呆关系研究[J]. 成都医学院学报,2011,6(4):333-334.
[2]郭雪冰,莫煊,张明琛. 抗抑郁药物治疗对老年血管性痴呆患者执行功能的影响[J]. 新疆医科大学学报,2013(9):1323-1325.
[3]Pratap K,Keisha S,James J.Genetic dys-regulation of astrocytic glutamate transporter EAAT2 and its implications in neurological disorders and manganese toxicity[J].Neurochem Res,2015,40(2): 380-388.
[4]Walther S, Halpern M.Cannabinoids and Dementia: A Review of Clinical and Preclinical Data[J].Pharmaceuticals (Basel),2010, 3(8):2689-2708.
[5]Yang Y, Kimura-Ohba S, Thompson J,etal.Rodent Models of Vascular Cognitive Impairment[J].Transl Stroke Res, 2016, 7(5):407-414.
[6]Lang U E, Borgwardt S.Molecular mechanisms of depression: perspectives on new treatment strategies[J].Cell Physiol Biochem, 2013,31(6):761-777.
[7]Weronika K, Bartosz P.Glutamate transporters in brain ischemia: to modulate or not[J].Acta Pharmacol, 2014, 35(4): 444-462.
[8]张海红.NMDA受体与中枢神经系统退行性疾病[J].神经药理学报,2006,10(1):69-72.
[9]Daniel T,Tharine A,Dal-Cim.Guanosine prevents nitroxidative stress and recovers mitochondrial membrane potential disruption in hippocampal slices subjected to oxygen/glucose deprivation[J].Purinergic Signal, 2016, 12(4):707-718.
[10] Federico S,Alberto P, Abraham M.Extrasynaptic glutamate release through cystine/glutamate antiporter contributes to ischemicdamage[J].J Clin Invest, 2014, 124(8): 3645-3655.
[11] Sungjin P, Yongwook J.Combined actions of Na+/K+-ATPase, NCX1 and glutamate dependent NMDA receptors in ischemicrat brain penumbra[J].Anat Cell Biol, 2010,43(3): 201-210.
[12] Pines G,Danbolt N G,Bjoras M,etal.Cloning and expression of a rat brain L-glutamate transporter[J].Nature,1992,360(6403):464-467.
[13] Fairman W A,Vandenberg R J,Arriza J L,etal.An excitatory amino-acid transporter withproperties of a ligand-gated chloridechannel[J].Nature,1995,375(6532):599-603.
[14] 吕少起,陈 静.补肾健脑汤治疗老年性痴呆60例[J].山东中医杂志,2014,1(33),30-31.

