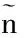4-氨基吡啶对大鼠臂旁外侧核神经元放电活动和温度敏感性的影响*
綦黄鹏,唐 新,朱云才,刘绿叶,许 莉,沈字玲,林友胜,张 洁△
1.成都医学院 基础医学院(成都 610500);2.成都医学院 临床医学院(成都 610500);3.成都医学院 检验医学院(成都 610500)
臂旁外侧核(lateral parabrachial nucleus, LPB)是皮肤温度信号上传通路的重要中继站,在维持体温稳定的前馈体温调节中具有重要作用[1-4]。前期实验在大鼠LPB上发现了温度敏感神经元,并观察到大部分自发放电LPB神经元在动作电位之前表现出一种小的去极化电位,即前电位[5]。研究[6]表明,前电位是决定体温中枢视前区热敏神经元温度敏感性的关键因素,温度升高能加快其前电位上升速率,使之更快达到阈电位水平,引起放电间期缩短,放电频率加快。A型钾通道介导的A型钾电流(A-type potassium current, IA)失活加快是前电位上升速率加快的重要机制,前期实验[7]已证实LPB表达A型钾通道,但A型钾通道是否参与LPB神经元温度敏感性的形成尚不清楚。本实验采用红外可视脑片膜片钳胞外记录技术,观察4-氨基吡啶(4-aminopyridine, 4-AP)阻断A型钾通道后,对LPB神经元放电活动和温度敏感性的影响,从电生理角度探讨A型钾通道是否参与LPB神经元温度敏感性的形成。
1 材料与方法
1.1 材料与试剂
健康雄性SD大鼠(80~150 g)由成都达硕生物医学科技有限公司提供。记录玻璃电极毛胚购自美国Sutter公司。4-AP、MgATP、Na2GTP、乙二醇二乙醚二胺四乙酸(EGTA)、N-2-羟乙基哌嗪-N'-2-乙磺酸(HEPES)、葡萄糖酸钾均购自美国Sigma公司。戊巴比妥钠、NaCl、KCl、CaCl2、MgSO4、KH2PO4、NaHCO3和葡萄糖均购自成都科龙化工试剂厂。人工脑脊液(artificial cerebrospinal fluid, ACSF)成分(mmol/L):NaCl 124,NaHCO326,KCl 5,CaCl22.4,MgSO41.3,KH2PO41.24,葡萄糖 10(pH 7.4,渗透压 300 mOsm/kgH2O)。电极内液成分(mmol/L):葡萄糖酸钾 130,MgATP 2,Na2GTP 2,EGTA 10,CaCl21,HEPES 10(pH 7.2,渗透压290 mOsm/kgH2O)。
1.2 制备含LPB大鼠脑薄片
雄性SD大鼠经腹腔注射戊巴比妥钠(40 mg/kg)麻醉后,迅速断头取脑。将全脑置于混合氧(95%O2和5%CO2)饱和的0 ℃ ACSF中冷冻1 min,取出修块,头端在中脑上、下丘之间横断,尾端在脑桥与延髓之间横断。将脑干块紧贴琼脂块固定于标本盘内,刀刃向头端倾斜20°,在0 ℃持续通氧ACSF中从头端开始振动切片,直至脑桥头端背外侧出现一新月形透明区,提示已到达LPB头端,切下300 μM厚脑片,选用LPB头尾方向中间1/3水平冠状片进行实验,此水平LPB表面积最大,是取得LPB各种膜片钳记录最理想的位置。脑片在32 ℃ ACSF中孵育1 h后开始实验。
1.3 脑片膜片钳胞外记录神经元自发放电活动
将孵育好的脑片移入灌流槽内,用附着有尼龙丝的U形铂金框轻覆于脑片上,用恒流泵向灌流槽中持续灌流充以混合氧的ACSF。使用正置微分干涉相差显微镜( FN1 Nikon, 日本),在低倍物镜(×4)下找到透明的新月形LPB区,然后在高倍浸水物镜(×40)下, 通过图像采集软件(NIS Elements D 3.1, Nikon,日本) 观察镜下细胞, 选取边界清楚、成像清晰、立体感强的神经元进行实验。利用三维微推进器( MPC 200 Sutter Instruments, USA)驱动充有电极液带正压的微电极接近细胞,电极入水阻抗为3~7 MΩ,当电极尖端接触并轻压在细胞膜表面时,稍加负压,形成细胞贴附式构型,切换成电流钳模式后,经放大器EPC-10(HEKA,德国)记录胞外自发放电。通过Patchmaster进行数据的采集和记录,采样频率10 KHz,低通滤波2 KHz。
1.4 鉴别神经元温度敏感性与给药
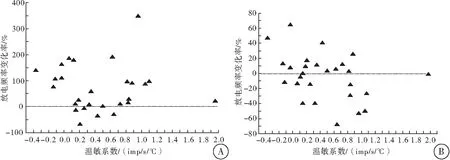
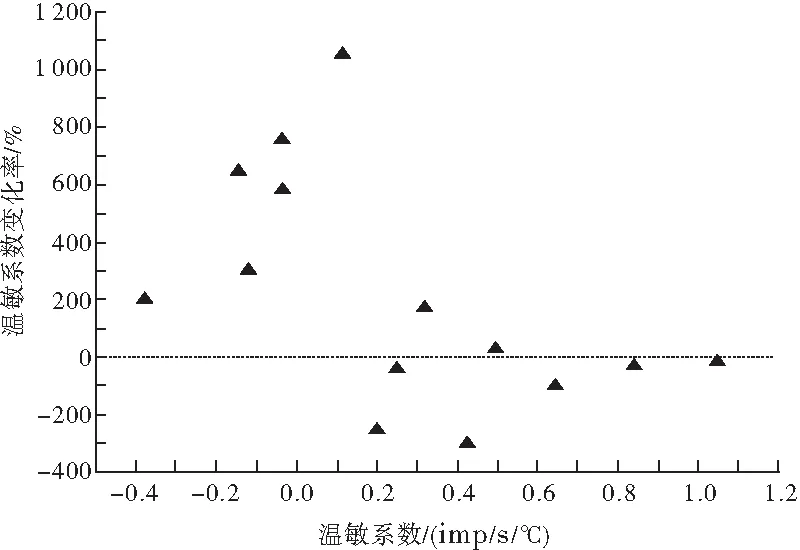
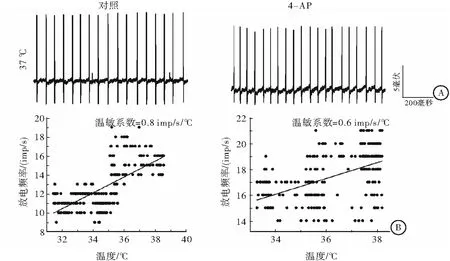
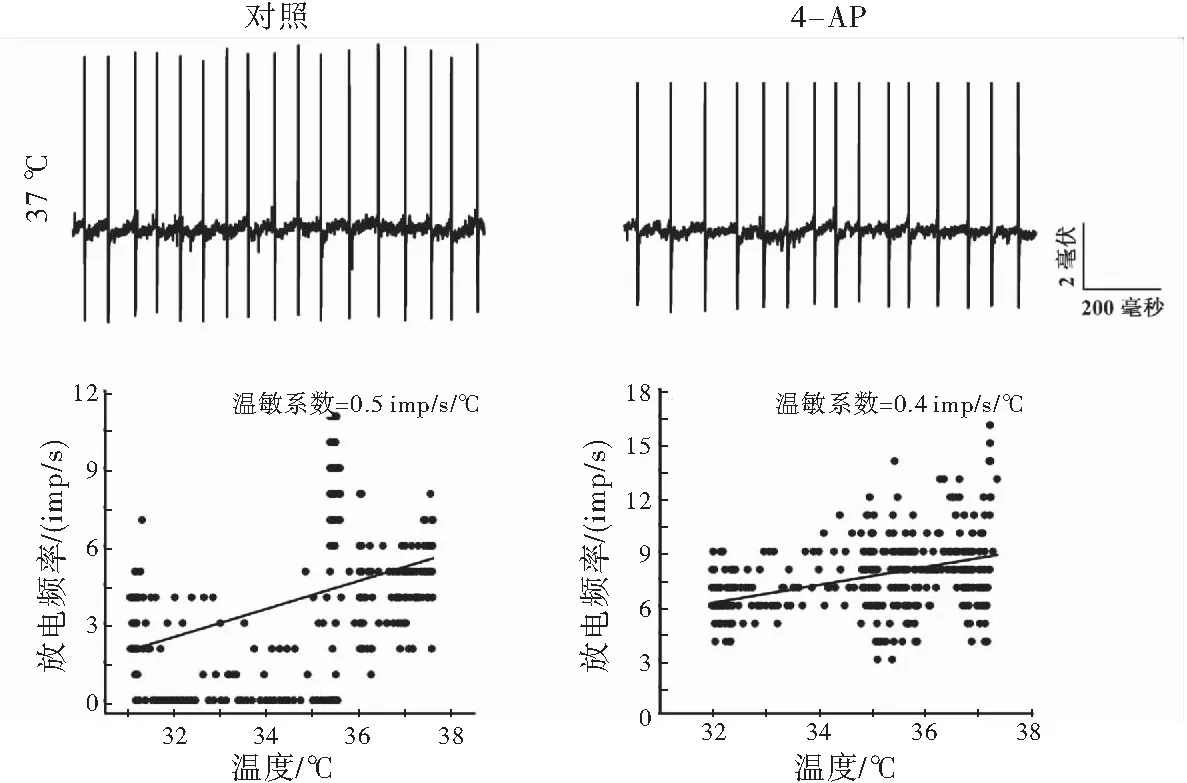
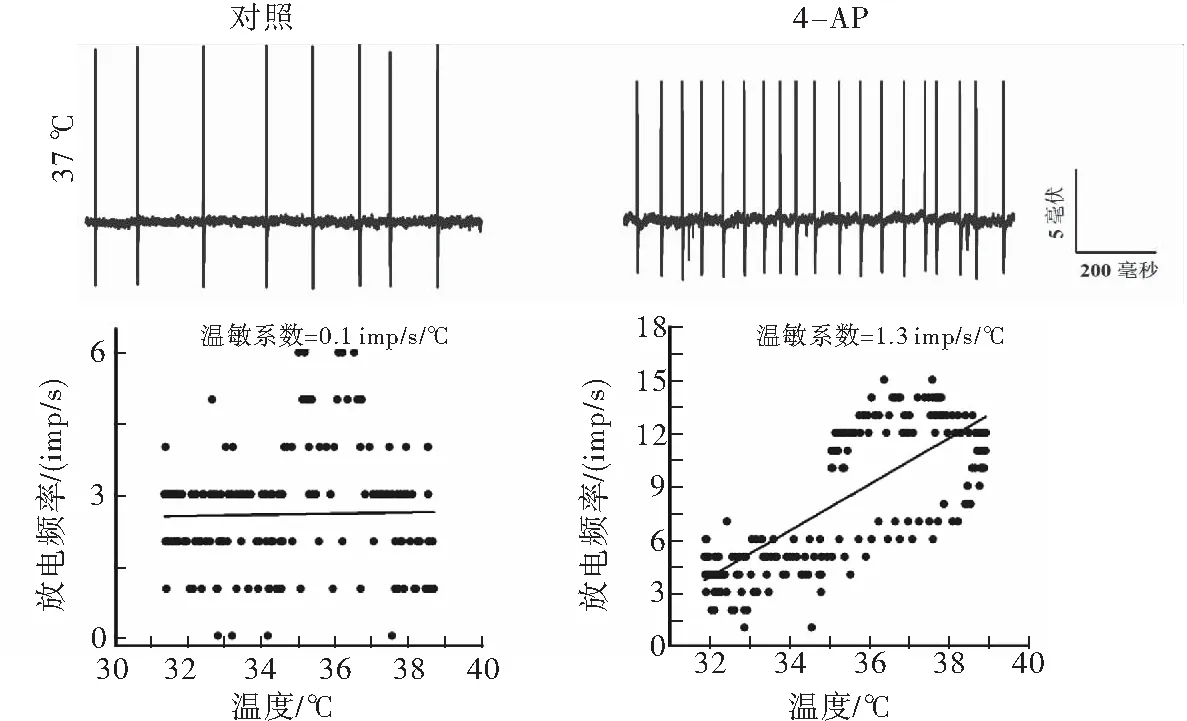
通过温度控制器TC-324B和CL-100(Warner Instruments, USA)共同将灌流槽浴液的基础温度保持在36 ℃左右,并可使浴液温度在30~45 ℃快速变化。根据温度对神经元放电频率的影响, 计算温敏系数(m 值),m值表示单位温度和时间内的放电个数, 即imp/s/℃。按体温中枢视前区神经元分类标准[6]鉴别LPB神经元温度敏感性:m值≥0.8 imp/s/℃为热敏神经元,m值≤-0.6 imp/s/℃为冷敏神经元,-0.2 ≤ m值≤ 0.2 imp/s/℃为低斜率的温度不敏感神经元,0.2 在记录的27个LPB自发放电神经元中,热敏神经元8个,中斜率温度不敏感神经元9个,低斜率温度不敏感神经元10个。4-AP使热敏神经元的平均放电频率由(8.93±4.99)imp/s增加至(15.30±6.10) imp/s(n=8,P<0.05),其中62.5%(5/8)的热敏神经元放电频率增加30%以上(图1A);4-AP对中斜率温度不敏感神经元的平均放电频率无明显影响(P>0.05),加药前后分别为(7.18±2.98)和(7.10±1.22) imp/s(n=9);4-AP使低斜率温度不敏感神经元的平均放电频率从(6.09±4.15) imp/s增加到(10.33±2.33) imp/s(n=10,P<0.05),其中70%(7/10)的低斜率温度不敏感神经元放电频率增加30%以上(图1A)。 灌流4-AP前后三类神经元的放电幅度比较,差异均无统计学意义(P>0.05),热敏神经元加药前后平均放电幅度分别为(19.87±5.63) mV和(14.11±2.87) mV(n=8,t=1.64,P=0.15);中斜率温度不敏感神经元加药前后平均放电幅度分别为(18.53±5.58)mV和(19.53±6.53)mV(n=9,t=-0.63,P=0.55);低斜率温度不敏感神经元加药前后平均放电幅度分别为(28.03±9.93)mV和(25.30±7.95)mV(n=10,t=1.01,P=0.34),每个LPB神经元放电幅度变化率见图1B。 图1 LPB神经元应用4-AP前后放电频率和放电幅度的变化百分率注:A:放电频率;B:放电幅度 在灌流4-AP阻断A型钾通道的27个LPB神经元中,共有14个在加药后再次循环改变灌流液温度鉴定加药后温度敏感性的变化。其中热敏神经元2个,中斜率温度不敏感神经元6个,低斜率温度不敏感神经元6个。在记录的2个热敏神经元中,4-AP均有降低温敏系数的趋势(图2),其中1例热敏神经元的温敏系数由0.8 imp/s/°C降至0.6 imp/s/℃,减少了26.4 %,由热敏神经元变成了中斜率温度不敏感神经元(图3);6个中斜率温度不敏感神经元温敏系数无明显变化(图2,图4);6个低斜率温度不敏感神经元中,所有神经元温敏系数均增加≥195%(图2),其中1例低斜率温度不敏感神经元的温敏系数由0.1 imp/s/°C增加至1.3 imp/s/°C,由低斜率温度不敏感神经元变成了热敏神经元(图5)。 图2 LPB神经元应用4-AP前后温敏系数的变化百分率 图3 4-AP对热敏神经元放电活动和温敏系数的影响注:A:加药前后的原始放电图;B:加药前后的温敏系数拟合曲线 图4 4-AP对中斜率温度不敏感神经元放电活动和温敏系数的影响 图5 4-AP对低斜率温度不敏感神经元放电活动和温敏系数的影响 A型钾通道广泛分布于多种类型的神经元上,其介导的IA电流具有快速激活、快速失活等特征,是动作电位复极化早期外向电流的主要成分,在神经元放电频率调节、动作电位产生及放电模式等方面具有重要作用[8]。视前区热敏神经元前电位形成与IA电流失活有关,温度升高加快热敏神经元IA电流失活速率,继而加快前电位上升速率,引起放电间期缩短、放电频率加快,表现出随温度升高,放电频率明显增加的热敏特性[6]。但A型钾通道是否参与LPB神经元温度敏感性的形成尚不清楚。为探讨A型钾通道是否参与LPB神经元温度敏感性形成,本研究采用胞外记录方法,观察了A型钾通道的特异性阻断剂4-AP对LPB热敏、中斜率和低斜率温度不敏感神经元放电频率、放电幅度和温敏系数的影响。结果显示,4-AP使热敏和低斜率温度不敏感神经元的放电频率显著加快,在记录的LPB神经元中约有51.9%神经元在灌流4-AP后放电频率显著增快,和之前研究[9]报道的在70%大鼠LPB神经元观察到了IA电流介导的膜超极化后兴奋延迟现象的结果接近。 4-AP 加快热敏神经元的放电频率,但对其温敏系数却有降低趋势,其中1例热敏神经元变成了中斜率温度不敏感神经元,提示4-AP影响了热敏神经元的放电活动,A型钾通道有可能参与热敏神经元温度敏感性形成,但因观察例数少,尚需进一步证实,特别是还需要采用电压钳方法,观察温度对热敏神经元IA电流的影响,为A型钾通道参与LPB神经元热敏形成提供直接证据。4-AP对中斜率温度不敏感神经元放电频率、放电幅度和温敏系数均无明显影响,提示这些中斜率温度不敏感神经元可能不表达A型钾通道。4-AP加快低斜率温度不敏感神经元放电频率,使其温敏系数全部增加≥195%,其中1例由低斜率温度不敏感神经元变成了热敏神经元,提示A型钾通道不但表达于低斜率温度不敏感神经元,而且可能与其温度不敏感性有关。Viana等[10]在研究三叉神经节神经元的温度敏感性时,在三叉神经节神经元记录到一种激活快但失活慢,也对4-AP敏感的IKD电流,而且观察到应用4-AP阻断这类电流,引起温度不敏感神经元放电频率频率明显加快,其中29%还具有冷敏性,认为IKD抑制了温度不敏感神经元在温度变化时的兴奋性,起着兴奋刹车样作用,导致这类神经元不能表现出温度敏感性[11]。本实验观察到了相似的电生理现象,且分子生物学实验显示LPB表达不同的A型钾通道亚型[7]。因此,我们推测,LPB热敏和低斜率温度不敏感神经元可能表达不同类型的A型钾通道亚型,介导不同类型的4-AP敏感的钾电流。热敏神经元有可能表达激活快、失活快的IA电流,介导了热敏神经元的温度敏感性;而低斜率温度不敏感神经元可能高表达激活快,但失活慢的IKD电流,与其温度不敏感的形成有关,但尚需采用膜片钳结合单细胞PCR技术来进一步证实上述猜想。因此,A型钾通道可能参与了LPB神经元温度敏感性的形成,但在热敏和低斜率温度不敏感神经元表达的A型钾通道亚型可能不同。 [1]Nakamura K, Morrison S F. A thermosensory pathway that controls body temperature[J]. Nat Neurosci, 2008, 11(1): 62-71. [2]Nakamura K, Morrison S F. A thermosensory pathway mediating heat-defense responses[J]. Proc Natl Acad Sci USA, 2010, 107(19): 8848-8853. [3]Geerling J C, Kim M, Mahoney C E,etal. Genetic identity of thermosensory relay neurons in the lateral parabrachial nucleus[J]. Am J Physiol Regul Integr Comp Physiol, 2016, 310(1): R41-R54. [4]Yahiro T, Kataoka N, Nakamura Y,etal. The lateral parabrachial nucleus, but not the thalamus, mediates thermosensory pathways for behavioural thermoregulation[J]. Sci Rep, 2017, 7(1): 5031. [5]Xue Y, Yang Y, Tang Y,etal. In vitro thermosensitivity of rat lateral parabrachial neurons[J]. Neurosci Lett, 2016, 619: 15-20. [6]Griffin J D, Kaple M L, Chow A R,etal. Cellular mechanisms for neuronal thermosensitivity in the rat hypothalamus[J]. J Physiol (Lond), 1996, 492 ( Pt 1): 231-242. [7]于洋, 鲜志攀, 许春梅, 等. A型钾通道基因在正常大鼠臂旁外侧核的表达[J]. 医学研究杂志, 2016, 45(10): 57-60. [8]Yunoki T, Takimoto K, Kita K,etal. Differential contribution of Kv4-containing channels to A-type, voltage-gated potassium currents in somatic and visceral dorsal root ganglion neurons[J]. J Neurophysiol, 2014, 112(10): 2492-2504. [9]Hayward L F, Felder R B. Electrophysiological properties of rat lateral parabrachial neurons in vitro[J]. Am J Physiol, 1999, 276(3 Pt 2): R696-R706. [11] Cabanes C, Viana F, Belmonte C. Differential thermosensitivity of sensory neurons in the guinea pig trigeminal ganglion[J]. J Neurophysiol, 2003, 90(4): 2219-2231.1.5 统计学方法
2 结果
2.1 4-AP对LPB神经元放电频率的影响
2.2 4-AP对LPB神经元放电幅度的影响
2.3 4-AP对LPB神经元温度敏感性的影响
3 讨论