FGF19调控肿瘤细胞增殖和自噬的生物学功能研究*
邓晓微,杨 婵,王嘉宝,尹小菲,李静怡
成都医学院 生物医学系(成都 610500)
成纤维细胞生长因子(fibroblast growth factors, FGFs)是一类具有多种功能的多肽细胞因子大家族,FGFs由垂体和下丘脑分泌,由大约200个氨基酸组成,家族成员间有一定的氨基酸同源性,核心区域约由120个氨基酸组成,具有高度同源性[1]。根据序列同源性及系统发生和结构分析,哺乳动物FGF家族分为5个旁分泌/自分泌作用亚家族和1个内分泌作用亚家族。FGFs参与组织内环境稳定、再生和代谢,是正常细胞生长、分化和增殖的关键信号分子[2-3]。迄今,共有23种FGF(FGF1~23)配体,其能够与成纤维细胞生长因子受体(FGFR)结合。目前仅发现4种人类FGFR:FGFR1至FGFR4。近期,还发现了FGFR5,但尚不清楚该受体的功能[4]。
自噬是一种被高度调控的细胞压力应答过程[5]。研究[6]表明,自噬在肿瘤发生发展过程中扮演着重要作用。一方面,在肿瘤中通常可以检测到自噬相关基因的缺失和突变,表明自噬有抑制肿瘤的作用[7-8]。另一方面,肿瘤细胞可以通过自噬途径降解脂滴和线粒体等方式回收营养物质,减少能量消耗,有利于肿瘤细胞存活[9]。
诸多研究[10]表明,FGFs过表达与恶性肿瘤的发生相关,如胰腺癌、结肠癌、乳腺癌、胃癌和肝癌等。FGF19属于FGF家族中的一员,属于内分泌作用亚家族,调节组织修复后期阶段的代谢,和其同源基因FGF15一同调节肝脏中的胆汁酸代谢,与FGFR4特异性结合后才能发挥其生物学效应[11]。目前,研究[12]发现,FGF19在诸如食管鳞癌、结肠癌和乳腺癌等实体瘤中高表达,与肿瘤发生密切相关,但FGF19对肿瘤细胞自噬的调节鲜见报道。本研究拟以肝癌细胞HepG2和胃癌细胞MKN45为模型,探讨FGF19在调控肿瘤细胞增殖和自噬中的作用。
1 材料与方法
1.1 材料及仪器
1.1.1 实验材料 人肝癌细胞HepG2由成都医学院张涛副教授惠赠,胃癌细胞MKN45来源于中科院上海细胞库。
1.1.2 药物与试剂 DMEM/HIGH GLUCOSE(美国HyClone),RPMI-1640(美国HyClone),PageRuler Prestained Protein Ladder (美国Thermo),FGF19重组蛋白(上海信裕生物科技有限公司),CCK-8试剂盒(上海贝博生物),pAb anti-LC3B(日本MBL),SQSTMI Rabbit PolyAb (美国Proteintech),羊抗兔(LC3)/羊抗鼠(β-actin)二抗,FITC标记山羊抗兔IgG(北京中杉金桥生物技术有限公司),伊曲康唑(萨恩化学技术上海有限公司)。
1.1.3 主要仪器 电热恒温水浴锅(上海跃进S.HH.W21-600-II),离心机(美国Thermo),电子天平(JY5002,上海),超净工作台(日本Airtech),液氮罐(成都金凤液氮罐),制冰机(意大利Castel MAC),恒温摇床(江苏QILINBETER),pH计(phs-320,成都试剂方舟科技有限公司),漩涡震荡仪(北京HYQ-2121A),凝胶成像系统(上海Bio-Rad),灭菌锅(上海申安医疗器械厂),荧光倒置相差显微镜(日本Olympus),纯水仪(成都SARTORIUS),干燥箱(上海齐欣科学仪器厂),-20 ℃冰箱(荣事达BCD-265)、-80 ℃冰箱(美菱BCD-238),程序降温盒(美国Nalgene),蛋白质印迹装置(上海Bio-Rad),冷冻离心机(美国Thermo),CO2恒温培养箱(美国Thermo),酶联免疫检测仪(上海Bio-Rad)。
1.2 实验方法
1.2.1 细胞增殖情况的测定 1)光镜下观察增殖 取对数生长期细胞,加入六孔板中(6×105/孔 、2 mL/孔),于37 ℃、5% CO2恒温培养箱中培养。待细胞贴壁后,在六孔板中分别加入2 mL新鲜培养基(对照组)及不同浓度FGF19重组蛋白,置于37 ℃、5% CO2恒温培养箱中培养24 h。光学显微镜下观察并拍照。2)CCK-8检测细胞增殖 取对数生长期的细胞加入96孔板中(2×103/孔、200 μL/孔),于37 ℃、5% CO2恒温培养箱中培养。待细胞贴壁后,吸出96孔板中的培养基,分别加入200 μL新鲜培养基及不同浓度FGF19重组蛋白工作液,置于恒温培养箱中培养24 h, 然后按照CCK-8试剂盒说明书检测细胞增殖情况。
1.2.2 免疫印迹 取对数生长期细胞,加入六孔板中(6×105/孔、2 mL/孔),置于37 ℃、5%CO2恒温培养箱中培养。待细胞贴壁后,在六孔板中分别加入2 mL新鲜培养基(对照组)及不同浓度FGF19重组蛋白。置于37 ℃、5%CO2恒温培养箱中培养24 h后收集细胞。用Ripa裂解液裂解细胞,提取蛋白。用12%的SDS-PAGE对蛋白(40 μg)进行电泳及转膜,将转好的PVDF膜用2%的脱脂奶粉封闭37 ℃,1 h,然后一抗4 ℃孵育过夜。TBST洗3次,每次10 min。二抗37 ℃孵育1 h。TBST洗3次,每次10 min。按照显影液:TBST=1∶3比例稀释,曝光机上曝光成像。
1.2.3 免疫荧光 1)FGF19重组蛋白处理细胞:取对数生长期细胞,加入已铺好爬片的24孔板中(1×104/孔、1 mL/孔),于37 ℃、5% CO2恒温培养箱中培养。待细胞贴壁,按照不同条件处理细胞后,将24孔板置于37 ℃、5% CO2恒温培养箱中培养24 h。2)免疫荧光:取出24孔板,使用PBS溶液进行洗涤,然后每孔加入1 mL 4%多聚甲醛固定30 min。PBS洗涤2次,每次1 min。2%Triton X-100处理15 min。PBS洗涤2次,每次1 min。5%脱脂奶粉封闭30 min。使用PBS洗涤2次,每次1 min。PBS稀释LC3一抗,比例为1∶200,一抗4 ℃过夜。使用PBS洗涤3次,每次10 min。PBS按照1∶100比例稀释FITC标记山羊抗兔IgG二抗,置于37 ℃孵育1 h,从二抗开始全程避光操作。使用PBS洗涤2次,每次10 min。在载玻片上滴加少量甘油,将爬片取出附于其上,使用荧光显微镜进行拍照并观察荧光斑点的数量。
1.3 统计学方法
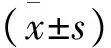
2 结果
2.1 加药后细胞生长情况
加入不同浓度FGF19重组蛋白处理24 h后,HepG2细胞生长情况与对照组HepG2细胞生长情况比较,差异有统计学意义。在10×放大倍数的显微镜下观察:加入FGF19重组蛋白浓度为50 ng/mL的HepG2细胞生长与对照组比较,差异无统计学意义;加入浓度为100 ng/mL的FGF19重组蛋白培养24 h后,相较于对照组,HepG2细胞数量明显增加。在20×放大倍数的显微镜下亦能得到相同的结论。当FGF19重组蛋白浓度为50 ng/mL、培养24 h对HepG2细胞未有较明显的促进或抑制作用; 当FGF19重组蛋白浓度为100 ng/mL、培养24 h时对HepG2细胞有明显促进增殖的作用(图1)。在胃癌细胞MKN45中,结果表明,FGF19处理能促进其增殖。但胃癌细胞MKN45对FGF19的敏感度与HepG2细胞比较稍有差异,结果显示:就MKN45细胞而言,25 ng/mL和50 ng/mL FGF19重组蛋白处理能够促进MKN45细胞增殖,而加入100 ng/mL的FGF19重组蛋白处理48 h后相对于对照组并没有明显的变化(图2)。
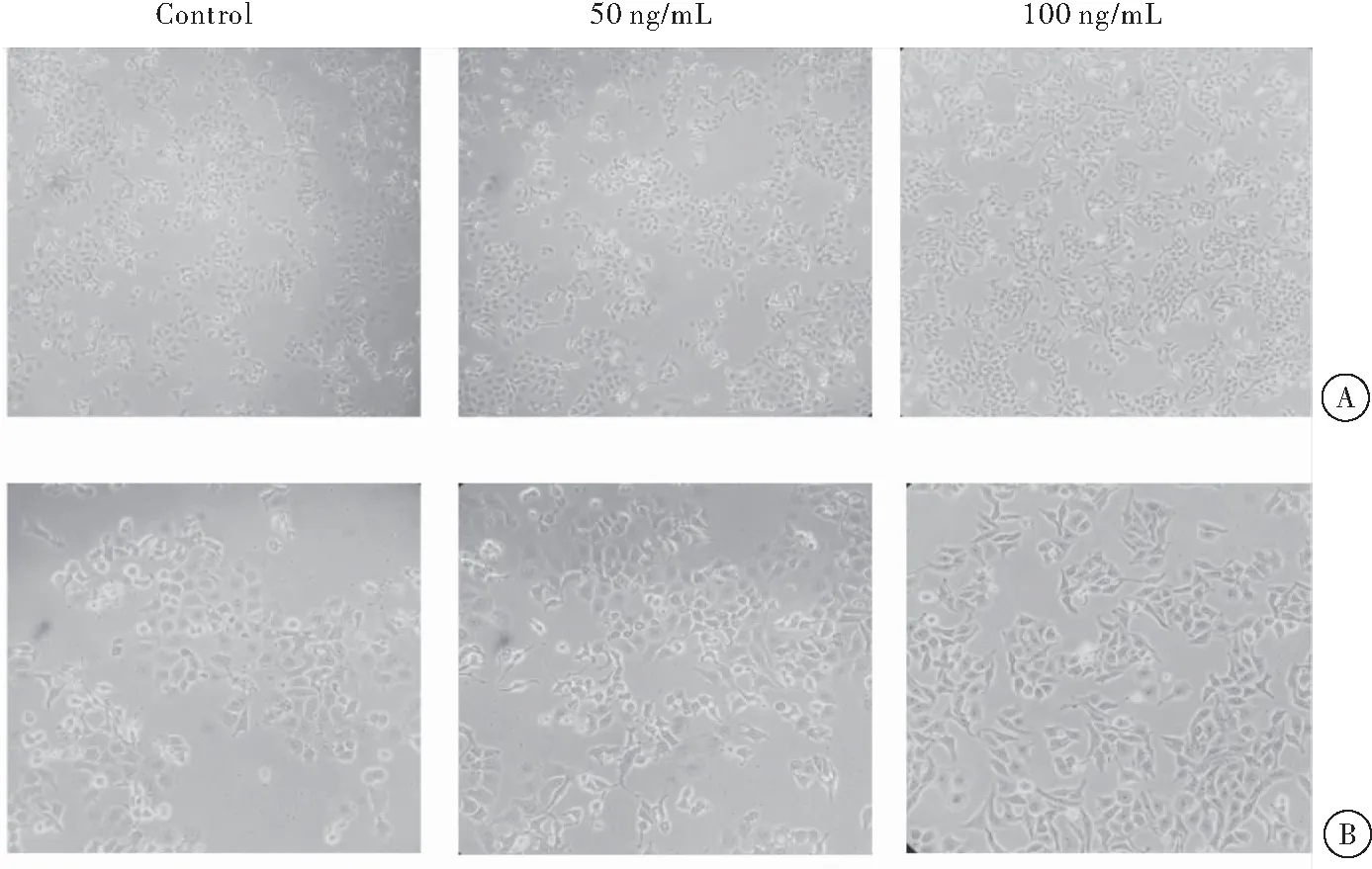
图1 不同浓度FGF19重组蛋白处理24 h后HepG2细胞的生长情况注:A:放大倍数为10×的光学显微镜下的观察结果;B:放大倍数为20×的光学显微镜下的观察结果
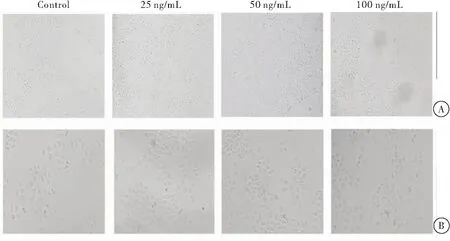
图2 不同浓度FGF19重组蛋白处理48 h后MKN45细胞的生长情况注:A:放大倍数为10×的光学显微镜下的观察结果;B:放大倍数为20×的光学显微镜下的观察结果
2.2 CCK-8检测细胞增殖情况
由于CCK-8试剂的特性,当96孔板内活细胞数目愈多,加入CCK-8后的培养基颜色就越深, 450 nm处OD值越大。可以认为,在相同培养条件及相同时间下,OD值越大,细胞生长速率越快。将所测OD值进行数据分析:当使用浓度为50 ng/mL和100 ng/mL的FGF19重组蛋白处理24 h时OD值明显增大,但加入浓度为200 ng/mL的FGF19重组蛋白处理24 h时,与对照组比较,差异无统计学意义。其中,使用浓度为100 ng/mL的FGF19重组蛋白处理24 h的细胞与对照组比较,差异有统计学意义(P<0.01)(图3)。将测得的MKN45细胞数据进行分析:当使用浓度为25 ng/mL和50 ng/mL的FGF19重组蛋白处理MKN45细胞48 h时OD值明显增大,但加入浓度为100 ng/mL的FGF19重组蛋白处理48 h时与对照组比较,差异无统计学意义。其中,使用浓度为25 ng/mL的FGF19重组蛋白处理48 h的细胞与对照组比较,差异有统计学意义(图4)。CCK8结果显示,FGF19能够促进肿瘤细胞增殖。
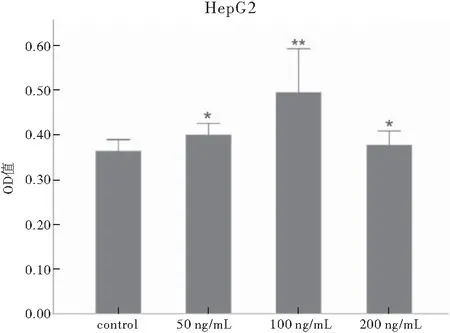
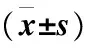
注:*P<0.05,**P<0.01
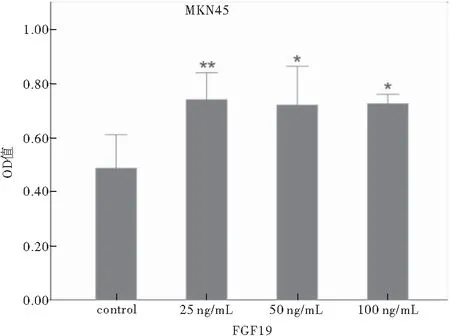
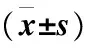
注:*P<0.05,**P<0.01
2.3 免疫印迹检测细胞自噬情况
在自噬体形成过程中,细胞质中的LC3-I和磷脂酰乙醇胺(PE)偶联形成LC3-II,LC3-II定位于自噬体膜上,因而LC3-II的含量或LC3-II/LC3-I比值与自噬体的数量呈正相关,在某种程度上反映了细胞的自噬活性。HepG2细胞在FGF19重组蛋白浓度为50 ng/mL和100 ng/mL时,处理24 h后LC3-II的表达量逐渐降低,但FGF19重组蛋白浓度为200 ng/mL时反而相较于FGF19重组蛋白浓度为100 ng/mL时LC3-II的表达量更多,表明100 ng/mLFGF19重组蛋白处理HepG2细胞能够更明显抑制LC3-II的表达。P62是自噬选择性底物,通过与LC3的相互作用定位于自噬体,而后被自噬-溶酶体系统降解,自噬功能的缺失将导致p62明显集聚。本研究结果显示,100 ng/mL FGF19重组蛋白处理HepG2细胞使p62明显集聚。在胃癌细胞中,同样可以观察到FGF19重组蛋白处理抑制LC3-II的表达(图5)。由此,我们可以得出结论,一定浓度的FGF19能够抑制肿瘤细胞自噬。
2.4 免疫荧光检测自噬情况
在对照组中,可以观察到正常生长24 h的HepG2细胞LC3斑点多于加入浓度为100 ng/mL的FGF19重组蛋白处理24 h后的细胞。此外,采用血清饥饿以及伊曲康唑诱导自噬,而加入FGF19重组蛋白共处理能够减少饥饿或者伊曲康唑诱导的LC3斑点(图6)。
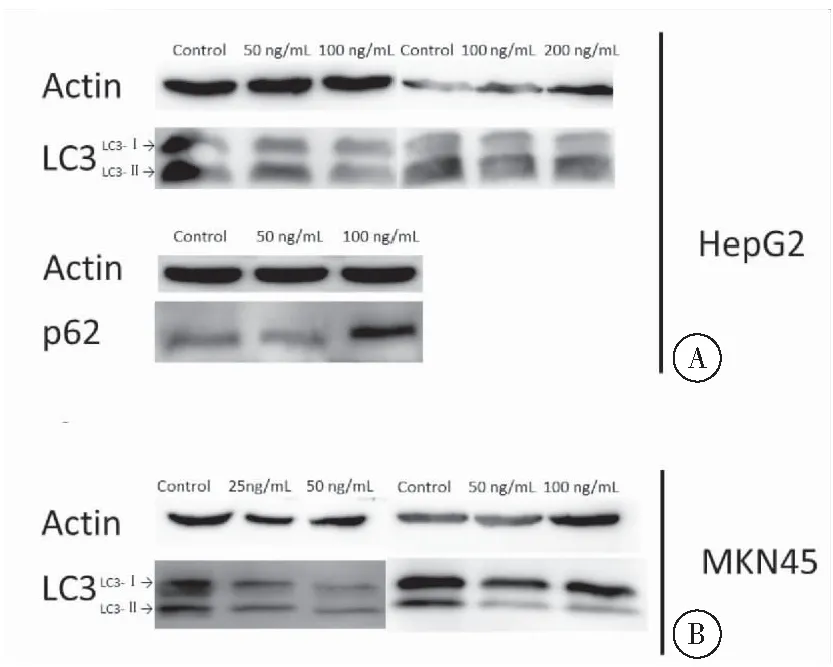
图5不同浓度FGF19重组蛋白处理后细胞内LC3和p62的表达
注:A:浓度50 ng/mL、100 ng/mL和200 ng/mL的FGF19重组蛋白处理24 h时与对照组相比,肝癌细胞HepG2内LC3的表达情况以及浓度50 ng/mL和100 ng/mL的FGF19重组蛋白处理24 h时与对照组相比,肝癌细胞HepG2内p62的表达情况;B:浓度25 ng/mL、50 ng/mL和100 ng/mL的FGF19重组蛋白处理48 h时与对照组相比,胃癌细胞MKN45内LC3的表达情况
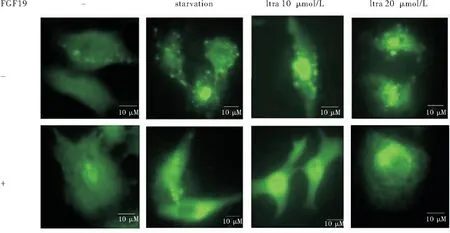
图6免疫荧光检测不同处理条件下HepG2细胞内LC3斑点的数量
注:处理时间24 h, FGF19浓度为100 ng/mL。 Starvation:血清饥饿;Itra:伊曲康唑
3 讨论
大量研究[13]表明,FGF/FGFR信号通路的失调将会导致肿瘤的发生发展,这已经在多种肿瘤细胞中被证实。FGFR4差别于FGFR1-3,在正常组织中仅在发育早期大量表达,在许多肿瘤组织内高表达,通过启动信号级联如STAT3、MAPK和PI3K/AKT等来调节细胞的增殖、分化和迁移[14]。FGF19作为FGFR4的配体,在N端具有一个约20个氨基酸大小的典型信号分泌序列,可以分泌到胞外与受体结合发挥作用[15]。
本研究中CCK8检测结果显示,当加入FGF19浓度<100 ng/mL时,随着FGF19浓度的增加,OD值愈大。但当药物浓度为200 ng/mL时,其OD值虽然比对照组数值大,却较药物浓度为100 ng/mL时更小。可以认为,FGF19重组蛋白浓度<100 ng/mL时,FGF19对肝癌HepG2细胞有明显的促进增殖作用,且与FGF19的浓度呈正相关,但超出了这个浓度时,其促增殖效果降低。本研究结果与Miura等[16]报道一致。
另一方面,100 ng/mL FGF19重组蛋白处理导致LC3-II表达降低及p62表达增强。在免疫荧光实验中,由于HepG2细胞自身的自噬水平有限,所以FGF19重组蛋白处理组与对照相比较,抑制LC3斑点的现象并不显著。因此,我们对细胞进行了饥饿及不同浓度伊曲康唑[17]处理,从而外源诱导细胞自噬。结果显示,在重组蛋白浓度为100 ng/mL时,FGF19能明显抑制肿瘤细胞内LC3斑点。在以肝癌细胞HepG2为模型得到一系列数据后,我们又用胃癌细胞MKN45重复进行以上实验过程,但因为胃癌细胞MKN45对FGF19的敏感度与肝癌细胞HepG2不同,故而设计的处理浓度及处理时间不同。但结果也表明,FGF19对胃癌细胞有明显促进增殖的作用,且浓度为25 ng/mL时,效果最显著。
综上所述,两种肿瘤细胞为模型的研究结果表明,一定浓度的FGF19可以促进肿瘤细胞的增殖,抑制其自噬。本研究探讨了FGF19调控肿瘤细胞增殖和自噬的生物学功能,明确了FGF19对肿瘤细胞增殖的促进作用。本研究还首次发现FGF19能够抑制肿瘤细胞自噬,为探索FGF19在肿瘤发生发展中的作用提供了新的思路。
[1]Beenken A, Mohammadi M. The FGF family: biology, pathophysiology and therapy[J]. Nat Rev Drug Discov, 2009, 8(3): 235-253.
[2]Sandhu D S, Baichoo E, Roberts L R. Fibroblast growth factor signaling in liver carcinogenesis[J]. Hepatology, 2014, 59(3): 1166-1173.
[3]Li X, Wang C, Xiao J,etal. Fibroblast growth factors, old kids on the new block[J]. Semin Cell Dev Biol, 2016, 53: 155-167.
[4]Tran T A, Leong H S, Pavia-Jimenez A,etal. Fibroblast Growth Factor Receptor-Dependent and-Independent Paracrine Signaling by Sunitinib-Resistant Renal Cell Carcinoma[J]. Mol Cell Biol, 2016, 36(13): 1836-1855.
[5]Xu J, Dang Y, Ren Y R,etal. Cholesterol trafficking is required for mTOR activation in endothelial cells[J]. Proc Natl Acad Sci USA, 2010, 107(10): 4764-4769.
[6]Liu E Y, Ryan K M. Autophagy and cancer--issues we need to digest[J]. J Cell Sci, 2012, 125(Pt 10): 2349-2358.
[7]Kim M S, Jeong E G, Ahn C H,etal. Frameshift mutation of UVRAG, an autophagy-related gene, in gastric carcinomas with microsatellite instability[J]. Hum Pathol, 2008, 39(7): 1059-1063.
[8]Kang M R, Kim M S, Oh J E,etal. Frameshift mutations of autophagy-related genes ATG2B, ATG5, ATG9B and ATG12 in gastric and colorectal cancers with microsatellite instability[J]. J Pathol, 2009, 217(5): 702-706.
[9]Rubinsztein D C, Codogno P, Levine B. Autophagy modulation as a potential therapeutic target for diverse diseases[J]. Nat Rev Drug Discov, 2012, 11(9): 709-730.
[10] 方科, 苏子剑, 庄建良. FGF19和FGFR4在肿瘤中作用的研究进展[J]. 中国肿瘤外科杂志, 2013, 5(1): 64-67.
[11] 宋倩倩. FGF19--新的代谢调节因子[J]. 医学综述, 2012, 18(21): 3553-3556.
[12] Xu B, Tong N, Chen S Q,etal. FGFR4 Gly388Arg polymorphism contributes to prostate cancer development and progression: a meta-analysis of 2618 cases and 2305 controls[J]. BMC Cancer, 2011, 11: 84.
[13] Powers C J, McLeskey S W, Wellstein A. Fibroblast growth factors, their receptors and signaling[J]. Endocr Relat Cancer, 2000, 7(3): 165-197.
[14] 伍代朝, 陈林, 陈永恒, 等. 靶向FGFR4的抗肿瘤药物研究进展[J]. 肿瘤防治研究, 2017, 44(1): 61-65.
[15] Ornitz D M, Itoh N. Fibroblast growth factors[J]. Genome Biol, 2001, 2(3):3005.1-3005.12.
[16] Miura S,Mitsuhashi N, Shimizu H,etal. Fibroblast growth factor 19 expression correlates with tumooprogression and poorer prognosis of hepatocellular carcinoma[J].BMC Cancer, 2012, 12:56.
[17] Xu J, Dang Y, Ren Y R,etal. Cholesterol trafficking is required for mTOR activation in endothelial cells[J]. Proc Natl Acad Sci USA, 2010, 107(10): 4764-4769.

