SAA与脓毒症进程的相关性及其生物学意义
冯凯 郑燕华 杨鹤鸣 王奎 张刚 岳茂兴, 尹进南
脓毒症是创伤、手术后严重的并发症,是目前外科和急诊重要的死亡原因[1]。脓毒症的发病机制复杂,与感染和机体非特异性炎症反应密切相关,引起全身性炎症反应和继发性免疫抑制,最终可导致多器官功能衰竭[2-4]。脓毒症起病急,涉及全身多个系统,各种机体对内外原性刺激交替反应,形成复杂的反应网络,因此目前还没有特异性好、敏感性高的生物标志物来检测脓毒症的发生、发展以及预测预后[5-8]。更因为脓毒症的发生机制没有系统阐明,目前也没有有效的靶点达到个性化的诊断和治疗[9]。笔者建立脓毒症小鼠模型,观察在脓毒症发生发展关键时间点上血清蛋白质组学维度上的变化[10],确定重要的生物标志物,研究其生成来源,发生机制,将有助于脓毒症的诊断、预后和治疗。
材料和方法
一、材料与方法
1.动物模型及分组
雌性C57BL/6小鼠,体重19~23 g,共85只小鼠分为假手术组(Sham组,18只)和盲肠结扎加穿孔组(sepsis组,67只)。分四批次完成实验,第1~3批次,每次20只实验小鼠,3只Sham小鼠,17只sepsis小鼠,手术8 h,取1只Sham,2只sepsis;32 h取1只Sham,2只sepsis;72 h取1只Sham,sepsis全部处死取材。第4批实验,25只实验小鼠,9只Sham,每个时项点取3只。16只sepsis,补足sepsis组各时项只数达到10只左右。
2.实验方法
动物模型参考Remick等[11]建立的方法,假手术组仅行腹部切口与缝合;脓毒症组行盲肠结扎加穿孔(22G针头)。手术前1 d转养于实验室,禁食16 h,自由饮水。研究期间小鼠处于室温20℃的房间,12 h光亮,12 h黑暗循环; 用150~200 μL氯胺酮(100 mg/kg体重)麻醉小鼠,腹部消毒,沿腹下部中线切口,暴露盲肠后,用6.0号手术线在回盲瓣下进行结扎,然后用22G的注射器针头穿透盲肠,从针孔处各挤出一滴肠内容物,将盲肠放回腹腔,缝合切口;假手术组不进行盲肠结扎和穿孔,其它与脓毒症小鼠模型一致。小鼠术后立刻在皮下注射0.1 mL温生理盐水,术后各组动物均自由进食饮水。
3.样本采集
摘除眼球取血,室温静置3 h,于2 500 rpm离心5 min,血清分装,每管300 μL,冻存于-70℃冰箱中备用。
4.病理生理学检测方法
小肠及重要器官病理学检查:Sham及CLP组取回盲部以上一段小肠、肺脏、心脏、肝脏、及肾脏、脾脏全部,10%中性福马林固定,石蜡切片包埋,HE染色,光镜镜检。其余组织液氮保存。
5.iTRAQ检测
iTRAQ检测根据标准流程进行[12],取24个样本,同组同时相4个样本,两两随机等体积混合形成12个样本。12个样本各取一份制成1份混合样本。样品用裂解缓冲液(8M尿素,0.1M TrI HCl,pH值8.5,20mM DTT)溶解,在4℃ 30 000 g离心15 min,取上清,改良Bradford法测定蛋白浓度。取100 μg蛋白使用FASP(filter-aided sample preparation)酶解方法进行酶解[1],并将酶解肽段冻干。
将冻干的肽段用30 μL 0.5M TEAB进行溶解,取出iTRAQ®Reagent-8Plex Multiplex Kit(Apple BioSosits),每组样品对应一个分子量。将标记试剂离心,分别加入70 μL无水乙醇,震荡混匀后高速离心,然后加入到各自对应的酶解液中,充分混匀离心,室温静置反应2 h;然后将肽混合物通过真空离心合并和干燥。混合的ITRAQ标记肽的混合物通过高pH反相色谱分离。
使用岛津LC-20AB HPLC泵系统的高pH反相色谱法,将ITRAQ标记的肽混合物用0.5 mL缓冲液A(20mM甲酸铵,2% ACN,pH值10)组合,并加载到Gemini NX 5U C18 110A 150×4.6 mm(Phenomenex,广州,中国)。将肽以1 mL/min的流速洗脱,缓冲剂A的梯度为10 min,5%~35%缓冲液B(20 mM甲酸铵,98% ACN,pH值10)15 min,35%~80%缓冲液3 min。通过测量214 nm的吸光度监测洗脱,每1 min收集部分。根据峰型和时间共收取10个组分,真空离心浓缩(Rotation vacuum Christ RVC 2-25,德国,Christ公司)。
用50 μL RP-LC A相(5%ACN,0.1%甲酸)溶解,在2 000 g离心10 min,在每个部分中,肽的最终浓度平均为0.5 μg/μL。将8 μL上清液加载到Eksigent ekspert nanoLC 425系统(AB SISEX)上,将肽洗脱到分析C18柱(内径75 μm)内。将样品装入3 μL/min 4 min,然后从8%~25% B(ACN,0.1% FA)开始,在600 nL/min下运行45 min梯度,随后15 min线性梯度为80%,在80% B处维持5 min。
采用Triple TOF 6600(Applied Biosystem,USA)系统进行数据采集。使用2.4 kV的离子喷涂电压,MS扫描范围350~1 500 (m/z),累积时间0.25 s,MS/MS扫描范围(m/z)100~1 500,扫描模式为HS高灵敏度模式,累积时间0.05 s,IDA采集模式,一个MS1图谱最多选择40个最强的母离子进行串级扫描。动态排除时间设为18 s,IDA Advanced参数设为“rolling collision energy (CE)” and “Adjust CE when using iTRAQ Reagent”[13]。
质谱产生的原始数据wiff和scan文件通过ProteinPilot 5.0(AB Sciex)进行定量分析。数据库为uniprot下载的小鼠数据库。搜索参数包括:样本类型=iTRAQ 8PLEX(肽标记),半胱氨酸烷基化=碘乙酰胺,消化=胰蛋白酶。采用矫正后P值分析作为鉴定标准。设定1.5倍的截断,以确定上调和下调的蛋白质。
6.组织mRNA检测
取约50 mg液氮冻存组织用于提取总RNA,操作方法参照Trizol试剂说明书(美国,Invitrogen公司),经NanoDrop 1000紫外分光光度计检测浓度后,取1 μg总RNA用于合成cDNA。试剂采用PrimeScriptTMRT试剂盒(RR037A,TAKARA公司),方法参照试剂盒说明书进行。接着,SYBR Premix Ex TaqTM II试剂盒(RR820A,TAKARA公司)用于荧光定量PCR,操作方法参照试剂盒使用说明书。PCR反应体系包括10 μL SYBR混合液,0.4 μL上下游引物,引物序列为F-5’AGAAAATCAGTGATGG AAGAGAGG3’,R-5’CCAGCACAACCTACTGAGC3’,ROX参照染料,2 μL cDNA模板,6.8 μL H2O。反应条件:95℃ 30 s预变性,95℃ 5 s,60℃40 s,40个循环。之后按仪器的默认程序进行溶解曲线。PCR反应在ABI7500定量PCR仪(Applied Biosystems,USA)上进行。mRNA定量采用相对定量法,结果按2-ΔΔCt进行计算。内参采用GAPDH(中国,生工公司)。
7.统计学方法
统计分析在R软件进行(版本号:3.3.1),生存曲线分析采用survival和survminer包,绘制Kaplan-Meier生存曲线观察两组生存曲线,并用Log Rank法比较sepsis组与Sham组的生存曲线是否有差异。热图绘制采用pheatmap包,聚类分析采用系统聚类法。mRNA多组比较采用非参法,软件包为“ggpubr”“ggsci”,qPCR值RQ值取自然对数,组间比较Wilcoxon法比较,组内比较采用Kruskal-Wallis法。
结 果
一、CLP小鼠一般情况分析
1.小鼠一般情况及生存曲线
共85只小鼠,67只行CLP手术,18只为假手术组,假手术组仅行腹部切口与缝合,总体病死率约60%,脓毒症组死亡50%的时间约为手术后28 h。小鼠术后30 min内逐步清醒,爬动。8 h脓毒症逐渐明显,C57BL/6小鼠明显,行动迟缓,目光呆滞,毛竖立,无光泽。呼吸窘迫,呼吸频率明显加快。死亡数量从12 h后逐渐开始并增多,高峰在16~24 h,20 h后部分sepsis小鼠开始进食,此时仍不稳定,还有脓毒症小鼠死亡,32 h后,进入康复期,不再发生死亡,72 h饮食、外观、活动已完全恢复正常。对两组生存曲线整体比较的Log Rank检验结果显示,脓毒症组与假手术组生存率差异有统计学意义(P<0.05)。图1。
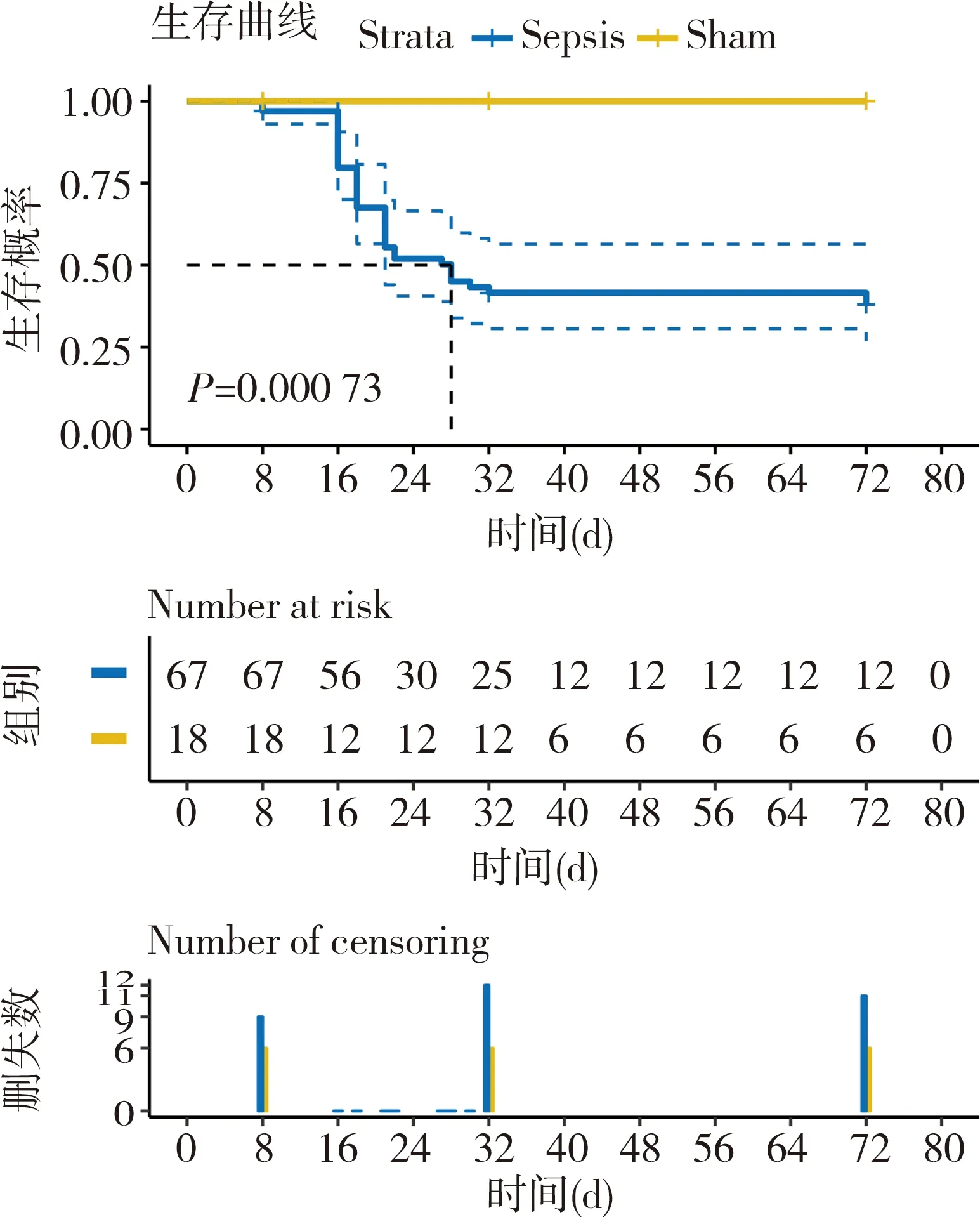
图1 生存曲线
2.CLP死亡小鼠病理情况
死亡小鼠进行了病理观察,小鼠肺组织肺泡毛细血管及肺间质充血,间隔水肿,炎症细侵润,可见出血,微血栓形成和肺间质水肿。肝脏部分肝细胞核固缩,肝细胞浊钟,脂肪变性明显。局部可见小片状肝细胞坏死。肾脏可见中度肾小管上皮细胞损伤,部分细胞核凝固,甚至消失。
二、iTRAQ技术定量检测不同时间CLP小鼠蛋白组表达差异。
本研究12个样本,分两个反应进行,每次反应每组各加一个mix,两组鉴定的蛋白数量分别为1 038和937个。质谱产生的原始数据wiff和scan文件通过ProteinPilot 5.0(AB Sciex)进行定量分析,通过检索数据库为uniprot下载的小鼠数据库,获得蛋白的名称。蛋白表达具有时间和空间特异性,在两个不同条件下,表达水平存在显著差异的蛋白称之为差异表达蛋白(DEP)。差异表达分析得到的蛋白集合叫做差异表达蛋白集,使用 “A-vs-B”的方式命名。根据两(组)样品之间表达水平的相对高低,差异表达蛋白可以划分为上调蛋白(up-regulated protein)和下调蛋白(down-regulated protein)。上调蛋白在样品(组)A中的表达水平高于样品(组)B中的表达水平;反之为下调基因。上调和下调是相对的,由所给A和B的顺序决定在差异表达基因检测过程中,将FoldChange>1.2且P-Value<0.05(方差分析)作为筛选标准。差异倍数(Fold Change)表示两样品(组)间表达量的比值。上述差异蛋白在脓毒症组和假手术组同时获得鉴定并定量,并且三个时间项都有数据者纳入本次研究,共获得13个蛋白,两组内不同时间项的组间比较见表1,两组间相同时间项的比较见表2。
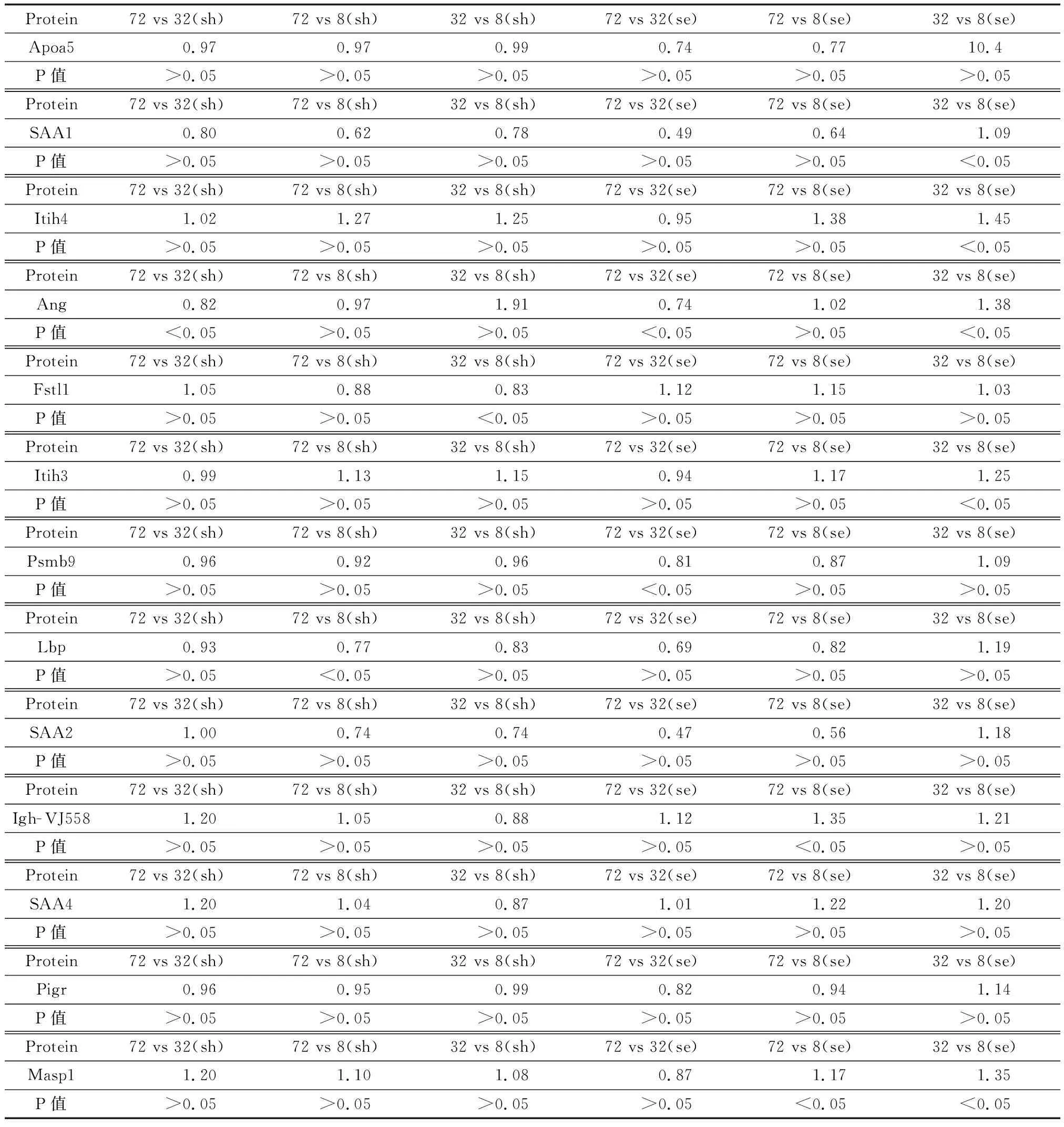
表1 假手术组与脓毒症组不同时项组间比较(sh,假手术组;se,脓毒症组)
注:Apoa5为载脂蛋白A-V(Apolipoprotein A-V),SAA1为血清淀粉样蛋白A-1(Serum amyloid A-1 protein),Itih4为α-胰蛋白酶抑制剂,重链4(Inter alpha-trypsin inhibitor, heavy chain 4),Ang为血管生成素(Angiogenin),Fstl1为卵泡抑素相关蛋白1(Follistatin-related protein 1),Itih3为α-胰蛋白酶抑制剂,重链3(Inter-alpha-trypsin inhibitor heavy chain H3),Psmb9为蛋白酶体亚单位β9型(Proteasome subunit beta type 9),Lbp为脂多糖结合蛋白(Lipopolysaccharide-binding protein),SAA2为血清淀粉样蛋白A-1(Serum amyloid A-2 protein),Igh-VJ558为免疫球蛋白重链(J558家族)[immunoglobulin heavy chain (J558 family)],SAA4为血清淀粉样蛋白A-4(Serum amyloid A-4 protein),Pigr为聚合免疫球蛋白受体(Polymeric immunoglobulin receptor),Masp1为甘露聚糖结合凝集素丝氨酸蛋白酶1(Mannan-binding lectin serine protease 1)
注:Apoa5为载脂蛋白A-V(Apolipoprotein A-V),SAA1为血清淀粉样蛋白A-1(Serum amyloid A-1 protein),Itih4为α-胰蛋白酶抑制剂,重链4(Inter alpha-trypsin inhibitor, heavy chain 4),Ang为血管生成素(Angiogenin),Fstl1为卵泡抑素相关蛋白1(Follistatin-related protein 1),Itih3为α-胰蛋白酶抑制剂,重链3(Inter-alpha-trypsin inhibitor heavy chain H3),Psmb9为蛋白酶体亚单位β9型(Proteasome subunit beta type 9),Lbp为脂多糖结合蛋白(Lipopolysaccharide-binding protein),SAA2为血清淀粉样蛋白A-1(Serum amyloid A-2 protein),Igh-VJ558为免疫球蛋白重链(J558家族)[immunoglobulin heavy chain (J558 family)],SAA4为血清淀粉样蛋白A-4(Serum amyloid A-4 protein),Pigr为聚合免疫球蛋白受体(Polymeric immunoglobulin receptor),Masp1为甘露聚糖结合凝集素丝氨酸蛋白酶1(Mannan-binding lectin serine protease 1)
聚类分析显示,蛋白可以根据时间顺序可划分为三组(图2),对比第一组蛋白和脓毒症生存曲线,发现该组蛋白在脓毒症组8 h和32 h高表达,而在假手术组中没有升高,表明该组蛋白是脓毒症特异的标志蛋白,与脓毒症小鼠死亡高峰时间完全匹配,当小鼠渡过危险期,该组蛋白在72 h也已经恢复到和对照组相同水平。这组蛋白中SAA1和SAA2最为明显,可以作为脓毒症检测和预后的生物标志分子。另外两组蛋白显示假手术组和脓毒症组趋势相近。见图3(每组选择2个蛋白作为代表)。
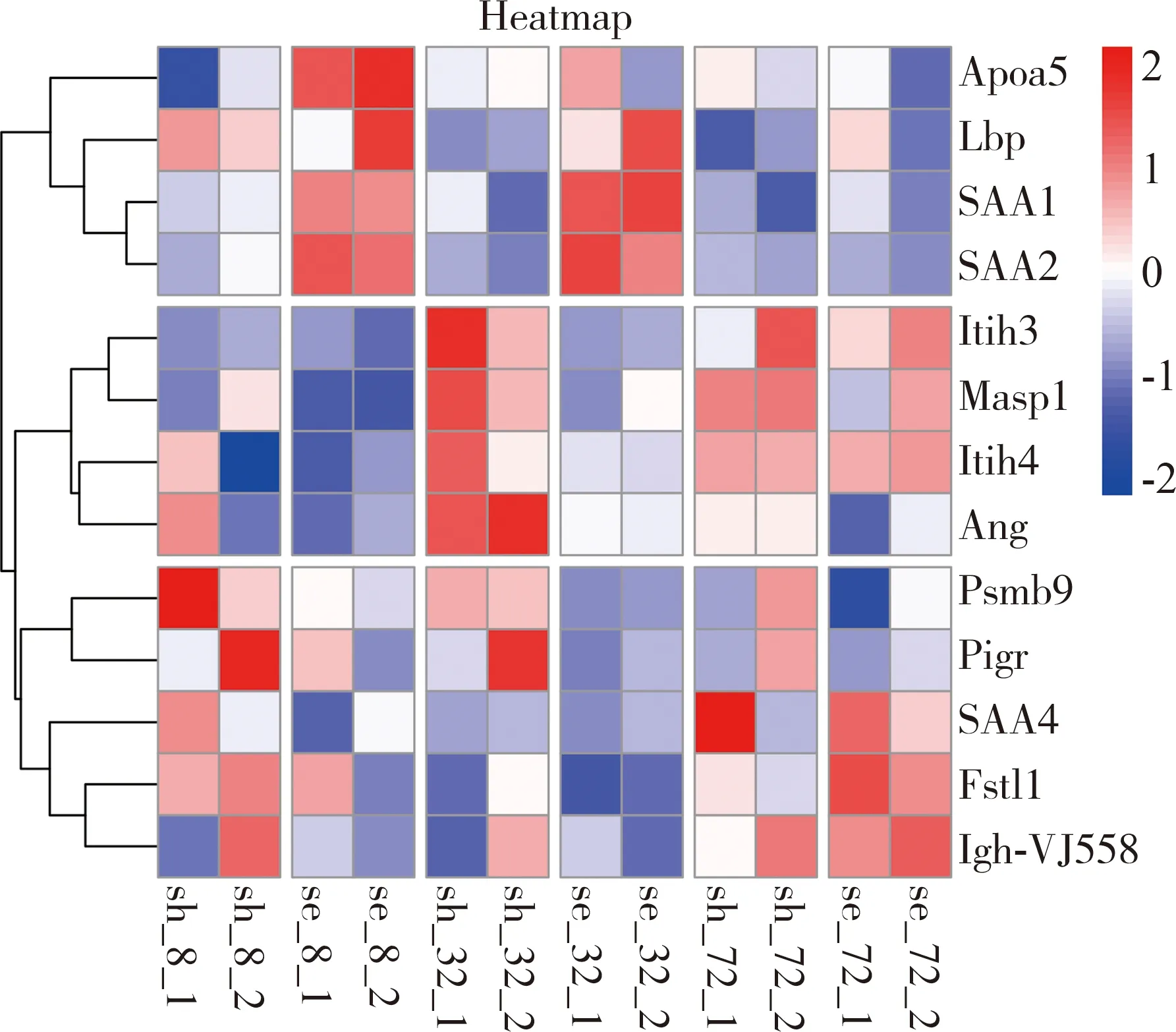
图2CLP小鼠模型血清蛋白聚类热图。(横坐标,重复样本,sh代表假手术组,se代表脓毒症组,第一个“—”后代表时间,第二个“—”代表重复样本;纵坐标为k-mean聚类树状图)
注:Apoa5为载脂蛋白A-V(Apolipoprotein A-V),Lbp为脂多糖结合蛋白(Lipopolysaccharide-binding protein),SAA1为血清淀粉样蛋白A-1(Serum amyloid A-1 protein),SAA2为血清淀粉样蛋白A-1(Serum amyloid A-2 protein),Itih3为α-胰蛋白酶抑制剂,重链3(Inter-alpha-trypsin inhibitor heavy chain H3),Masp1为甘露聚糖结合凝集素丝氨酸蛋白酶1(Mannan-binding lectin serine protease 1),Itih4为α-胰蛋白酶抑制剂,重链4(Inter alpha-trypsin inhibitor, heavy chain 4),Ang为血管生成素(Angiogenin),Psmb9为蛋白酶体亚单位β9型(Proteasome subunit beta type 9),Pigr为聚合免疫球蛋白受体(Polymeric immunoglobulin receptor),SAA4为血清淀粉样蛋白A-4(Serum amyloid A-4 protein),Fstl1为卵泡抑素相关蛋白1(Follistatin-related protein 1),Igh-VJ558为免疫球蛋白重链(J558家族)[immunoglobulin heavy chain (J558 family)]
三、CLP小鼠SAA1在不同组织中的表达
采用qPCR法检测了CLP模型小鼠,三种组织的SAA1mRNA表达,所有数据经过取log处理,并采用非参数方法比较。结果如图4显示,正常情况下SAA1mRNA在各组织不表达,在创伤后肝组织SAA1mRNA表达水平8 h已经明显增高,而且直到72 h脓毒症组仍然高表达,假手术组开始下降。肝外组织则不同,肺组织脓毒症组8 h明显增高,而32 h达到峰值,72 h恢复到正常水平,假手术组肺组织SAA1mRNA表达水平保持不变。小肠组织SAA1mRNA表达,脓毒症组在32 h才有显著增高,72 h又恢复正常,假手术组肺组织SAA1mRNA表达水平保持不变。由此可见,肝脏是小鼠SAA1的主要合成场所,其表达水平可达肝外组织的近1 000倍。肝组织合成SAA1在创伤后开始,假手术组与脓毒症组同步升高,幅度相近,只在脓毒症小鼠恢复期显示出与假手术组的差异。肝外组织表达SAA1的表达特异性的与脓毒症进程同步,8 h显著增高,峰值在32 h,与创伤无关。对比血清蛋白SAA1的蛋白水平和mRNA的组织表达数据可知,血清中检测的SAA1蛋白可能来自于肝外组织,一是因为对照假手术组血清中检测不到SAA1蛋白水平随创伤发生进程的变化,但肝内SAA1mRNA 8 h已经表达,而且逐步增高,量级很大。二是脓毒症组和假手术组肝SAA1mRNA表达72 h仍然处于高位,脓毒症组比32 h水平还显著提高,但血清SAA1蛋白已经恢复到正常水平。因此,不排除肝外组织生成的SAA1释放入血,特别是肺组织。肝内组织合成大量的SAA1,是以与HDL结合的方式进入外周血,在脓毒下时可能也有部分脱离HDL以单体形式进入外周血。
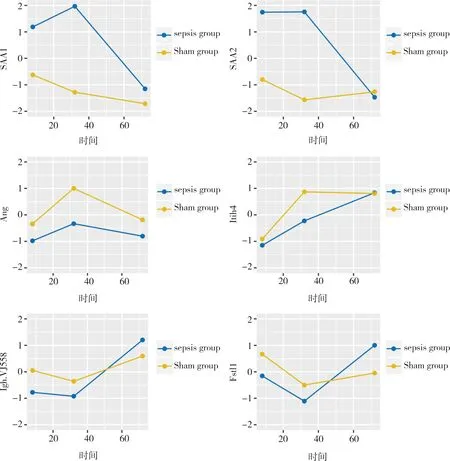
图3 血清蛋白表达相对强度与脓毒症进程的关系
注:横坐标为时间,单位:h,纵坐标为表达相对强度,所以相对表达强度经过标准化处理,1组(A,B),2组(C,D),3组(E,F);SAA1为血清淀粉样蛋白A-1(Serum amyloid A-1 protein),SAA2为血清淀粉样蛋白A-1(Serum amyloid A-2 protein),Ang为血管生成素(Angiogenin),Itih4为α-胰蛋白酶抑制剂,重链4(Inter alpha-trypsin inhibitor, heavy chain 4 ),Igh-VJ558为免疫球蛋白重链(J558家族)[immunoglobulin heavy chain (J558 family)],Fstl1为卵泡抑素相关蛋白1(Follistatin-related protein 1 )
讨 论
脓毒症是创伤、手术后严重的并发症,发病机制复杂,与感染和机体非特异性炎症反应密切相关,目前还缺乏对脓毒症特异性的诊断和监测的生物标志分子,本研究拟通过定量蛋白质组学的方法,发现并鉴定重要的生物标志分子,为脓毒症诊断和预后提供重要的靶标。结果显示,CLP小鼠在脓毒症发病进程中,4 h后出现脓毒症症状,8 h后开始出现死亡,12~24 h是死亡发生的集中时间,24 h后死亡减少,50%死亡发生时间约为28 h,总死亡率约60%。对死亡小鼠进行病理学观察发现,肺,肝,肾组织都发生病变。
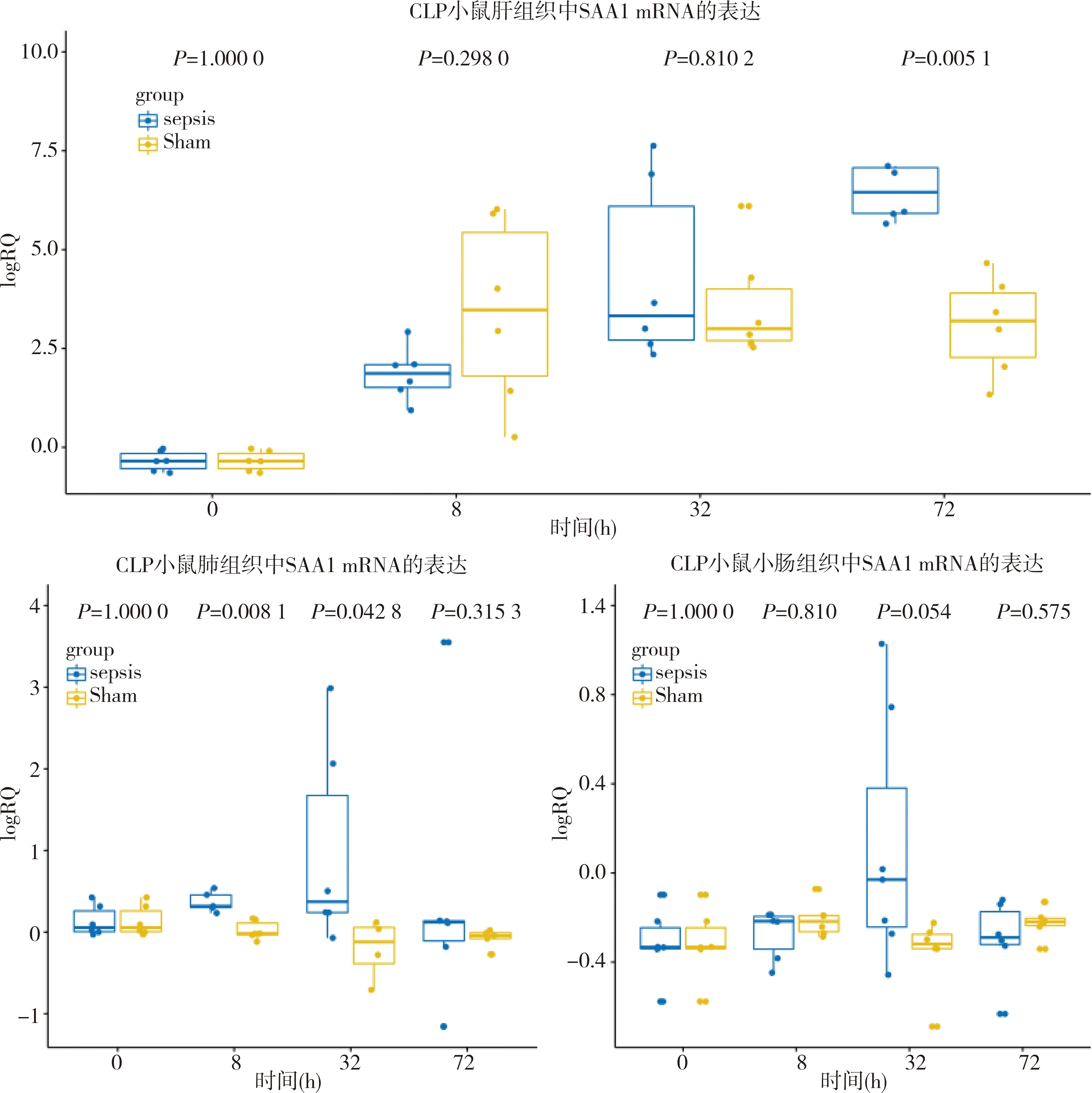
图4 CLP小鼠组织SAA1 mRNA表达
同位素标记相对和绝对定量(isobaric tags for relative and absolute quantification,iTRAQ) 技术是由AB SCIEX公司研发的一种体外同种同位素标记的相对与绝对定量技术[14]。该技术利用多种同位素试剂标记蛋白多肽N末端或赖氨酸侧链基团,经高精度质谱仪串联分析,可同时比较多达8种样品之间的蛋白表达量,是近年来定量蛋白质组学常用的高通量筛选技术。笔者利用iTRAQ技术对血清蛋白质组进行定性定量分析,共鉴定到1 000余种血清蛋白,并通过筛选重点鉴定了13个在脓毒症组和假手术组不同时间点上组内变化和组间变化都非常显著的血清蛋白。对上述血清蛋白聚类分析发现,以SAA 1和SAA 2为代表的一组蛋白,与脓毒症的进程密切相关,而与对照假手术组无关。人类SAA被视为一种急性时相反应蛋白,SAA家族是包括SAA1,SAA2,SAA3,SAA4的一组基因,串联定位于11号染色体[15],形成一个基因簇,其中SAA3为假基因,SAA1,SAA2被称为急性识相反应SAA(A-SAA),SAA4认为是构成性表达的SAA(C-SAA)。SAA1,SAA2基因的结构非常相似,只相差几个碱基,一般认为是基因复制的产物。小鼠SAA家族基因定位在7号染色体[16]。由于SAA(SAA1和SAA2)只相差少量碱基,其产物无论是在mRNA水平还是蛋白水平的检测都难以区分,基于一般抗体的检测方法和PCR的检测方法检测的都是二者的混合物[17]。本研究采用质谱法,在蛋白水平能够有效鉴定和区分SAA家族的每一种蛋白。同时质谱法检测的SAA是游离形态的单体,这一点与基于抗原抗体法的检测方法有所不同(检测的是SAA与HDL的复合物)。本研究qPCR法mRNA检测的任然是二者的混合物,但根据本研究的结果可知,小鼠血清蛋白中SAA1和SAA2表达的量级和时项基本一致,以SAA统称并不影响其应用价值。
SAA作为血清急性时相反应蛋白,发现较早,在炎症、感染和创伤后升高[18],其主要机制一直不够清晰。研究认为肝脏是产生SAA的主要组织,其他组织也可少量合成,合成后其在肝内主要与HDL结合通过血液转运到肝外SAA[19]。目前尚不清楚有多少血清中SAA是肝脏合成的,以及血清中游离的SAA与HDL结合的SAA功能上有何不同[17]。目前认为SAA具有多种功能,早期通过细胞因子或LPS通过TLR2激活细胞释放SAA,进一步刺激单核细胞[20],白细胞释放更多炎症因子和化学因子。低浓度SAA可作为某些化学信号分子如CCL2,CCL3,CCL8的招募信号[21-23],这些信号能够诱导更多的白细胞到组织的炎症位点放大炎症效应。同时,高浓度SAA可能针对革兰阴性菌和病毒还有调理素作用[24]。本研究发现,小鼠血清单体形态的SAA1和SAA2与脓毒症进程一致,与假手术无关,进一步对比肝和肝外组织SAA1mRNA的表达水平,发现肝内mRNA的表达脓毒症组与假手术组呈正相关,72 h仍高表达,此时血清中已经检测不到SAA1和SAA2,说明血清中的SAA是肝外组织产生的,肝内组织产生大量的SAA功能上可能与组织损伤修复相关。
综上所述,通过iTRAQ技术,本研究发现一组与脓毒症进程特别是与死亡发生密切相关的蛋白,其中以急性时相反应蛋白SAA1最有代表性,对脓毒症的诊断和预后具有重要价值。

