以橘渣为原料间歇振荡法生产细菌纤维素
杨 颖,唐伟敏,邢建荣,郑美瑜,陆胜民
(浙江省农业科学院 食品科学研究所,浙江 杭州 310021)
细菌纤维素(bacterial cellulose,BC)是通过微生物发酵作用形成的,由β-D- 葡萄糖通过β- 1,4- 糖苷键结合成的直链,又称为β- 1,4- 葡聚糖[1]。BC产生菌较多,其中葡糖酸醋杆菌属的高产菌较多,生产方式主要有静置与振荡培养2种。静置培养时,在培养液表面长出凝胶状厚膜[2-3],因外观类似椰肉,又称“椰果”,具有饱腹感,以及清理肠道与减肥效果,作为配料广泛应用于食品与特殊材料领域[4-9]。连续振荡培养时,根据转速、装液量、培养基成分不同,形成球状、絮状、星状等不同形状的凝胶团,主要作为新奇食品配料或者特殊材料应用[10-13]。
BC生产基质主要有化学培养基与复合培养基2种:化学培养基以HS为代表,价格较贵且产量不高,多用于研究分析[14-15];复合培养基以椰子水、菠萝渣为基质复配,价格较低且产量较高[16-18]。柑橘是世界第一大水果,加工集中度高,橘渣产量大且易于获得,以其为原料生产BC能够充分利用自然资源,是一个值得关注的研究方向。作者在前期研究时从腐败柑橘表面获得1株中间葡糖酸醋杆菌CIs26,橘渣水能够显著提高其BC产量[19]。当其静置培养时,形成的凝胶膜较硬,改变培养方式时发现,静置与短时振荡间歇培养能够形成较疏松的软膜,且持水性、复水性更好,是制备脆嫩型纳塔、药物缓释系统、透气敷料的潜在原料。基于此,本文以CIs26为发酵菌株,采用间歇振荡培养方式,研究以橘渣为基质的培养基复配方案,为扩大BC生产的原料来源、丰富BC生产的工艺条件等提供参考。
1 材料与方法
1.1 主要材料与试剂
发酵菌株:中间葡糖酸醋杆菌(Gluconacetobacterintermedius)CIs26,本实验室自行筛选、鉴定。
橘渣制备:温州蜜柑去皮榨汁。残渣可以立即使用,也可以冷冻保存后解冻使用。
橘渣水的配制:橘渣与水混合打浆,添加果胶酶与纤维素酶,45 ℃保温2 h,800目滤布过滤,所得滤液为橘渣水。
基础培养基:酵母粉5 g,蔗糖30 g,(NH4)2SO45 g,橘渣水1 L,自然pH值,121 ℃灭菌15 min。
HS培养基:参考Hestrin等[20]的配方,121 ℃灭菌15 min。
橘渣水复配HS培养基:以橘渣水替代蒸馏水,其他同HS培养基。
果胶酶(200 000 U·g-1)、纤维素酶(100 000 U·g-1),购于宁夏和氏璧生物技术有限公司;酵母粉购于浙江杭富生物制品厂;常规药品购于华东医药有限公司。
1.2 主要仪器与设备
双层恒温振荡培养箱,上海智诚分析仪器制造有限公司;生化培养箱,上海博讯实业有限公司;Elx800TM全自动酶标仪,美国伯腾仪器有限公司;超低温冰箱,美国NBS公司;LXJ- IIB高容量低转速离心机,上海安亭科学仪器厂;PB- 10精密pH计,赛多利斯科学仪器(北京)有限公司;Quick- Brix90TM糖度计,梅特勒- 托利多国际股份有限公司;85- 2恒温磁力搅拌器,金坛市杰瑞尔电器有限公司;DS- 1高速组织捣碎机,上海标本模型厂。
1.3 试验方法
1.3.1 发酵曲线绘制
180 μL培养基添加于酶标板微孔中,接入活化种子液10 μL,30 ℃摇床培养,每隔1 h 150 r·min-1转动摇床5 min,每6 h测定1次D450,取3组数据平均值绘制发酵曲线。
1.3.2 渣水比选择
橘渣与水分别按质量比1∶2、1∶4、1∶6、1∶8、1∶10及1∶12混合,打浆,过滤,以滤液代替去离子水配制基础培养基,灭菌,接种,按1.3.1节方法绘制发酵曲线。
1.3.3 橘渣酶解条件
橘渣与水混合打浆,添加不同浓度的果胶酶与纤维素酶,45 ℃保温2 h,过滤取滤液复配、灭菌、接种,按1.3.1节方法绘制发酵曲线。
1.3.4 最适碳源及浓度
取橘渣水配制30 g·L-1不同碳源的培养基(蔗糖、葡萄糖、果糖、乳糖、半乳糖、甘露糖、木糖、麦芽糖、阿拉伯糖及鼠李糖),灭菌,接种,按1.3.1节方法绘制发酵曲线。配制不同碳源浓度(30、40、50、60、70、90 g·L-1)的培养基,灭菌,接种,按1.3.1节方法绘制发酵曲线。
1.3.5 最适氮源及浓度
取橘渣水配制5 g·L-1不同氮源的培养基(硫酸铵、蛋白胨、牛肉膏),灭菌,接种,按1.3.1节方法绘制发酵曲线。配制不同氮源浓度(0、1、3、5、7、9 g·L-1)的培养基,灭菌,接种,按1.3.1节方法绘制发酵曲线。
1.3.6 最适酵母粉浓度
取橘渣水配制不同酵母粉浓度(0、1、3、5、7、9 g·L-1)的培养基,灭菌,接种,按1.3.1节方法绘制发酵曲线。
1.3.7 有机酸的影响
取橘渣水配制2 g·L-1不同有机酸种类的培养基(柠檬酸、醋酸、乳酸),灭菌,接种,按1.3.1节方法绘制发酵曲线。配制不同浓度(0、1、2、3、4 g·L-1)有机酸培养基,灭菌,接种,按1.3.1节方法绘制发酵曲线。
1.3.8 最适磷酸氢二钠浓度
取橘渣水配制不同浓度(0、1、2、3 g·L-1)磷酸氢二钠培养基,灭菌,接种,按1.3.1节方法绘制发酵曲线。
1.3.9 BC干重
500 mL三角瓶装150 mL培养液,按1.3.1节方法接种培养,5 d后将BC凝胶取出,无菌水清洗去除杂质,浸泡于0.1 mol·L-1的NaOH溶液中,80 ℃水浴60 min,以去离子水反复浸泡冲洗至中性,85 ℃烘干至质量恒定,称量。
2 结果与分析
2.1 渣水比对发酵的影响
由图1可见,当渣水比为1∶6时D450值最高,此时BC产量也最高,达6.72 g·L-1,其次为1∶8,BC产量为6.03 g·L-1,再次为1∶4,BC产量为5.26 g·L-1,1∶2时发酵液D450值与BC产量均最低。橘渣太浓或者太稀皆不利于BC软凝胶的形成,原因可能是橘渣中含有部分抑制CIs26菌株生长或者限制BC积累的物质,而太稀时橘渣溶液中糖类、维生素、氨基酸及微量元素浓度太低,对菌株生长促进作用不大。本研究选择渣水比为1∶6。
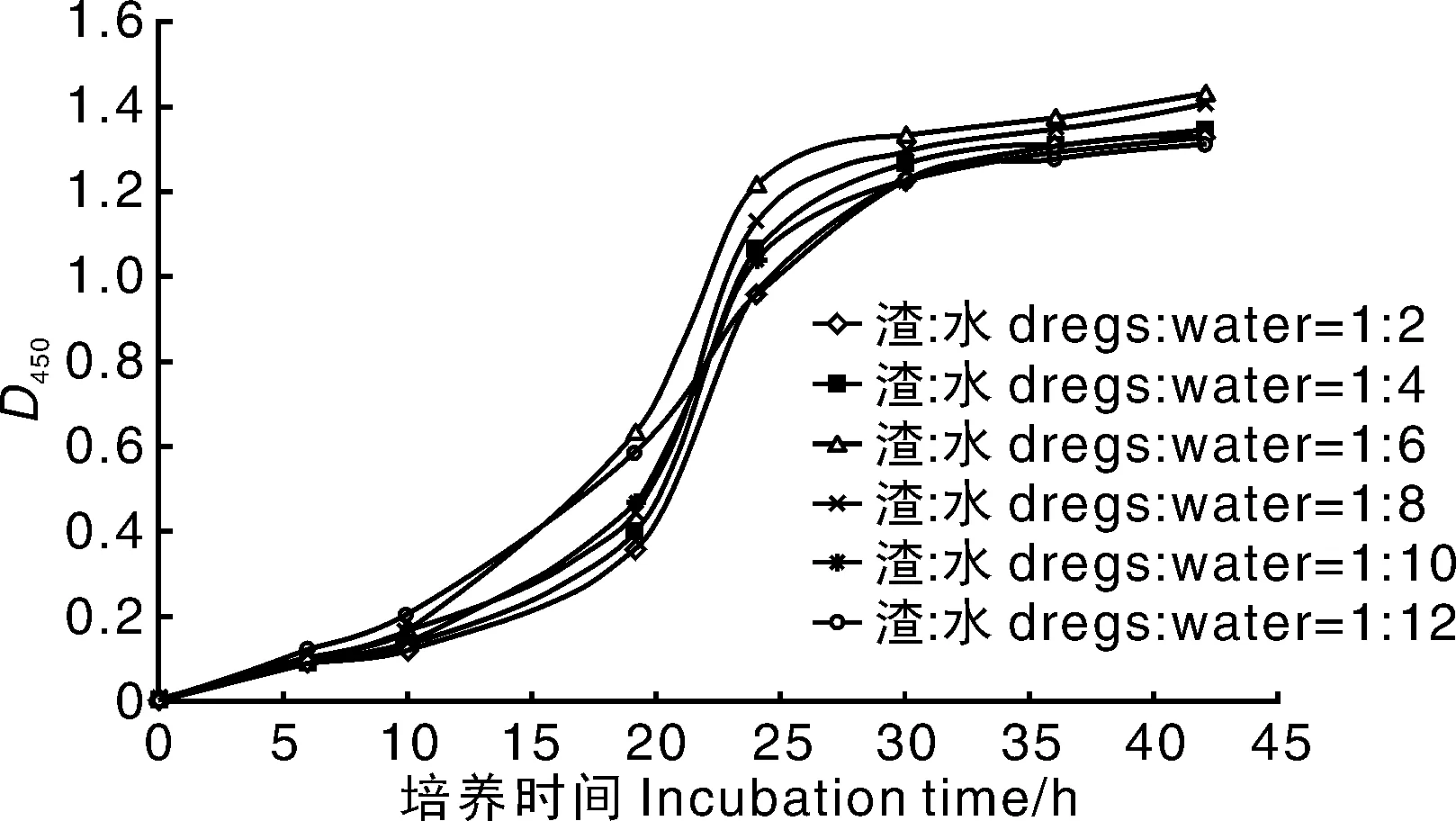
图1 渣水比对CIs26发酵的影响Fig.1 Effects of dregs- water ratio on fermentation of CIs26
2.2 酶处理条件对发酵的影响
橘渣中含有大量的果胶与纤维素,打浆后溶液黏度较高,过滤困难,滤液可溶性固形物含量低,仍剩余30%左右的滤渣需要处理。先以果胶酶对橘渣浆进行降解,再添加不同浓度的纤维素酶进行酶解,研究酶解对CIs26菌株发酵情况的影响,结果如图2所示。
添加0.3 g·L-1果胶酶时发酵液的浊度最高,BC产量也最高,达6.81 g·L-1,选择果胶酶浓度为0.3 g·L-1。果胶酶复配纤维素酶能够有效地提高发酵液的浊度,复配0.1 g·L-1纤维素酶较不复配组BC产量提高了1.51 g·L-1。原因可能是果胶酶与纤维素酶复合酶解,能够充分释放被果胶、纤维素等大分子缠绕包裹的小分子营养物质,同时降低培养液黏度,增加溶氧量。本研究选择0.3 g·L-1的果胶酶复合0.1 g·L-1的纤维素酶对橘渣浆进行酶解。
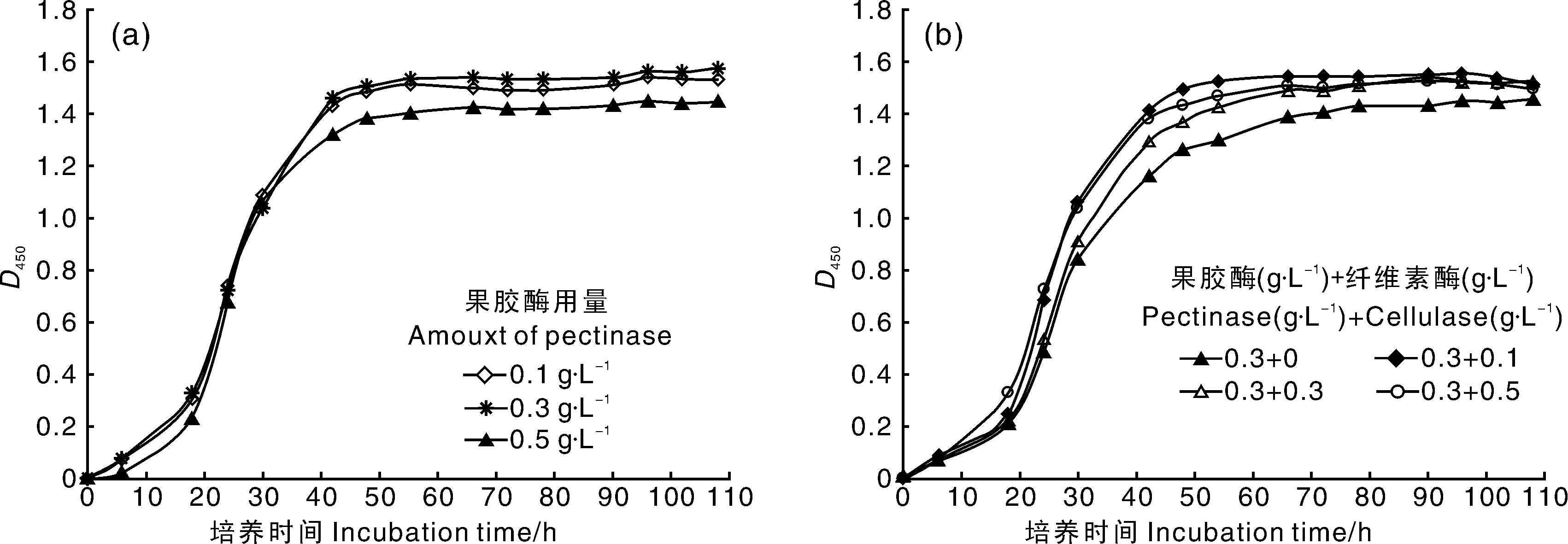
a,单独使用果胶酶;b,果胶酶与纤维素酶复配a, Pectinase only; b. both pectinase and cellulase图2 酶添加比例对CIs26发酵的影响Fig.2 Effects of enzyme amount on fermentation of CIs26
2.3 碳源种类及浓度对发酵的影响
由图3- a可见,CIs26发酵生产BC的最适碳源是葡萄糖,在80 h左右D450即达到最大值,放大培养时其BC产量达8.13 g·L-1,果糖次之,蔗糖紧随其后,甘露醇最差。以葡萄糖为唯一碳源时,CIs26发酵液的D450值迅速上升,到达最高点时缓慢下降,可能与发酵后期有机酸的含量上升有关。当以蔗糖为唯一碳源时,发酵液的D450值到达高点后保持平稳态势,其原因还有待进一步研究。综合考虑发酵效率与产品成本,本研究选择蔗糖为碳源。
由图3- b可见,蔗糖浓度70 g·L-1时发酵液的浊度最高,放大培养时BC产量达8.06 g·L-1,其次为60 g·L-1,30 g·L-1时最低。实际生产时考虑成本问题,可以选择60 g·L-1或70 g·L-1,本研究选择蔗糖浓度为70 g·L-1。
2.4 氮源种类及浓度对CIs26发酵的影响
由图4- a可见,试验所选用的3种氮源对CIs26发酵无明显影响,其中以硫酸铵发酵效果最好,且价格最低,故选择其作为CIs26发酵的氮源。由图4- b可见,硫酸铵浓度对菌株发酵影响相对较小,添加量以3 g·L-1效果较佳。
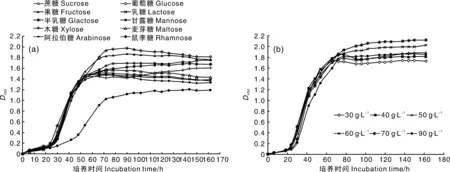
图3 碳源种类(a)和蔗糖浓度(b)对CIs26发酵的影响Fig.3 Effects of carbon sources (a) and sucrose concentrations (b) on fermentation of CIs26
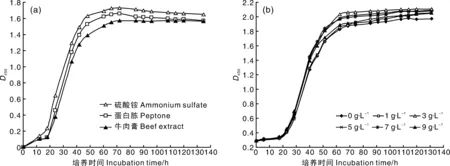
图4 氮源种类(a)及硫酸铵浓度(b)对CIs26发酵的影响Fig.4 Effects of nitrogen sources (a) and ammonium sulphate concentrations (b) on fermentation of CIs26
2.5 酵母粉浓度对CIs26发酵的影响
由图5可见,酵母粉能够有效提高CIs26的发酵效率,且随着其添加浓度升高,发酵液的D450值呈上升趋势,BC产量也由4.31 g·L-1增加至6.57 g·L-1,与静态培养时类似[21],当酵母粉浓度增加至7 g·L-1时上升速度减缓,与9 g·L-1时效果接近。综合考虑发酵效率与生产成本,选择酵母粉浓度为7 g·L-1。
2.6 有机酸种类及浓度对CIs26发酵的影响
由图6可见,醋酸、柠檬酸、乳酸对CIs26发酵均有促进作用,与前期部分研究类似[22]。其原因可能是有机酸能够参与菌体的物质或能量代谢,刺激发酵早期的菌体繁殖,从而提高BC产量。乳酸的效果优于其他2种,其适宜添加量为1 g·L-1,过高不利于BC积累。
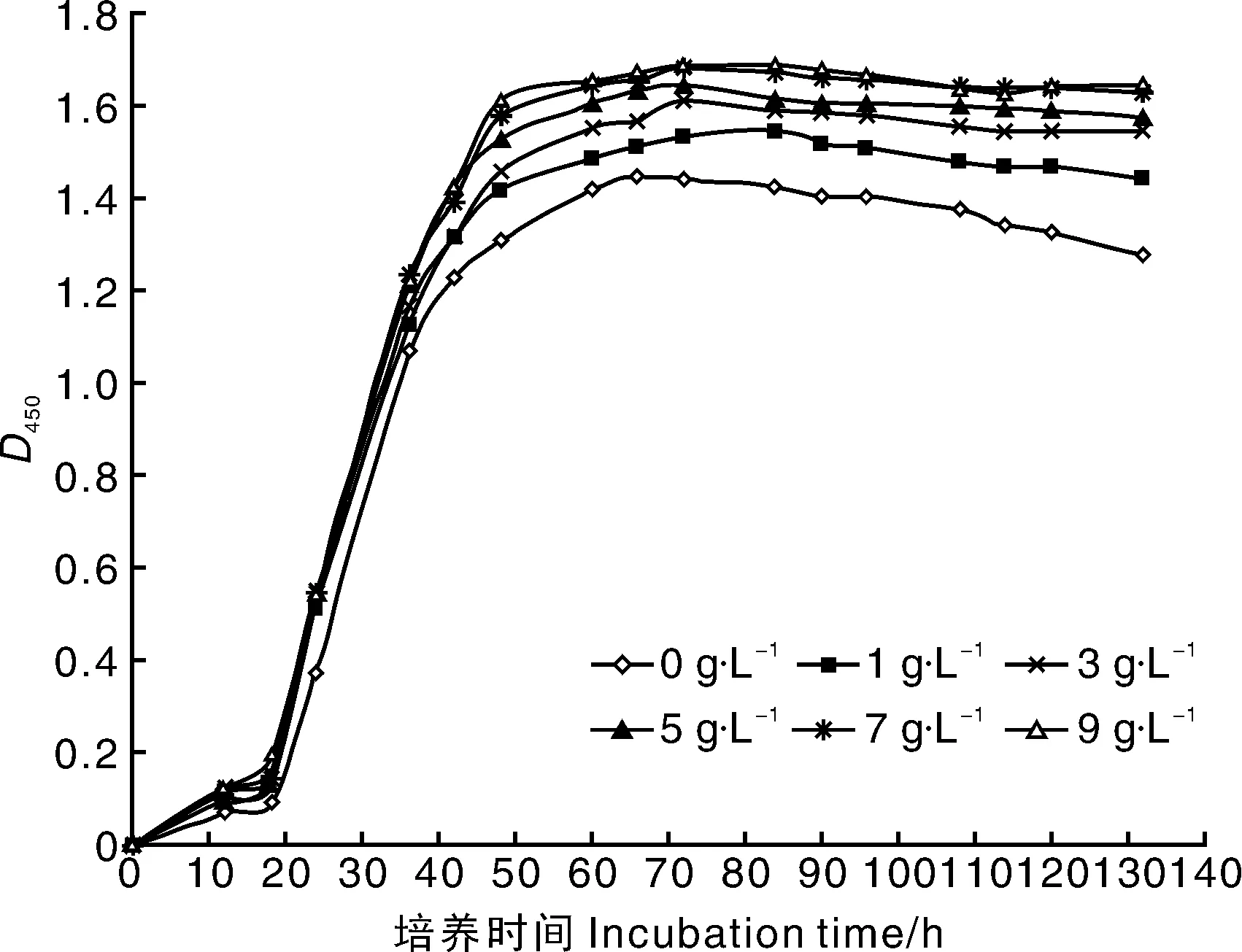
图5 酵母粉浓度对CIs26发酵的影响Fig.5 Effects of yeast extract concentrations on fermentation of CIs26
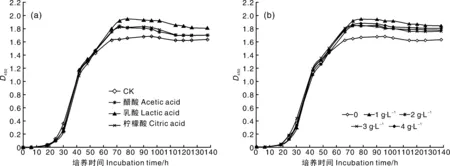
图6 有机酸种类(a)及乳酸浓度(b)对CIs26发酵的影响Fig.6 Effects of organic acids (a) and lactic acid concentrations (b) on fermentation of CIs26
2.7 磷酸氢二钠浓度对CIs26发酵的影响
CIs26在发酵过程中产酸,积累到一定程度会对自身生长、发酵产生抑制作用。由图7可见,添加磷酸氢二钠能促进CIs26的生长,增加发酵液浑浊度。添加2 g·L-1与3 g·L-1时D450值相差不大,故选择磷酸氢二钠添加量为2 g·L-1。
2.8 不同营养条件对CIs26发酵的影响
将活化好的CIs26菌株分别接种于HS培养基、橘渣水复配HS培养基、本研究优化培养基中放大培养,30 ℃发酵5 d后,BC产量分别为4.51、6.75、10.26 g·L-1,优化培养基条件下的BC产量是HS培养基上的2.27倍、橘渣水复配HS培养基上的1.52倍,可见橘渣对于菌株的BC生成具有促进作用。
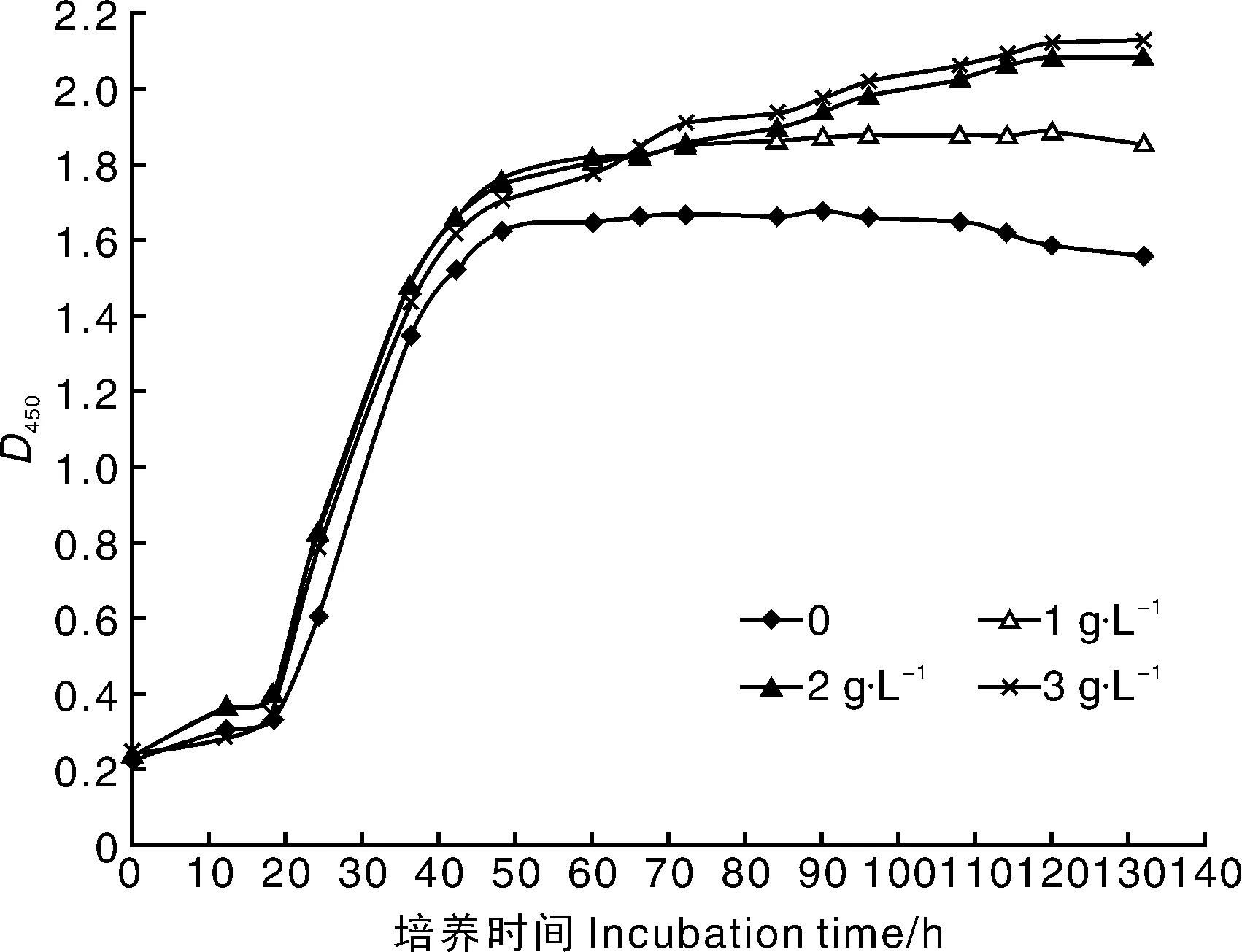
图7 磷酸氢二钠对对CIs26发酵的影响Fig.7 Effects of hydrogen phosphate on fermentation of CIs26
3 小结与讨论
本论文以筛选自腐败柑橘表面的中间葡糖酸醋杆菌CIs26为发酵菌株,研究间歇振荡法生产BC的营养条件,确定基于橘渣的营养物质复配方案如下:橘渣与水的混合比例为1∶6,太浓或者太稀皆不利于BC积累;橘渣与水混合均匀打浆制备橘渣浆,添加0.3 g·L-1的果胶酶、0.1 g·L-1的纤维素酶,于45 ℃酶解2 h,过滤所得滤液为培养基液;选择蔗糖为碳源,浓度70 g·L-1,硫酸铵为氮源,浓度3 g·L-1,酵母粉为生长因子,浓度为7 g·L-1,并添加1 g·L-1的乳酸与2 g·L-1磷酸氢二钠。在优化条件下,BC产量达10.26 g·L-1,是HS培养基上的2.27倍。
我国的BC发酵集中在海南,主要以当地的椰子水为基质进行生产,BC产量受产地与椰子产量的限制。我国柑橘产量大、产地广,加工集中,橘渣易于收集,冷冻后不影响使用,能够实现周年供应,是工业化生产BC的良好基质。本研究结果可为扩大BC生产的原料来源、提高BC产量、改变生产工艺等提供新思路。此外,既有的BC培养方式以静置与振荡培养为主,间歇振荡法生产所得BC凝胶有独特的性能,但还未见相关报道,是一个值得关注的研究方向。同时,应加强间歇振荡对BC性能影响的相关研究。
[1] ROSS P, MAYER R, BENZIMAN M. Cellulose biosynthesis and function in bacteria[J].MicrobiologicalReviews, 1991, 55(1): 35-58.
[2] HSIEH J T, WANG M J, LAI J T, et al. A novel static cultivation of bacterial cellulose production by intermittent feeding strategy[J].JournaloftheTaiwanInstituteofChemicalEngineers, 2016, 63(6): 46-51.
[3] 何艳,陈轶捷,马霞. 木醋杆菌静态发酵细菌纤维素的提纯及表征[J]. 食品工业, 2013, 34(7):18-21.
HE Y,CHEN Y J, MA X. Purification and haracterization of bacterial cellulose produced byAcetobacterxylinumin static culture[J].TheFoodIndustry, 2013, 34(7):18-21.(in Chinese with English abstract)
[4] SHI Z, ZHANG Y, PHILIPS G O. Utilization of bacterial cellulose in food[J].FoodHydrocolloids, 2014, 35(3): 539-545.
[5] 张基亮,何欣,李元敬,等. 细菌纤维素减肥功能测定及其酸奶的制作[J]. 食品科学, 2013, 34(12): 61-66.
ZHANG J L, HE X, LI Y J, et al. Weight- reducing effect of bacterial cellulose and its application in bacterial cellulose yogurt[J].FoodScience, 2013, 34(12): 61-66. (in Chinese with English abstract)
[6] 邵伟,唐明,黎姝华,等. 细菌纤维素在发酵植物蛋白冰淇淋中的应用[J]. 食品科学, 2002, 23(8): 167-169.
SHAO W, TANG M ,LI S H, et al. Study on application of bacterial cellulose in fermented soy milk ice cream[J].FoodScience, 2002, 23(8): 167-169. (in Chinese with English abstract)
[7] 陈中,杨晓泉,吴永辉,等.椰果酸奶的研究[J]. 食品科学, 2005, 26(2): 270-272.
CHEN Z, YANG X Q, WU Y H, et al. Study on noix de coco yoghourt formula[J].FoodScience, 2005, 26(2): 270-272. (in Chinese with English abstract)
[8] 张海悦,闫小娟,赵伟. 细菌纤维素发酵果冻的研制[J]. 中国酿造, 2010, 29(5): 176-179.
ZHANG H Y, YAN X J, ZHAO W. Development of bacterial cellulose fermented jelly[J].ChinaBrewing, 2010, 29(5): 176-179. (in Chinese with English abstract)
[9] PADRAO J, GONCALVES S, SILVA J P. Bacterial cellulose- lactoferrin as an antimicrobial edible packaging[J].FoodHydrocolloids, 2016, 58(7): 126-140.
[10] 章翠,毕继才,陈华美. 动态发酵合成球形细菌纤维素条件研究[J]. 中国酿造, 2016, 35( 5): 37-42.
ZHANG C, BI J C, CHEN H M. Culture conditions for the sphere- like bacterial cellulose by dynamic fermentation[J].ChinaBrewing, 2016, 35(5): 37-42. (in Chinese with English abstract)
[11] 余敏华,龙映均,刘四新,等.振荡条件对发酵生产颗粒状细菌纤维素的影响[J].中国酿造, 2012, 31(6): 98-102.
YU M H, LONG Y J, LIU S X, et al. Effect of agitation condition on bacterial cellulose pellets production[J].ChinaBrewing, 2012, 31(6): 98-102. (in Chinese with English abstract)
[12] HU Y, CATCHMARK J M, VOGLER E A. Factors impacting the formation of sphere- like bacterial cellulose particles and their biocompatibility for human osteoblast growth[J].Biomacromolecules, 2013, 14(10): 3444-3452.
[13] ZHU H X, JIA S R, YANG H J, et al. Preparation and application of bacterial cellulose sphere: a novel biomaterial[J].BiotechnolyandBiotechnologicalEquipment, 2014, 25(1): 2233-2236.
[14] TYAGI N, SURESH S. Production of cellulose from sugarcane molasses usingGluconacetobacterintermediusSNT- 1: optimization & characterization[J].JournalofCleanerProduction, 2016, 112: 71-80.
[15] LINA S P, HUANG Y H, HSU K D. Isolation and identification of cellulose- producing strainKomagataeibacterintermediusfrom fermented fruit juice[J].CarbohydratePolymers, 2016, 151 (6): 827-833.
[16] 谢健健,洪枫 .细菌纤维素发酵原料的研究进展[J]. 纤维素科学与技术, 2011, 19(3): 68-76.
XIE J J, HONG F. Recent progress in fermentation feedstocks of bacterial cellulose[J].JournalofCelluloseScienceandTechnology, 2011, 19(3): 68-76. (in Chinese with English abstract)
[17] 李艳,张俊娜,李志西, 等. 利用菠萝酒合成细菌纤维素的发酵培养基优化[J]. 西北农业学报, 2013, 22(7): 84-89.
LI Y, ZHANG J N, LI Z X, et al. Optimization of fermentation medium for bacterial cellulose synthesized from pineapple wine[J].ActaAgriculturaeBoreali-occidentalisSinica, 2013, 22(7): 84-89. (in Chinese with English abstract)
[18] ISLAM M U, ULLAH M W, KHAN S, et al. Strategies for cost- effective and enhanced production of bacterial cellulose[J].InternationalJournalofBiologicalMacromolecules, 2017, 102(9): 1166-1173.
[19] YANG Y, JIA J J, LU S M, et al.GluconacetobacterintermediusCIs26: a high cellulose production strain from rotten citrus and characteristics analysis[J].CarbonhydratePolemers, 2013, 92(2): 2012-2017.
[20] HESTRIN S, SCHRAMM M. Synthesis of cellulose byAcetobacterxylimumⅡ. Preparation of freeze- dried cells capable of polymerizing glucose to cellulose[J].BiochemicalJournal, 1954, 58(2): 345-352.
[21] 葛含静,杨苗苗. 一株纤维素高产菌株的鉴定及发酵条件优化[J]. 食品研究与开发, 2017, 38(9): 168-172.
GE H J, YANG M M. Identification and fermentation conditions optimizing of a high- yield bacterial cellulose- producing strain[J].FoodResearchandDevelopment, 2017, 38(9): 168-172. (in Chinese with English abstract)
[22] 张丽平,卢红梅,戴锐,等. 乙醇及有机酸对木醋杆菌合成细菌纤维素的影响[J]. 食品工业科技, 2014, 35(4): 161-165.
ZHANG L P, LU H M, DAI R, et al. Study on the function of ethanol and organic acid to acetobacter xylinum synthetic bacterial cellulose[J].ScienceandTechnologyofFoodIndustry, 2014, 35(4): 161-165. (in Chinese with English abstract)

