免疫胶体金法快速检测水产品中喹诺酮类药物
柳爱春,刘 超,张 乐,童朝明,李 锋,赵 芸
(杭州市农业科学研究院,浙江 杭州 310024)
我国水产品养殖总产量居世界首位,养殖过程中的药物残留问题备受国内外关注。近10 a来,喹诺酮类(quinolones,QNs)药物残留是造成我国水产品抽检不合格的主要原因之一。QNs是一类化学合成的抗菌药,近年来被广泛应用于养殖业以预防和治疗细菌性疾病[1-5]。研究表明,QNs在动物体内可发生转化和富集现象[6-7],造成动物性食品中药物残留[8-9],而且还有部分药物会随着动物排泄物在环境中发生迁移[10-11]。QNs对人体的危害包括影响儿童和胎儿的骨骼发育,引起头晕、关节病变、消化道反应、肝肾毒性等。QNs在环境中残留还会诱导细菌产生耐药性[12-13]。美国现已禁止在水产品养殖中使用QNs,残留限量为5 μg·kg-1,但QNs在我国、欧盟和日本是允许使用的,农业部293号公告规定水产品肌肉中残留限量为100 μg·kg-1。然而,依据农业部2292号公告,自2016年12月31日起,禁止在食品用动物养殖中使用QNs药物中的洛美沙星、培氟沙星、氧氟沙星、诺氟沙星,与之相关的5 000多个兽药批号被取消。
目前,对水产品中QNs药物残留进行检测的方法主要有液相色谱- 串联质谱法(LC- MS/MS)(GB/T 21312—2007)和高效液相色谱法(HPLC)(农业部783号公告- 2- 2006),但这些方法存在检测时间长、成本高的问题,难以满足对水产品质量监管的时效性要求。免疫胶体金法(GICT)以其操作简便、快速、直观等特点,成为药物残留快速筛检的有效方法。农业部自2011年以来,每年开展对水产品快速检测产品的验证工作,促进了快速检测产品的改进和发展。进入21世纪以来,我国对喹诺酮类抗体和快速检测产品的研究和开发工作不断深入[14-15],吴建祥等[16]研制的单克隆抗体对环丙沙星、氧氟沙星、诺氟沙星、洛美沙星竞争ELISA法的50%抑制率(IC50)分别达3.21、8.15、7.75、6.21 ng·mL-1,可满足当时我国、欧盟和日本对QNs残留检测的需求。2017年随着农业部2292号公告的实施,对单克隆抗体和快速检测产品灵敏度的要求进一步提高。本研究针对4种禁用QNs药物开展免疫胶体金试剂盒的研制工作,并将其应用于水产品中QNs药物残留的快速筛检,以期为水产品市场准入制度和基地准出制度的实施提供技术支持。
1 材料与方法
1.1 材料及仪器
1.1.1 材料
产QNs抗体的杂交瘤细胞株(实验室自制),株号5H1E9E8D7H12,简称QH12,中国典型培养物保藏中心保藏编号CCTCC No.C2015118,专利申请号201510990139.X。水产样品来自浙江省内各个养殖场,取鱼、虾、鳖等可食部分约100 g,用组织捣碎机充分绞碎混匀,-18 ℃冷冻避光保存。
1.1.2 试剂
RPMI 1640培养基,GIBCO;胎牛血清(FBS),GIBCO;1307镀剂、氯金酸(纯度99.99%)、胶体金垫和NC膜,上海捷宁公司。实验用水为超纯水。金标抗体保存液:0.02 mol·L-1Tris- HCl缓冲液(pH 8.7,含0.2% PEG20000、1%BSA和3%海藻糖,现配现用)。喹诺酮类药物标准物质:氟甲喹(flumequine,Flu),诺氟沙星(norfloxacin,Nor),依诺沙星(enoxacin,Eno),环丙沙星(ciprofloxacin,Cip),培氟沙星(pefloxacin,Pef),洛美沙星(lomefloxacin,Lom),达氟沙星(danofloxacin,Dan),恩诺沙星(enrofloxacin,Enr),氧氟沙星(ofloxacin,Ofl),麻保沙星(marbofloxacin,Mar),沙拉沙星(sarafloxacin,Sar),二氟沙星(difloxacin,Dif),均为德国Dr.Ehrenstorfer公司生产的纯品型有证标准品。乙腈、甲醇、正己烷均为色谱纯,其他试剂均为分析纯。
1.1.3 仪器与设备
二氧化碳培养箱,Thermo 3111,美国;酶标仪,Tecan Infinite M1000,瑞士;紫外- 可见分光光度计,岛津UV3550,日本;三维喷点平台,BIODOT 3210,美国;空气吹干机,定制;高效液相色谱仪/HPLC,Waters e2695,美国;超高效液相串联质谱仪/UPLC- MS/MS,Waters TQ- S,美国。
1.2 免疫胶体金试剂条研制
1.2.1 体外抗体制备
将QH12杂交瘤细胞株复苏,加入适量RPMI 1640培养基(含10% FBS),在37 ℃、5% CO2条件下培养。更换培养基时,收集旧培养基,取少量用ELISA方法检测抗体灵敏度,其余的培养基中立即加入等体积的饱和硫酸铵,摇匀后,4 ℃静置2~16 h。10 000g离心30 min,弃上清,向沉淀中慢慢加入0.02 mol·L-1(pH 7.2)的PBS,并搅拌至沉淀完全溶解,10 000g离心30 min,留上清液,用40%饱和硫酸铵沉淀,获初步纯化的抗体。再用PBS复溶,用紫外- 可见分光光度计测定280 nm处的吸光值,并对照标准曲线计算蛋白质浓度,分装后,-86 ℃冻存。取部分抗体用Protein G法进一步纯化,冷冻干燥后,-20 ℃保存备用。
1.2.2 免疫胶体金试剂条研制
(1)胶体金制备。取6个250 mL三角瓶,预先用硫酸- 重铬酸钾洗液浸泡过夜,冲洗干净后,烘干,备用。实验组(编号①~③)以2 mL 1307镀剂涂抹内壁,倒出多余液体,倒置,60 ℃烘干;对照组(编号④~⑥)未用1307镀剂处理。每个三角瓶各加100 mL水,加入0.1%氯金酸水溶液1 mL,在磁力搅拌器上加热至冒泡,加入1 mL 1%柠檬酸三钠水溶液,保持微沸15 min,冷却后,4 ℃保存过夜。取3 mL胶体金溶液,在紫外- 可见分光光度计上进行200~800 nm光谱扫描,测定吸收峰波长和吸收值。
(2)胶体金标记。将冻干抗体用0.01 mol·L-1的PB缓冲液(pH 7.4)配制成0.5 mg·mL-1的溶液,20 000g离心60 min,去除蛋白聚合物。将100 mL胶体金用0.1 mol·L-1Tris- HCl调节pH至8.7。在6支小试管中各加1 mL胶体金,分别按表1所列的抗体量进行预标记,每管加10 μg BSA结合未标记的胶体金。将2 μL金标抗体溶液滴在装空白胶体金垫的试剂条上,分别测试加PBS或5 ng·mL-1Cip后T线(检测线)和C线(质控线)的显色情况和抑制效果。取60 mL胶体金,以最佳抗体量进行标记,15 000g离心30 min,弃上清液,保留底部紫红色的金标抗体,加入3 mL金标抗体保存液使其复溶,4 ℃保存过夜。
(3)试剂条制备。用三维喷点平台将金标抗体喷在胶体金垫上,37 ℃烘干,与T线和C线分别喷有抗原(实验室人工合成的Cip- BSA)和二抗(羊抗鼠)的NC膜一起组装成免疫胶体金测向层析试剂条,加塑料卡后,称其为试剂板,并以铝箔袋单个包装。
(4)检出限测试。以0.02 mol·L-1(pH 7.2)的PBS分别配制0.5~100 ng·mL-1的环丙沙星、洛美沙星、诺氟沙星、氧氟沙星和培氟沙星标准溶液。从铝箔袋中取出试剂板,平放,每个试剂条加3滴标准溶液(简称为“滴板”),3~5 min内观察显色结果。定性判定原则:T线比C线浅为阳性;T线比C线深或一样深浅为阴性。以肉眼可识别出色差的最少浓度为该药物的最低检出限(LOD)。以同样的方法测试恩诺沙星、沙拉沙星等其他喹诺酮类药物的检测限。
(5)交叉反应。分别以100 ng·mL-1氯霉素和1 mg·L-1链霉素、四环素或磺胺嘧啶进行交叉反应。
1.3 样品预处理方法优化
取一个经LC- MS/MS检测的阴性淡水鱼样,每份称取2.00 g匀质样品于5 mL离心管中,按以下4种样品预处理方法分别做添加回收试验,每种方法的每个添加水平做6次平行试验。
A:加4 mL含1%甲酸的乙腈剧烈振荡5 min,2 000g离心5 min,上清液移到另一支5 mL试管中,用空气吹干机将溶剂吹至近干,加0.5 mL PBS溶解残留物,加0.5 mL正己烷,用小滴反复吹打试管内壁,静置5 min,吸取下层溶液滴板。
B:按A法提取,将溶剂吹至全干。
C:加入4 mL快速提取液(含1%甲酸的乙腈与乙酸乙酯以体积比1∶8混合),剧烈振荡5 min,2 000g离心5 min,上清液移到另一支5 mL试管中,用空气吹干机将溶剂吹至近干,加0.5 mL PBS溶解残留物,加0.5 mL正己烷,用小滴反复吹打试管内壁,静置5 min,吸取下层溶液滴板。
D:加入4 mL PBS,剧烈振荡后,取其悬浊液直接滴板。
根据试验结果优选预处理方法,并进一步完成虾、甲鱼及其他水产样品的添加回收试验。
1.4 实际样品对比检测与验证
1.4.1 与HPLC法对比
采集169个水产样品,分别按以下部位取样:鱼、黄鳝和泥鳅去皮,沿脊背取肌肉;鳖取可食部分(肌肉和性腺);对虾和小龙虾去头、皮和肠腺,取整条虾肉;青蛙,去头,去皮,取肌肉。取好的样品分别绞碎后备用。参照农业部783号公告- 2- 2006,以HPLC法定量检测Cip、Enr和Nor残留量,同时以1.3节中的C方法进行样品预处理,并用免疫胶体金试剂条定性检测喹诺酮类药物总残留量。
1.4.2 不同免疫胶体金方法对比
取HPLC检测结果为阳性的鳖样品,分别用1.3节的C法和D法进行预处理,同时用组织渗出液直接滴板,对比检测结果。
1.4.3 LC- MS/MS方法确证检测
选取10个HPLC和GICT检测结果均为阳性的样品、10个HPLC检测结果为阴性而GICT为阳性的样品、3个HPLC检测结果为阳性而GICT为阴性的样品,用LC- MS/MS法进行确证检测。
2 结果与分析
2.1 免疫胶体金试剂条研制
2.1.1 体外抗体制备结果
QH12杂交瘤细胞株经过体外培养获得4.4 g初步纯化的抗体,经竞争ELISA测试,对Cip的IC50为0.4 ng·mL-1。与传统的体内抗体制备方法比较,体外抗体制备方法的优点是产量高,对实验动物的依存度低,缺点是细胞上清中抗体易被降解,因此要及时用硫酸铵沉淀法分离抗体。
2.1.2 胶体金紫外- 可见光200~800 nm扫描结果
以0.01 mol·L-1Tris- HCl作对照,用紫外- 可见光在波长200~800 nm范围内对胶体金进行扫描(图1),3个平行试验的吸收曲线和吸收峰均高度一致:λ①max=529.5 nm,λ②max=λ③max=529.0 nm,D①529.5nm=0.943,D②529.0 nm=0.944,D③529.0 nm=0.950。根据经验公式λ=0.427 1φ+514.56计算出胶体金粒径φ①=35 nm,φ③=φ③=34 nm。对比实验组与对照组扫描图可知,使用1307镀剂处理过的容器所制备的胶体金3次重复的波形几乎重合,说明该镀剂处理使胶体金质量更稳定。
2.1.3 胶体金标记抗体实验
胶体金标记抗体预试验显色情况见表1:当抗体浓度为0.5~2.0 μg·mL-1时,Cip对T线上抗原与抗体反应有强抑制作用;当抗体浓度大于4.0 μg·mL-1时,无抑制作用;但抗体浓度小于1.0 μg·mL-1时,显色偏浅。因此,以1 mL胶体金中加2.0 μg抗体进行正式标记。

图1 胶体金紫外- 可见分光光度计扫描图Fig.1 Scanogram of colloidal gold by UV- visible spectrophotometer
2.1.4 免疫胶体金试剂板检出限
以2.5~100 ng·mL-1的Pef、Ofl、Nor和Lom标准溶液测试新制备的免疫胶体金试剂板(图2),可以看出,Pef的LOD为5.0 ng·mL-1,Ofl和Nor的LOD为2.5 ng·mL-1,Lom的LOD为2.0 ng·mL-1。
2.1.5 交叉反应结果
试剂条与100 ng·mL-1氯霉素和1 mg·mL-1链霉素、四环素或磺胺嘧啶交叉反应实验结果均呈阴性。
2.2 样品预处理方法优化
方法A吹干时间20~35 min,尤其是从最后1 mL吹至近干特别慢。方法B其实是在方法A的基础上将溶剂吹至全干,以测试喹诺酮类药物在吹干后是否能稳定;方法C吹干较快,只需5~8 min。4种样品预处理方法的比较结果见表2∶A法检测结果不稳定;B法出现较多假阴性结果,可能是因为吹干时间过长,致使喹诺酮类药物损失较大;C法的检测灵敏度和结果精密度均最好;D法操作最方便,但灵敏度低于C法和A法。
表1胶体金标记抗体预试验显色情况
Table1Color rendering of colloidal gold labelled antibody in preliminary experiment

抗体浓度Antibodyconcentration/(μg·mL-1)PBST线显色ColorofTlineC线显色ColorofClineCipT线显色ColorofTlineC线显色ColorofCline抑制Inhibition0.5*———S1.0**——**S2.0*****—***S3.0***********W4.0************—5.0************—
*,浅红色;**,红色;***,深红色;S,强抑制作用;W,弱抑制作用;—,无色或无抑制作用。
*, Light red; **, Red; ***, Purple red; S, Strong inhibition; W, Weak inhibition; —, Colorless or no inhibition.
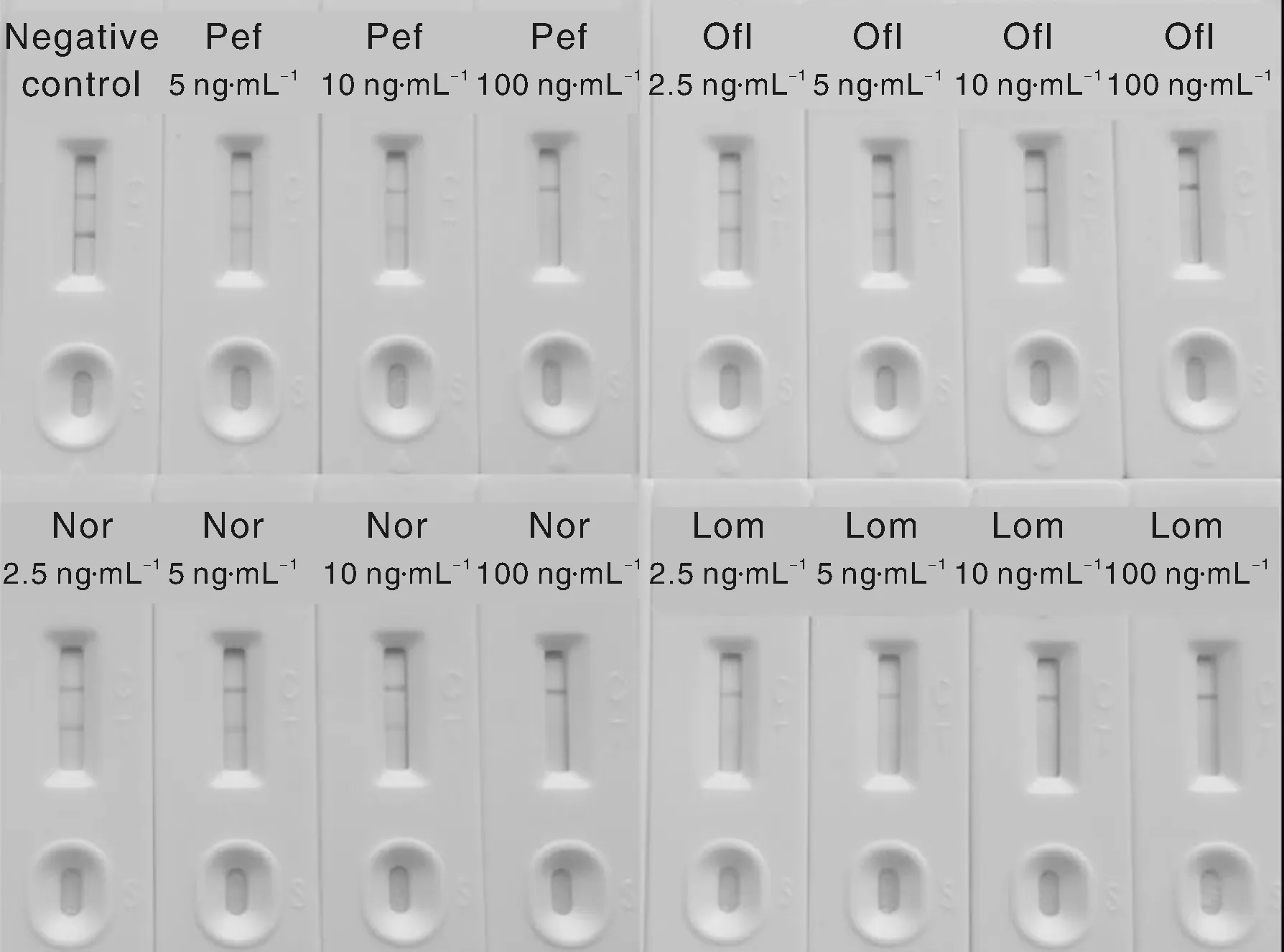
图2 4种喹诺酮药物免疫胶体金法检出限Fig.2 LOD of immune colloidal gold detection for 4 QNs
因此,C法和D法分别适用于高灵敏度检测和现场快速检测。
2.3 实际样品对比检测与验证
2.3.1 与HPLC对比结果
取10份HPLC检测有Nor、Cip或Enr残留的鳖、鱼、小龙虾和泥鳅样品,免疫胶体金法检测结果呈阳性;有3份小龙虾样品HPLC检出有环丙沙星残留,免疫胶体金C法检测呈阳性;有26份HPLC未检出Nor、Cip或Enr的样品,免疫胶体金法呈阳性。
2.3.2 不同预处理方法对比结果
取经HPLC检测Cip和Nor总残留量为35 μg·kg-1的鳖样品进行不同预处理方法对比检测,结果如图3所示,从左到右分别为采用D法、组织渗出液直接滴板和C法进行预处理后的检测结果,均为阳性,中间试剂板上血液引起背景颜色较深,均匀布满整个观察窗,但结果仍可辨识,说明抗体未与样品中杂质发生非特异性结合,右侧试剂条显示的是经过有机试剂提取和净化的结果,更清晰,更干净,检测灵敏度也相对更高。
2.3.3 LC- MS/MS验证结果
表2不同样品预处理方法的检测结果
Table2Comparison of test results of four sample processing methods

标准品SampleSDC/(ng·g-1)ABCDNC0————————————————————————Cip2.0+++———+++———+—+———+++———10.0+++++——++++++++++++++++—+—+++++++++Nor2.5++————+++————++———+++———15.0++++—+—+++++++++++++++—++++++++++
NC,阴性对照;SDC,加标浓度;—,阴性或未检出;+,弱阳性;++,中等阳性;+++,强阳性。下同。
NC, Negative control; SDC, Standard addition concentration; —, Negative or Non- detected;+, Weak positive;++, Moderate positive; +++, Strongly positive. The same as below.

图3 不同预处理方法检出效果对比Fig.3 Detection effect comparison of different processing methods
用LC- MS/MS方法对10个HPLC和GICT(C法)检测结果均为阳性的样品、3个HPLC为阳性而GICT为阴性的样品进行验证,结果见表3。对于QNs残留量较高的样品,3种方法的检测结果基本一致。HPLC检测结果中,小龙虾中Cip易出现假阳性,鳖中Nor也出现部分假阳性结果,但GICT与LC- MS/MS检测结果一致。
选取10个HPLC为阴性而GICT(C法)为阳性的样品,LC- MS/MS法检测结果见表4,其中:9个样品含多种QNs,且均有Cip和Enr药物被检出(但含量均低于3 μg·kg-1,即在LC- MS/MS最低定量限以下),未检出Nor;有1个样品未检出12种QNs中的任何1种,但GICT法显示阳性,其中可能含有这12种以外的QNs。
表3同一样品不同检测方法的结果对比
Table3Comparison of test results of different detection methods
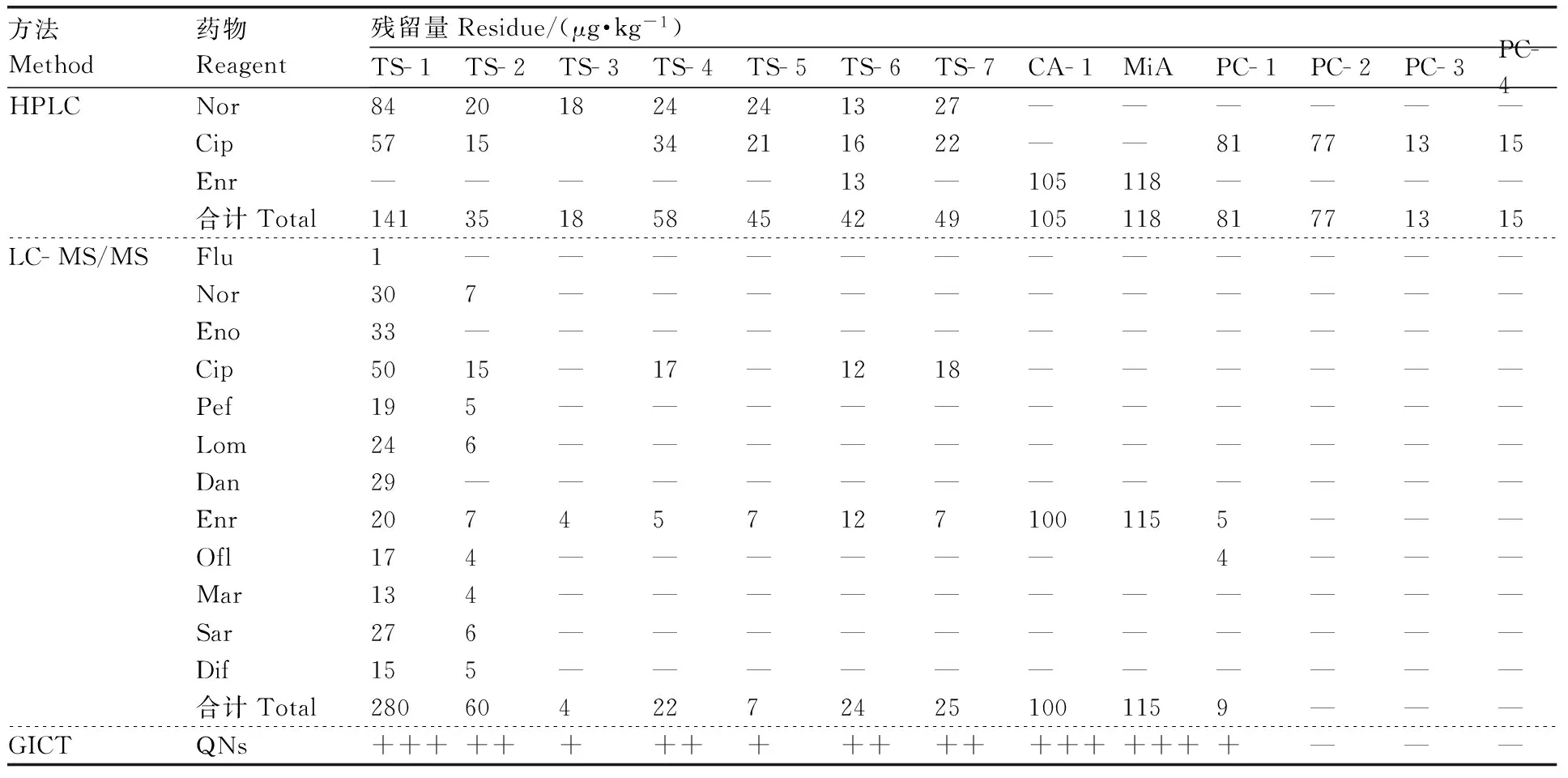
方法Method药物Reagent残留量Residue/(μg·kg-1)TS-1TS-2TS-3TS-4TS-5TS-6TS-7CA-1MiAPC-1PC-2PC-3PC-4HPLCNor84201824241327——————Cip571534211622——81771315Enr—————13—105118————合计Total14135185845424910511881771315LC-MS/MSFlu1————————————Nor307———————————Eno33————————————Cip5015—17—1218——————Pef195———————————Lom246———————————Dan29————————————Enr2074571271001155———Ofl174——————4———Mar134———————————Sar276———————————Dif155———————————合计Total28060422724251001159———GICTQNs++++++++++++++++++++———
TS,鳖;CA,鲫鱼;MiA,泥鳅;PC,小龙虾。下同。
TS,Trionyxsinensis; CA,Carassiusauratus; MiA,Misgurnusanguillicaudatus; PC,Procambarusclarki. The same as below.
表4HPLC阴性样品的LC- MS/MS和GICT检测结果
Table4Test results of HPLC negative samples by LC- MS/MS and GICT

方法Method药物Reagent残留量Residue/(μg·kg-1)TS-8TS-9TS-10TS-11MACA-2CCMPCIRNLC-MS/MSFlu3—534———4—Nor——————————Eno——<10——————<10Cip<3<3<3<3<3<3<3—<3<3Pef14—<3—6—————Lom———<3—15——<3—Dan—2——————<3—Enr<3<3<3<3<3<3<3—<3<3Ofl4——4——————Mar—4————————Sar——6<6————<6—Dif——<3<3<3———3—GICTQNs++++++++++++++++
MA,黄鳝; CC,鲤鱼;MP,青鱼;CI,草鱼;RN,青蛙。
MA,Monopterusalbus; CC,Cyprinuscarpio; MP,Mylopharyngodonpiceus; CI,Ctenopharyngodonidellus; RN,Rananigromaculata.
3 结论与讨论
本研究利用自制的杂交瘤细胞,通过体外制备方法获得的单克隆抗体,研制检测水产品中QNs残留的高灵敏度免疫胶体金试剂盒,对农业部2292号公告中禁用的4种QNs药物检出限均≤5.0 μg·kg-1,与LC- MS/MS方法的符合性高,完全可满足我国、美国和日本等国对水产品QNs残留快速检测的需求。
实验中用HPLC法检测小龙虾样品易出现Cip假阳性,与3方面因素有关:(1)样品基质干扰;(2)样品在预处理时浓缩了5倍,虽然可在一定程度上弥补方法灵敏度低的缺陷,但会带来更严重的基质干扰;(3)HPLC的检出方法,不管是荧光法还是紫外法均为非特异性的方法。相对而言,GICT法和LC- MS/MS法的灵敏度和特异性均高于HPLC法。近几年,在水产品药物残留检测工作中,HPLC法逐步被LC- MS/MS法取代。
GICT法虽然是一种定性或半定量的检测方法,但由于检测速度快、操作简便、成本低,符合市场准入制度和基地准出制度实施对检测时效性的需求。本文中免疫胶体金试剂条具有特异性强的特点,具体表现为:(1)与多种喹诺酮类药物反应,而与其他类别的药物无交叉反应;(2)在检测过程中(D法),抗体可以从未经过任何预处理的样品中识别出喹诺酮类药物而不受其他物质干扰。综合比较分析,免疫胶体金法非常适合于作为水产品中喹诺酮类药物残留的快速筛查检测方法进行推广。
[1] 张路, 徐洋, 潘晓艺, 等. 5种喹诺酮类药物对维氏气单胞菌体外抗生素后效应的研究[J]. 中国预防兽医学报, 2015, 37(2):106-109.
ZHANG L, XU Y, PAN X Y, et al. Postantibiotic effects of 5 kinds of quinolone antibiotics onAeromonasveronii[J].ChineseJournalofPreventiveVeterinaryMedicine, 2015, 37(2): 106-109. (in Chinese with English abstract)
[2] 苏振霞, 肖辉, 陈列欢. 3种抗生素对3种常见鱼类病原菌的抑菌活性研究[J]. 中国预防兽医学报, 2011, 33(6):483-486.
SU Z X, XIAO H, CHEN L H. Antibacterial activity of three antibiotics on three common fish pathogenic bacteriainvitro[J].ChineseJournalofPreventiveVeterinaryMedicine, 2011, 33(6): 483-486. (in Chinese with English abstract)
[3] 操继跃, 葛建, 方之平,等. 氧氟沙星在鲤体内的药物动力学和残留研究[J]. 水生生物学报, 2005, 29(2):227-229.
CAO J Y, GE J, FANG Z P, et al. Study on pharmacokinetics and residues of ofloxacin in common carp,Cyprinuscarpio[J].ActaHydrobiologicaSinica, 2005, 29(2): 227-229. (in Chinese with English abstract)
[4] 梁华丽,徐辉,华炯钢,等. 恩诺沙星钠盐可溶性粉剂对实验大肠杆菌的疗效研究[J]. 浙江农业学报,1998,10(6): 313-315.
LIANG H L, XU H, HUA J G, et al. The therapeutic trial of soluble powder of enrofloxacin sodium on chickens experimentally infected withE.coli[J].ActaAgriculturaeZhejiangensis, 1998, 10(6): 313-315. (in Chinese with English abstract)
[5] 姜中其, 方兰勇, 曾卫东, 等. 盐酸沙拉沙星的急性毒性和对鸡实验性沙门氏菌病的药效[J]. 浙江农业学报, 2000, 12(1): 38-41.
JIANG Z Q, FANG L Y, ZENG W D, et al. Studies on acute toxicity and efficacy of sarafloxacin against experimental salmonellosis in chicks[J].ActaAgriculturaeZhejiangensis, 2000, 12(1):38-41. (in Chinese with English abstract)
[6] 柳爱春,刘超,赵芸,等. 喹诺酮类药物在麻鸡体内的转化和分布规律[J]. 浙江农业学报, 2016,28 (5):736-742.
LIU A C, LIU C, ZHAO Y, et al. Studies on transformation and distribution rules of quinolones in Partridge chicken[J].ActaAgriculturaeZhejiangensis, 2016, 28 (5): 736-742. (in Chinese with English abstract)
[7] 原盛广, 崔艳芳, 张文婧. 北京农贸市场常见淡水鱼体内抗生素残留调查研究[J]. 生态毒理学报, 2015, 10(3):311-317.
YUAN S G, CUI Y F, ZHANG W J. Residual levels of antibiotics in aquatic products in Beijing market[J].AsianJournalofEcotoxicology, 2015, 10(3): 311-317. (in Chinese with English abstract)
[8] 杨永涛, 何秀婷, 聂湘平, 等. 广州地区淡水鱼体内喹诺酮类药物残留调查[J]. 环境与健康杂志, 2009, 26(2):109-111.
YANG Y T, HE X T, NIE X P, et al. Preliminary investigation of three quinolones in the muscle tissues of four fishes collected from the markets in Guangzhou City[J].JournalofEnvironmentandHealth, 2009, 26(2): 109-111. (in Chinese with English abstract)
[9] 柳爱春, 刘超, 赵芸, 等. 胶体金法和质谱法检测禽蛋中喹诺酮类残留的比较[J].浙江农业科学, 2015,56(11):1763-1766.
LIU A C, LIU C, ZHAO Y, et al. Comparative analysis of quinolones residues in eggs by colloidal gold method and LC- MS/MS method[J].JournalofZhejiangAgriculturalSciences, 2015,56(11):1763-1766. (in Chinese)
[10] 任珂君,刘玉,徐健荣, 等. 广东—饮用水源地河流沉积物及鱼体中氟喹诺酮类(FQs)抗生素残留特征研究[J].农业环境科学学报, 2016, 36(3): 760-766.
REN K J, LIU Y, XU J R, et al. Residues characteristics of fluoroquinolones (FQs) in the river sediments and fish tissues in a drinking water protection area of Guangdong Province[J].ActaScientiaeCircumstantiae, 2016, 36(3): 760-766. (in Chinese with English abstract)
[11] 国彬,姚丽贤,刘忠珍,等. 广州市兽用抗生素的环境残留研究[J].农业环境科学学报, 2011, 30(5):938-945.
GUO B, YAO L X, LIU Z Z, et al. Environmental residues of veterinary antibiotics in Guangzhou City, China[J].JournalofAgro-EnvimnmentScience, 2011, 30(5):938-945. (in Chinese with English abstract)
[12] 方一风,潘晓艺,蔺凌云, 等.嗜水气单胞菌对喹诺酮类药物耐药的分子机制[J]. 微生物学报,2014, 54(2):736-742.
FANG Y F,PAN X Y,LIN L Y, et al. Molecular mechanisms of quinolone resistance inAeromonashydrophilia[J].ActaMicrobiologicaSinica,2014, 54(2):736-742. (in Chinese with English abstract)
[13] 李金梅,李雨珊,刘华,等. 健康儿童肠道大肠埃希菌产ESBLs菌株耐药性研究[J]. 检验医学与临床,2015,12(3):310-311.
LI J M, LI Y S, LIU H, et al. Resistance research ofE.coliproducing ESBLs stains in the gut for healthy children[J].LaboratoryMedicineandClinic, 2015, 12(3):310-311. (in Chinese with English abstract)
[14] 王晓艳,林纪昀,杨利,等.两株高特异性抗恩诺沙星单克隆抗体的研制[J]. 食品安全质量检测学报,2010,27(1):1-6.
WANG X Y,LIN J Y,YANG L, et al. Development of two specific monoclonal antibodies against enrofioxacin[J].JournalofFoodSafetyandQuality,2010,27(1):1-6. (in Chinese with English abstract)
[15] UWAMAHORO E, 吕书为, 唐秋实, 等.基于洛美沙星免疫原的喹诺酮药物广谱特异性抗体制备的研究[J]. 食品工业科技, 2012, 33(20): 156-159.
UWAMAHORO E,LYU S W,TANG Q S, et al. Preparation of broad- specific antibody to fluoquinolone drugs based on lomefloxacin immunogen[J].ScienceandTechnologyofFoodIndustry, 2012, 33(20): 156-159. (in Chinese with English abstract)
[16] 吴建祥, 王震成, 金仁耀, 等. 抗氟喹诺酮类抗生素单抗的研制及其检测应用[J]. 核农学报, 2013, 27(12):1961-1967.
WU J X, WANG Z C, JIN R Y, et al. Development and detection application of a monoclonal antibody against fluoroquinolone[J].JournalofNuclearAgriculturalSciences, 2013, 27(12): 1961-1967. (in Chinese with English abstract)

