乌鳢(Channa argus)源摩氏摩根菌(Morganella morganii)的分离、鉴定及药敏特性
杨移斌,宋 怿,杨秋红,刘永涛,杨先乐,艾晓辉,*
(1.中国水产科学研究院 长江水产研究所,湖北 武汉 430223; 2.农业部水产品质量安全控制重点实验室,北京 100141; 3.上海海洋大学,上海 201306)
乌鳢(Channaargus)又名才鱼、墨鱼、乌鱼、孝鱼、生鱼、蛇头鱼等,其分类地位为鲈形目(Perciformes)鳢科(Channidae)鳢属(Channa)[1]。乌鳢是凶猛的肉食性经济鱼类,适应能力强,对各种不良环境具备较强耐受力,在我国分布区域广泛,天然环境下生长的乌鳢很少发病[2]。乌鳢肉质鲜美、营养丰富,而且具备去瘀生新、健脾利水、生肌补血及滋补调养等医疗功效[3],因此获得广大消费者的喜爱,市场需求逐步扩大。为了满足市场需求,乌鳢人工养殖产量不断提升,但因其养殖规模不断扩大,集约化程度不断提高,养殖环境日益恶化,导致病害频发。目前,乌鳢养殖过程中主要疾病包括结节病[2,4-5]、溃烂病[6-7]、腹水病[8]、腐皮病[9]、出血病[10]等,这些病害的暴发,给养殖户带来了较大的经济损失,也严重制约了乌鳢养殖业健康可持续发展。
2016年5—6月江西南昌某养殖场暴发慢性传染疾病,导致乌鳢批量死亡,死亡乌鳢主要症状为:乌鳢头部及尾部有严重大块溃烂,肛门红肿外翻;解剖后发现肾、脾等充血,脾脏严重肿大,肝脏较脆易碎,颜色发黄,肠道发白,内无食物。发病期持续近1个月,累计死亡率达20%,死亡鱼体质量大多为1.0~1.5 kg,造成较大经济损失。本研究从患病濒死乌鳢体内分离到一株优势菌,对其开展人工感染试验、生理生化特性测定、16S rRNA序列分析及药物敏感性等试验,以期为乌鳢在养殖过程中暴发的细菌性疾病的防控提供参考依据。
1 材料与方法
1.1 材料
1.1.1 供试鱼
发病乌鳢(1.0~1.5 kg)10尾采于江西南昌某乌鳢养殖场;健康乌鳢苗(50±2) g购自武汉某乌鳢繁殖场,乌鳢苗活力强、无伤病,暂养7 d无异常后用于试验。
1.1.2 主要试剂
MH琼脂、营养琼脂、营养肉汤、革兰氏染色液、药敏纸片及细菌微量生化管均购自杭州微生物试剂有限公司;PCR反应体系、细菌基因组DNA提取试剂盒均购自天根生化科技(北京)有限公司;测序服务及引物合成均由武汉擎科生物技术有限公司提供。
1.2 方法
1.2.1 病原菌分离
取具有典型病症,如体表溃烂及重要组织器官充血等(图1)的乌鳢10尾,经75%乙醇消毒后,在无菌操作台内取病鱼肝肾脾、溃烂处肌肉,接种于普通营养琼脂平板上,置于28 ℃恒温培养箱中18~24 h,挑取形态大小、颜色一致,以及优势度高的菌落进行细菌再纯化,将分离纯化得到的菌株与15%甘油混匀后保存于-80 ℃冰箱,分离菌株暂命名为JX15。

图1 发病乌鳢Fig.1 Diseased Channa argus
1.2.2 人工感染及半致死剂量LD50测定
将JX15株划线于普通营养琼脂平板上,恒温培养18 h后,用无菌生理盐水洗下菌苔,并参照麦氏比浊法调整菌悬液浓度为4.9×109cfu·mL-1。
将健康乌鳢分为试验组及对照组,每组均设置3个重复,每个重复30尾乌鳢。试验期间连续充氧,水温控制在22~25 ℃。试验组乌鳢腹腔注射JX15株菌悬液0.1 mL·尾-1,对照组相同部位注射等量无菌生理盐水。定时观察乌鳢游动状况,及时记录发病死亡乌鳢数量及症状,并进行细菌再分离。
将分离菌株JX15用无菌生理盐水稀释成浓度为3.0×1010、3.0×109、3.0×108、3.0×107、3.0×106cfu·mL-1的菌悬液,分别注射到不同组的乌鳢体内,注射量为0.1 mL·尾-1,即不同组每尾乌鳢注射JX15株的剂量分别为3.0×109、3.0×108、3.0×107、3.0×106、3.0×105cfu,而对照组相同部位注射等剂量无菌生理盐水,每组乌鳢30尾。连续查看乌鳢游泳状况,及时记录发病死亡量,并用概率单位图解法[11]计算半致死剂量(LD50)。
1.2.3 形态学及生理生化特性测定
将JX15菌株接种于普通营养琼脂平板上,置于28 ℃恒温培养中培养24 h后,观察菌落大小、形态特征及其颜色,并进行革兰氏染色及镜检。菌株JX15的理化特性采用细菌生化微量鉴定管[12]进行测定。
1.2.4 JX15株16S rRNA与gyrB基因测序
模板制备。将JX15株接种于普通营养肉汤中,置于摇床(200 r·min-1)恒温28 ℃培养18 h,将JX15菌液离心后收集菌体,提取DNA作为PCR模板。
16S rRNA测序。上游引物为27F,5′- AGAGTTTGATC(C/A)TGGCTCAG- 3′,下游引物为1492R,5′- GGTTACCTTGTTACGACTT- 3′。参照赖晓健等[13]方法进行PCR反应扩增目的基因。PCR反应产物送武汉擎科进行纯化及序列测定。
gyrB测序。引物参照Yamamoto等[14]设计:UP1,5′- GAAGTCATCATGACCGTTCTGCAYGCNGGNGGNAARTTYGA- 3′;UP2,5′- AGCAGGGTACGGATGTGCGAGCCRTCNACRTCNGCRTCNGTCAT- 3′。PCR 反应条件参照文献[15],PCR反应产物送武汉擎科生物技术有限公司进行纯化及测序。
系统发育分析。将分离纯化菌株的16S rRNA及gryB基因与NCBI中已经存储的基因序列进行Blast比对,根据Blast比对结果,选取同源性较高的序列采用Clustal X软件进行多序列匹配分析,通过MEGA 5.1软件Neighbor- Joining法构建系统进化树,1 000次Bootstrap检验置信度。
1.2.5 药敏特性分析
JX15株的药敏特性研究参照NCCLS抗微生物药物敏感性试验执行标准,采用纸片扩散法[16]。将JX15株接种于普通营养肉汤中,置于摇床(200 r·min-1)28 ℃恒温培养18 h,用无菌生理盐水稀释成浓度为1.5×107cfu·mL-1的菌悬液,取150 μL菌液均匀涂于水解酪蛋白琼脂平板上,贴上药敏纸片,置于28 ℃恒温培养24 h后测量药敏纸片的抑菌圈直径。根据药敏纸片厂家提供的抑菌圈直径判断标准进行判断。
1.2.6 组织病理损伤观察
取具有典型症状的乌鳢溃烂皮肤肌肉、肝脏、肾脏、脾脏及肠道,用10%的中性缓冲福尔马林固定液固定,酒精梯度脱水,二甲苯透明,石蜡包埋、切片(厚度4 μm),苏木精- 伊红(HE)染色,中性树脂胶封片后,显微镜观察并拍照。
2 结果与分析
2.1 细菌分离和LD50测定
从自然发病濒死乌鳢肝肾脾、肌肉溃烂处分离到同一株优势菌JX15。经人工感染试验,试验组乌鳢出现死亡,15 d内累计死亡达90%,而对照组试验鱼未出现任何异常。感染致死乌鳢出现体表轻微溃烂,肛门红肿,有血水从肛门流出,肝、肾、脾严重充血等症状,与自然发病症状基本一致,并从感染死亡乌鳢体内再分离到与菌株JX15一致的菌株,表明JX15株是乌鳢此次溃烂病的病原菌。建立试验鱼死亡率(%)与细菌剂量对数[lg(cfu)]的关系曲线:y=24x-123.52(图2),JX15株对乌鳢半数致死剂量LD50=3.4×105cfu·g-1。
2.2 细菌鉴定
JX15株在普通营养琼脂上28 ℃恒温培养24 h后出现大小为0.7~1.2 mm圆形、边缘无缺刻、中央凸起、灰白色、表面光滑的菌落。镜检可见分离菌株JX15为革兰氏阴性短杆菌。其理化特性见表1,由理化特性初步确定分离菌株JX15是摩氏摩根菌。将JX15的16S rRNA及gyrB基因序列与NCBI中存储的序列进行Blast比对,结果显示JX15株与摩氏摩根菌同源性最高,为99%。选取同源性较高的摩根菌属序列及水产常见病原菌的16S rRNA及gyrB基因序列构建系株是摩氏摩根菌(Morganellamorganii)。
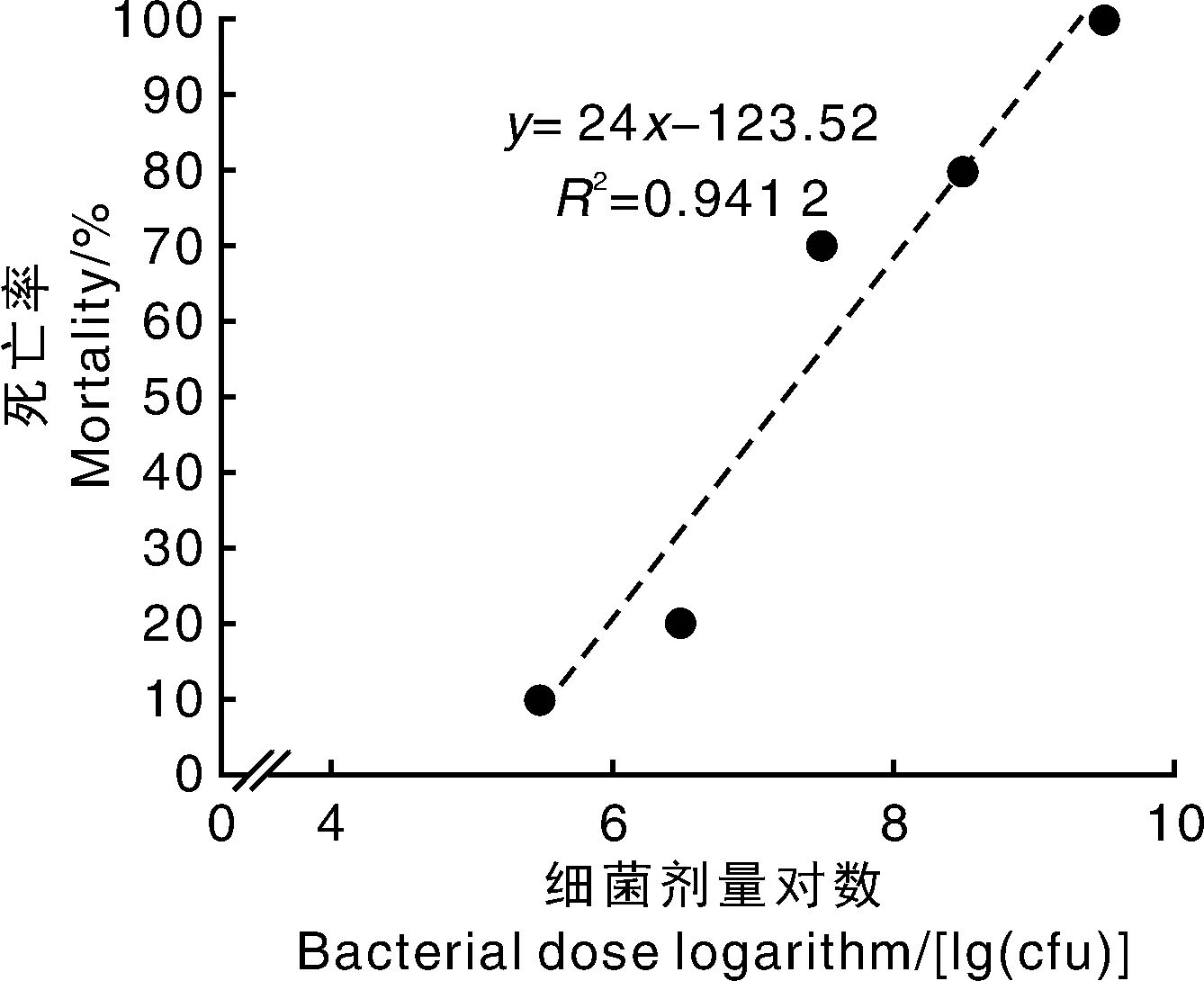
图2 乌鳢死亡率(%)与细菌剂量对数 [lg(cfu)]的关系曲线Fig.2 Relation curve of Channa argus mortality with logarithm of bacterial dose
统发育树(图3、4),结果显示,JX15株与摩氏摩根菌聚为一簇。结合理化特性测定结果判定JX15
表1菌株JX15生理生化特征
Table1Physiologic and biochemical characteristics of strain JX15
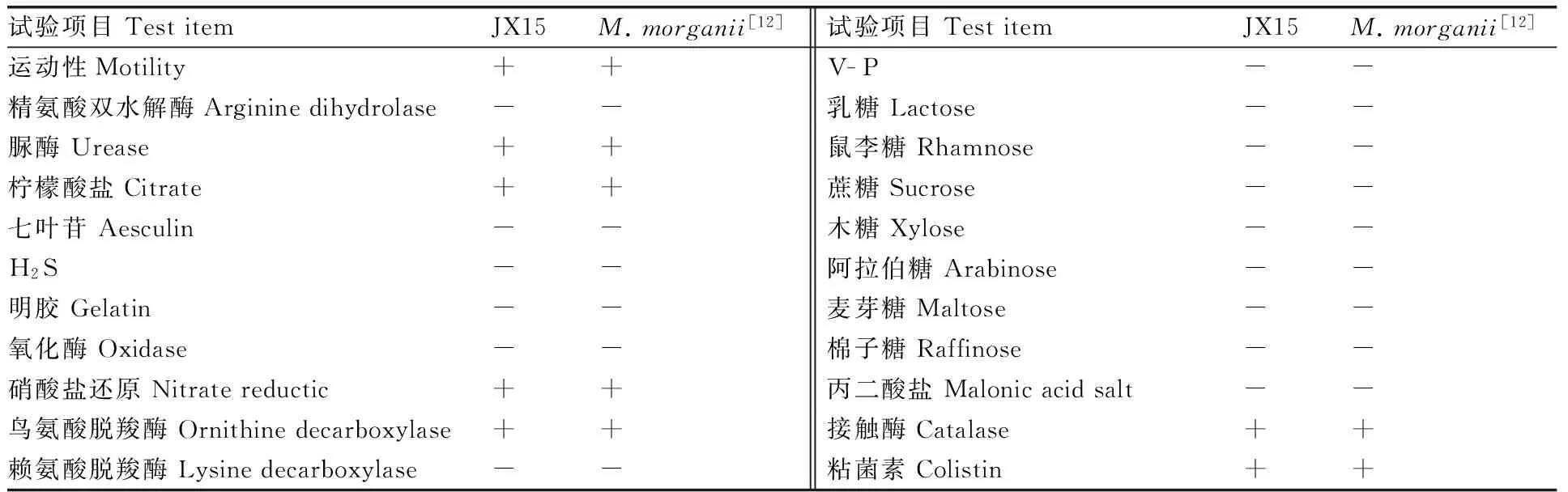
试验项目TestitemJX15M.morganii[12]试验项目TestitemJX15M.morganii[12]运动性Motility++V-P--精氨酸双水解酶Argininedihydrolase--乳糖Lactose--脲酶Urease++鼠李糖Rhamnose--柠檬酸盐Citrate++蔗糖Sucrose--七叶苷Aesculin--木糖Xylose--H2S--阿拉伯糖Arabinose--明胶Gelatin--麦芽糖Maltose--氧化酶Oxidase--棉子糖Raffinose--硝酸盐还原Nitratereductic++丙二酸盐Malonicacidsalt--鸟氨酸脱羧酶Ornithinedecarboxylase++接触酶Catalase++赖氨酸脱羧酶Lysinedecarboxylase--粘菌素Colistin++
+,阳性Positive;-,阴性Negative。
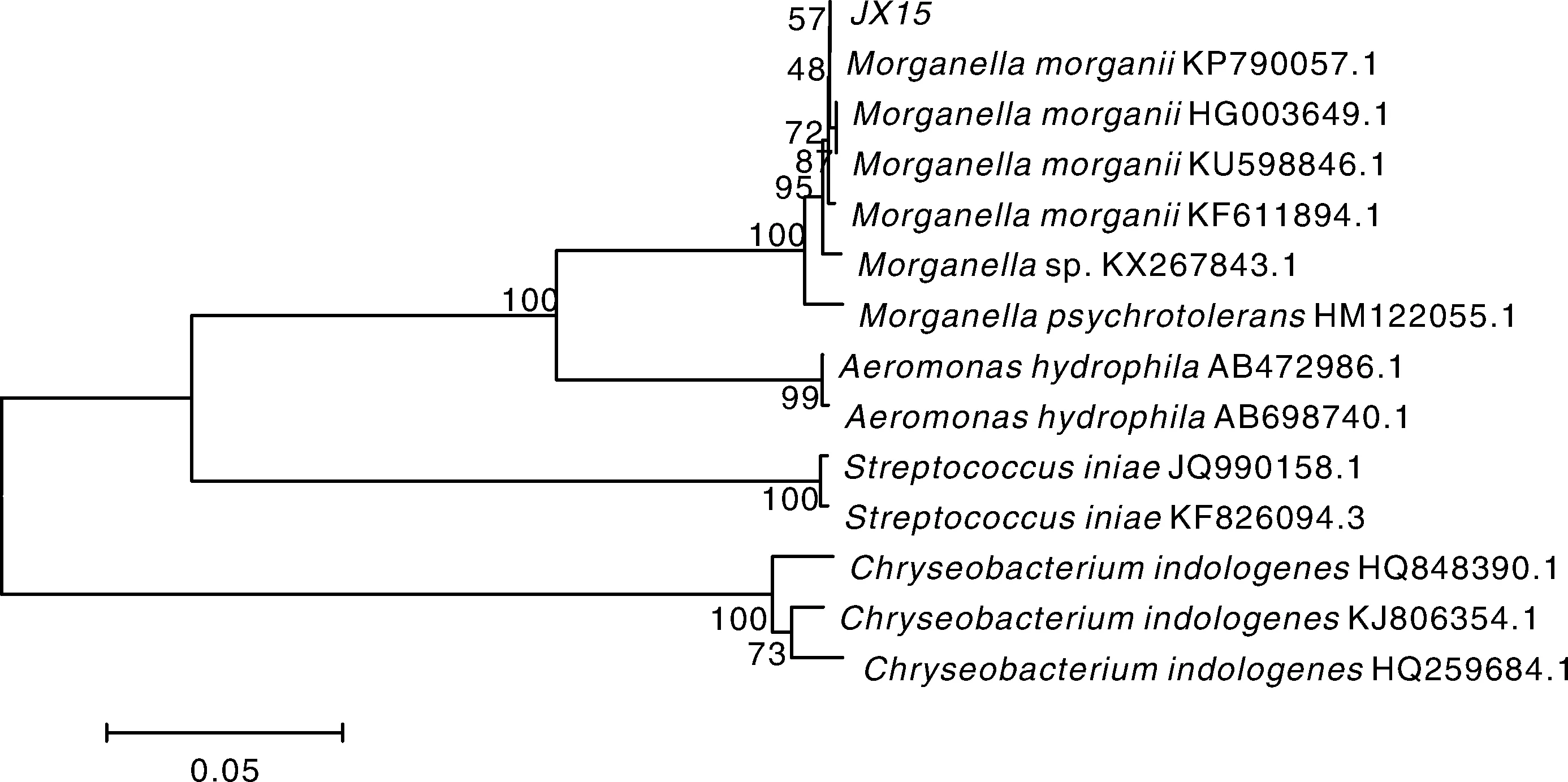
图3 JX15株根据16S rDNA 基因序列构建的系统进化树Fig.3 Phylogenetic tree of JX15 strain based on 16S rDNA gene sequence
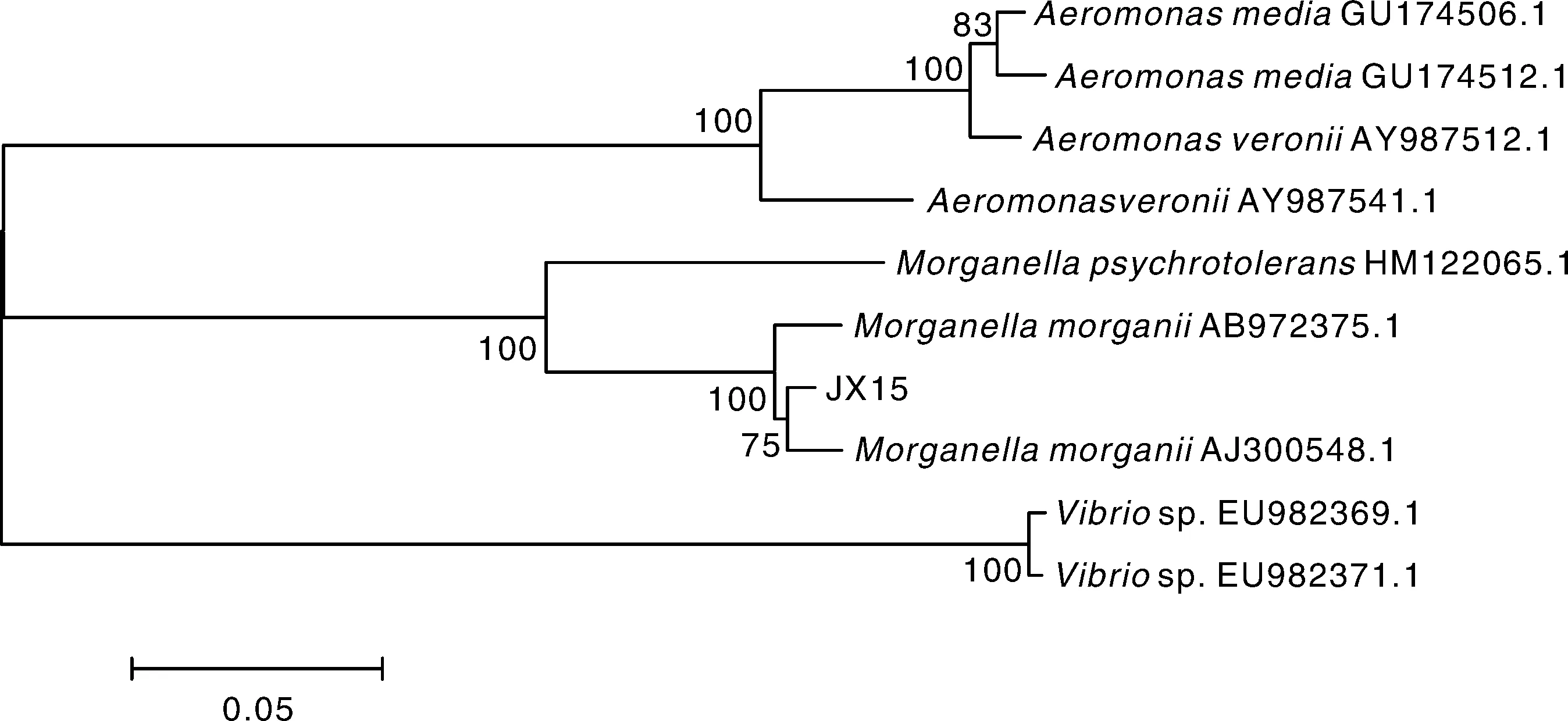
图4 JX15株根据gyrB 基因序列构建的系统进化树Fig.4 Phylogenetic tree of JX15 strain based on gyrB gene sequence
2.3 药敏特性
药敏特性结果显示:JX15株对氟苯尼考、诺氟沙星及头孢噻肟等7种药物高度敏感;对呋喃唑酮、氯霉素及卡那霉素等4种药物中度敏感;对环丙沙星、苯唑西林及青霉素等11种药物耐药。具体见表2。
2.4 组织病理观察
发病乌鳢溃烂处肌肉肿瘤细胞呈囊状排列,肿瘤细胞大小均一,胞核异型性小,如图5- A淡灰色箭头所示;囊状排列的肿瘤细胞之间充满结缔组织,如图5- A灰色箭头所示;组织中部分肌纤维萎缩,如图5- A黑色箭头所示。肝细胞胞质广泛呈空泡状,如图5- B淡灰色箭头所示;部分肝窦轻度瘀血,如图5- B灰色箭头所示。脾脏白髓中血管扩张,充满棕黄色颗粒物,如图5- C黑色箭头所示;组织中淋巴细胞数量丰富,红白髓界限清晰,未见其他明显异常,如图5- C灰色箭头所示。肠道组织中可见嗜碱性黏液,如图5- D黑色箭头所示;肠上皮局部杯状细胞增生,如图5- D淡灰色箭头所示。肾脏组织中可见片状出血灶,如图5- E黑色箭头所示;伴炎性细胞浸润,如图5- E灰色箭头所示;部分肾小管上皮细胞肿胀,胞质中可见空泡,如图5- E淡灰色箭头所示。
表2JX15株药敏试验结果
Table2Antibiotic sensitivity of strain JX15
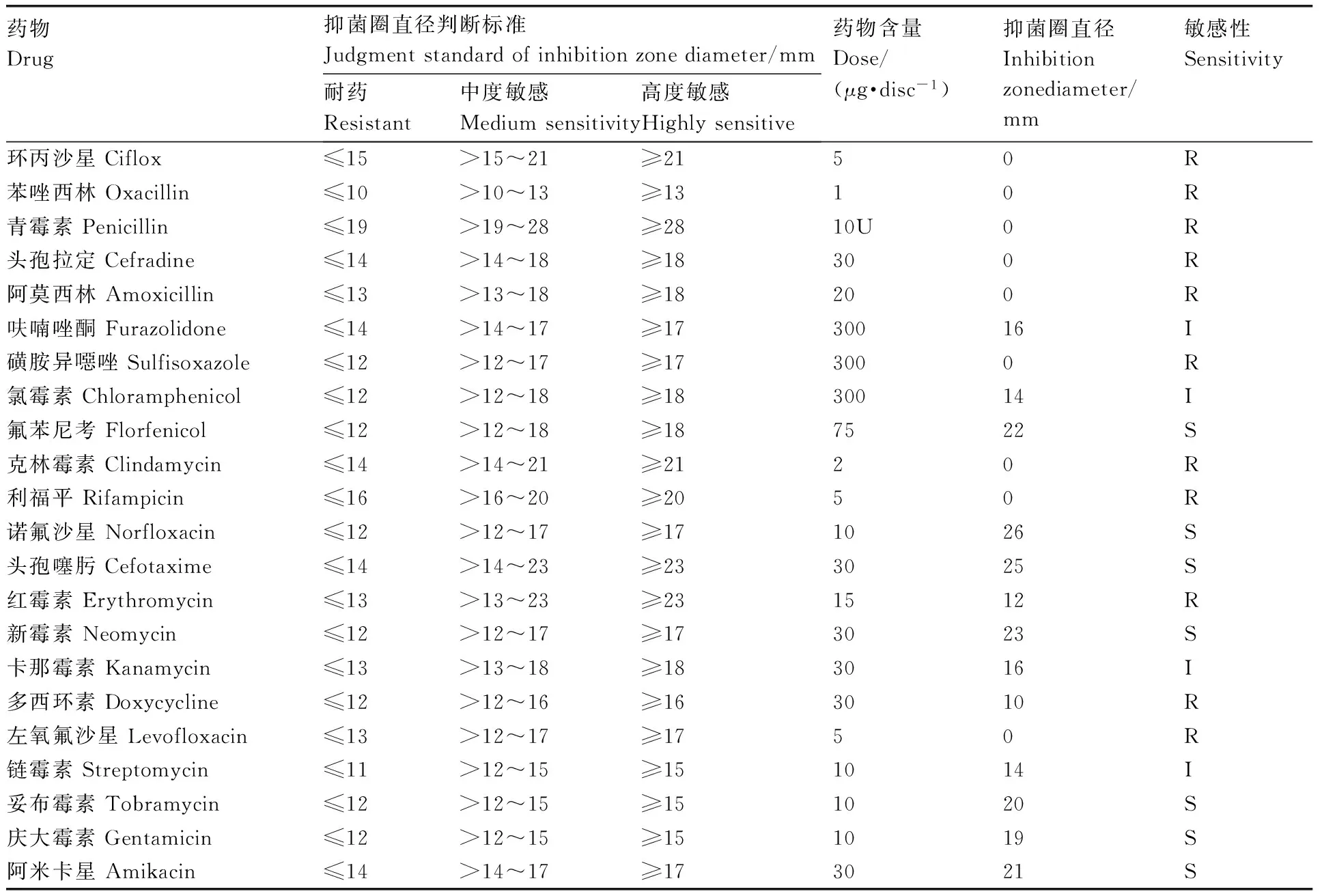
药物Drug抑菌圈直径判断标准Judgmentstandardofinhibitionzonediameter/mm耐药Resistant中度敏感Mediumsensitivity高度敏感Highlysensitive药物含量Dose/(μg·disc-1)抑菌圈直径Inhibitionzonediameter/mm敏感性Sensitivity环丙沙星Ciflox≤15>15~21≥2150R苯唑西林Oxacillin≤10>10~13≥1310R青霉素Penicillin≤19>19~28≥2810U0R头孢拉定Cefradine≤14>14~18≥18300R阿莫西林Amoxicillin≤13>13~18≥18200R呋喃唑酮Furazolidone≤14>14~17≥1730016I磺胺异噁唑Sulfisoxazole≤12>12~17≥173000R氯霉素Chloramphenicol≤12>12~18≥1830014I氟苯尼考Florfenicol≤12>12~18≥187522S克林霉素Clindamycin≤14>14~21≥2120R利福平Rifampicin≤16>16~20≥2050R诺氟沙星Norfloxacin≤12>12~17≥171026S头孢噻肟Cefotaxime≤14>14~23≥233025S红霉素Erythromycin≤13>13~23≥231512R新霉素Neomycin≤12>12~17≥173023S卡那霉素Kanamycin≤13>13~18≥183016I多西环素Doxycycline≤12>12~16≥163010R左氧氟沙星Levofloxacin≤13>12~17≥1750R链霉素Streptomycin≤11>12~15≥151014I妥布霉素Tobramycin≤12>12~15≥151020S庆大霉素Gentamicin≤12>12~15≥151019S阿米卡星Amikacin≤14>14~17≥173021S
S, 高度敏感; I,中度敏感;R, 耐药。
S, Highly sensitive; I, Medium sensitivity; R, Resistant.

A,溃烂肌肉;B,肝脏;C,脾脏;D,肠道;E,肾脏。A, Ulcerated muscle; B, Liver; C, Spleen; D, Intestines; E, Kidney.图5 肌肉和内脏组织病理切片图Fig.5 Pathological section of muscle and viscus tissues
3 讨论
摩氏摩根菌(Morganellamorganii)又称摩根氏菌,1906年被Morgan首次发现,其隶属于肠杆菌科(Enterobacteriaceae)摩根菌属(Morganella)。摩氏摩根菌在自然界分布广泛,在水体、土壤及空气中均有分布,但却是可引起严重感染的条件致病菌之一。摩氏摩根菌毒力较强,能引起包括人在内的多种动物死亡。感染致病症状主要有皮肤溃烂、肌肉出血、重要组织器官出血充血及肠道坏死等。目前已经证实摩氏摩根菌可以引起人类多种感染性疾病,如败血症、关节炎及肺炎等[17-19],是继发感染重要病原菌,危害较大。同时研究者也从患肺炎袋鼠[20]、海狸鼠[21]、蛇[22]、病鸡[23],甚至鸡蛋[24]中分离到摩氏摩根菌,表明摩氏摩根菌对陆生动物同样具有很严重的危害,可能会通过垂直传播途径进一步扩散,更进一步影响食品安全,危害人类健康。摩氏摩根菌导致水生动物致病的报道更多,黎小正等[25]及兰云等[26]均报道了黄喉拟水龟感染摩氏摩根菌死亡病例;陈永亮等[27]及孔蕾等[28]分别报道了摩氏摩根菌导致中华鳖肠道坏死病及类似疖疮样病症;李瑞伟等[29]及李雪峰等[30]研究发现,摩氏摩根菌能引起大鲵及鲈鱼体表出血;韩娜娜等[31]及王磊等[32]分别报道了摩氏摩根菌引发锦鲤及黑格尔七彩神仙鱼体表溃烂等。本研究从患病乌鳢体内分离到同一株优势菌JX15,经回归感染及鉴定,确定摩氏摩根菌为此次乌鳢发病的病原菌,对乌鳢的LD50为3.4×105cfu·g-1,显示了较强毒力。关于摩氏摩根菌引起乌鳢致病报道尚属首次。综上可以得出,摩氏摩根菌致病对象范围进一步扩大,危害性进一步增强,但其致病机制尚未完全明晰,因此深入研究摩氏摩根菌变得更加迫切。
随着现代分子生物技术发展,分子生物手段在细菌鉴定中发挥的作用越来越大。16S rRNA是一个高度保守的基因序列,但在不同种属间又具备一定的变异,因此可以很好地将细菌鉴定到属甚至种,目前已经成为细菌鉴定的重要工具[33]。但由于16S rRNA 基因序列在种内鉴定有一定的局限性,为此,常在测完16S rRNA基因后再次测定进化相对较快的gryB等基因序列[34],以使鉴定更加精准。本研究通过测定分离菌株JX15的16S rRNA及gyrB基因序列,分别构建了系统发育树,在进化树上都可以明显看到分离菌株JX15与摩氏摩根菌聚为一支,因此综合理化特性可以准确判定分离菌株为摩氏摩根菌。
目前,水生动物细菌性病害防控仍然主要依靠药物手段,但近年来,水生动物病原菌的耐药性不断增强,使得病害防控变得更加困难。摩氏摩根菌极易产生耐药性,研究表明,其对氨基糖苷类、氯霉素类、β- 内酰胺类都产生过耐药[28]。本研究发现JX15株对氟苯尼考、诺氟沙星及头孢噻肟等7种药物高度敏感,对呋喃唑酮、氯霉素及卡那霉素等4种药物中度敏感,对环丙沙星、苯唑西林及青霉素等11种药物耐药。其中对氟苯尼考等高度敏感与陈永亮等[27]研究一致。本研究结果可为乌鳢摩氏摩根菌病防控提供参考。
[1] 张新铖. 乌鳢、斑鳢及杂交种线粒体DNA全序列分析及杂种鉴定[D]. 上海:上海海洋大学, 2013.
ZHANG X C. The complete mitochondrial DNA ofChannaargus,Channamaculataand their hybrids (C.maculata♀×C.argus♂ andC.argus♀ ×C.maculata♂): genome sequence analysis and identification of hybrids [D]. Shanghai: Shanghai Ocean University, 2013. (in Chinese with English abstract)
[2] 曹铮,沈锦玉,谢荣林,等. 乌鳢结节病病原- 诺卡氏菌的分离与鉴定[J]. 水生生物学报,2009,33(2):338-341.
CAO Z, SHEN J Y, XIE R L, et al. Isolation and identification of a strain of Nocardia a pathogen of snakehead fish(Ophicephalusargus-argus)with tuberculosis[J].ActaHydrobiologicaSinica, 2009, 33(2):338-341. (in Chinese with English abstract)
[3] 郑尧兰. 乌鳢的池塘养殖技术[J]. 河南水产,2007,73(4):15-16.
ZHENG Y L. Snakehead fish pond farming techniques[J].HenanFisheries, 2007, 73(4):15-16. (in Chinese)
[4] 王二龙,汪开毓,陈德芳,等. 养殖乌鳢内脏结节病的病原分离、鉴定与药物敏感性分析[J]. 华中农业大学学报,2015,34(5):90-98.
WANG E L, WANG K Y, CHEN D F, et al. Isolation, identification and drug sensitivity test of causative pathogen of farmed snakehead (Channaargue) with visceral sarcoidosis[J].JournalofHuazhongAgriculturalUniversity, 2015, 34(5):90-98. (in Chinese with English abstract)
[5] 王国良,徐益军,金珊,等. 养殖乌鳢诺卡氏菌病及其病原研究[J]. 水生生物学报,2009,33(2):277-283.
WANG G L, XU Y J, JIN S, et al. Research on the nocardiosis and pathogen in reared snakeheadOphicephalusarguscantor[J].ActaHydrobiologicaSinica, 2009, 33(2):277-283. (in Chinese with English abstract)
[6] 王鑫毅, 韩艳楠, 金珊, 等. 乌鳢产吲哚金黄杆菌的鉴定及其胞外产物特性分析[J]. 水生生物学报, 2016, 40(3):641-646.
WANG X Y, HAN Y N, JIN S, et al. Identification and analysis on extracellular products characteristics ofChryseobacteriumindologenesisolation fromChannaargue[J].ActaHydrobiologicaSinica, 2016, 40(3):641-646. (in Chinese with English abstract)
[7] 陈言峰,周爱国,邹记兴,等. 乌鳢溃烂病病原分析[J]. 水产科技情报,2015(4):213-216.
CHEN Y F, ZHOU A G, ZOU J X, et al. The pathogen analysis of snakehead canker disease[J].FisheriesScience&TechnologyInformation, 2015 (4):213-216. (in Chinese with English abstract)
[8] 舒新华,金燮理,肖克宇,等. 乌鳢腹水病病原的分离和鉴定[J]. 湖南农业大学学报, 1998,24(4):286-290.
SHU X H, JIN Y L, XIAO K Y, et al. Identification and isolation of pathogenic bacteria of snakehead’s ascitesosis[J].JournalofHunanAgriculturalUniversity, 1998, 24(4):286-290. (in Chinese with English abstract)
[9] 曾慷,舒新华,金燮理,等. 乌鳢腐皮病致病细菌的研究[J]. 湖南农业大学学报(自然科学版),1999,25(5):395-398.
ZENG K, SHU X H, JIN J L, et al. Studies on pathogen of snakehead’s putrid skin disease[J].JournalofHunanAgriculturalUniversity(NaturalSciences), 1999, 25(5):395-398. (in Chinese with English abstract)
[10] 康元环,孟庆峰,夏京津,等. 乌鳢致病性维氏气单胞菌的分离鉴定及生物学特性研究[J]. 动物医学进展,2014,35(5):40-43.
KANG Y H, MENG Q F, XIA J J, et al. Isolation, identification and study on biological characteristics ofAeromonasveroniiisolated fromChannaargus[J].ProgressinVeterinaryMedicine, 2014, 35(5):40-43. (in Chinese with English abstract)
[11] 徐叔云,卞如濂,陈修. 药理实验方法学[M]. 北京:人民卫生出版社,2002:192.
[12] 东秀珠,蔡妙英. 常见细菌系统鉴定手册[M]. 北京:科学出版社,2001:97.
[13] 赖晓健,杨方园,李忠琴. 太平洋双色鳗鲡(Anguillabicolorpacifica)致病性类志贺邻单胞菌的鉴定和中药敏感性研究[J]. 海洋与湖沼,2016,47(6):1185-1191.
LAI X J, YANG F Y, LI Z Q, et al. PathogenicPlesiomonassheigelloidesisolated fromAnguillabicolorpacifica: identification and sensitivity to Chinese herbs[J].OceanologiaetLimnologiaSinica, 2016, 47(6):1185-1191. (in Chinese with English abstract)
[14] YAMAMOTO S, HARAYAMA S. PCR amplification and direct sequencing ofgyrBgenes with universal primers and their application to the detection and taxonomic analysis ofPseudomonasputidastrains[J].AppliedandEnvironmentalMicrobiology, 1995, 61(3):1104-1109.
[15] 陈雪峰,杨国梁,高强,等. 罗氏沼虾(Macrobrachiumrosenbergii)幼体新暴发病病原阴沟肠杆菌的分离鉴定[J]. 海洋与湖沼,2015,46(6):1467-1477.
CHEN X F, YANG G L, GAO Q, et al. Identification and isolation of a novel bacterial pathogen (Enterobactercloacae) from disease larvae of giant freshwater prawnMacrobrachiumrosenbergii[J].OceanologiaetLimnologiaSinica, 2015, 46(6):1467-1477. (in Chinese with English abstract)
[16] WIKLER M A. Performance standards for antimicrobial susceptibility testing [M]. USA:Clinical Laboratory Standards Institute, 2009.
[17] CHEN Y T, PENG H L, SHIA W C, et al. Whole- genome sequencing and identification ofMorganellamorganiiKT pathogenicity- related genes[J].BMCGenomics, 2012, 13(Suppl. 7):S4.
[18] MANDELL G L, BENNETT J E, DOLIN R. Principles and practice of infectious diseases [M]. 4th ed. New York: Churchill Livingstone Inc, 1994:1748.
[19] GOLUBIC- CEPULIC B, BUDIMIR A, PLECKO V, et al.Morganellamorganiicausing fatal sepsis in a platelet recipient and also isolated from a donor’s stool[J].TransfusionMedicine, 2004,14(3):237-240.
[20] ZHAO Y, LI W J, DU X B, et al. Phylogenetic analysis and identification of biological characterization ofMorganellamorganiiin Kangaroo[J].ChinaAnimalHusbandry&VeterinaryMedicine, 2010, 37(3):48-51.
[21] 陈永林,关孚时,李庆珍. 海狸鼠摩根氏菌病病原鉴定[J]. 中国兽医杂志,1995,21(8):24-25
CHEN Y L, GUAN F S, LI Q Z. Nutria Morgan’s disease pathogen identification[J].ChineseJournalofVeterinaryDrug, 1995, 21(8):24-25. (in Chinese with English abstract)
[22] 黄尚彪,罗廷荣,吴文德. 蛇口腔炎病原菌的分离与鉴定[J]. 广西农业生物科学,2004,23(1):31-34.
HUANG S B, LUO T R, WU W D. Isolation and identification of pathogenic bacteria from stomatitis of snake[J].GuangxiAgriculturalBiologicalScience, 2004, 23(1):31-34. (in Chinese with English abstract)
[23] ZHAO C G, TANG N, WU Y, et al. First reported fatalMorganellamorganiiinfections in chickens[J].VeterinaryMicrobiology, 2012, 156(3/4):452-455.
[24] 于恩琪,张笛,李东明,等. 蛋源摩氏摩根菌分离、鉴定及遗传进化分析[J]. 中国畜牧兽医,2013,40(8):176-179.
YU E Q, ZHANG D, LI D M, et al. Isolation, identification and genetic evolution analysis ofMorganellamorganiifrom eggs[J].ChinaAnimalHusbandryandVeterinary, 2013, 40(8):176-179. (in Chinese with English abstract)
[25] 黎小正,韦信贤,童桂香,等. 黄喉拟水龟摩氏摩根菌的分离鉴定及系统发育分析[J]. 上海海洋大学学报,2010,19(3):358-363.
LI X Z, WEI X X, TONG G X, et al. Isolation, identification and phylogenetic analysis ofMorganellamorganiiinMauremysmuticaCantor[J].JournalofShanghaiOceanUniversity, 2010, 19(3):358-363. (in Chinese with English abstract)
[26] 兰云,胡秀彩,吕爱军,等. 黄喉拟水龟摩氏摩根菌的分离鉴定及药敏试验[J]. 水生生物学报,2014,38(6):1173-1178.
LAN Y, HU X C, LYU A J, et al. Isolation, identification and antibiotic sensitivity test ofMorganellamorganiifromMauremysmutica[J].ActaHydrobiologicaSinica, 2014, 38(6):1173-1178. (in Chinese with English abstract)
[27] 陈永亮,高晓华,李怡,等. 鳖源摩氏摩根菌分离鉴定及药敏特性分析[J]. 南方农业学报,2015,46(11):2046-2052.
CHEN Y L, GAO X H, LI Y, et al. Isolation, identification and antibiotic sensitivity test ofMorganellamorganiifromTrionyxsinensis[J].JournalofSouthernAgriculture, 2015, 46(11):2046-2052. (in Chinese with English abstract)
[28] 孔蕾,朱凝瑜,贝亦江,等. 中华鳖(Pelodiscussinensis)摩氏摩根菌(Morganellamorganii)的鉴定及致病性研究[J]. 海洋与湖沼,2013,44(3):722-727.
KONG L, ZHU N Y, BEI Y J, et al. Isolation and identification of pathogenicMorganellamorganiiisolates fromChinesesoft-shelledturtlePelodiscussinensis[J].OceanologiaetLimnologiaSinica, 2013, 44(3):722-727. (in Chinese with English abstract)
[29] 李瑞伟,曾令兵,张辉,等. 患病大鲵摩氏摩根菌的分离与鉴定[J]. 畜牧与兽医,2014,46(1):28-32.
LI R W, ZENG L B, ZHANG H, et al. Isolation and identification ofMorganellamorganiifrom diseased giant salamanders[J].AnimalHusbandry&VeterinaryMedicine, 2014, 46(1):28-32. (in Chinese with English abstract)
[30] 李雪峰,王利. 鲈鱼摩氏摩根菌的鉴定及药敏试验[J]. 动物医学进展,2015,36(2):65-68.
LI X F, WANG L. Identification and drug resistance analysis ofMorganellamorganiiisolated fromLateolabraxJaponicus[J].ProgressinVeterinaryMedicine, 2015, 36(2):65-68. (in Chinese with English abstract)
[31] 韩娜娜,刘万建,耿伟光,等. 锦鲤摩氏摩根氏菌的分离鉴定与药敏性研究[J]. 中国预防兽医学报,2013,35(9):729-732.
HAN N N, LIU W J, GENG W G, et al. Isolation, identification of a pathogenicMorganellamorganiifrom ornamental koi(Cyprinuscarpiokoi)[J].ChineseJournalofPreventiveVeterinaryMedicine, 2013, 35(9):729-732. (in Chinese with English abstract)
[32] 王磊,孙培英,陈再忠,等. 黑格尔七彩神仙鱼摩氏摩根菌分离鉴定及耐药性分析[J]. 南方农业学报,2016,47(10):1772-1777.
WANG L, SUN P Y, CHEN Z Z, et al. Isolation, identification and resistance analysis ofMorganellamorganiifromSymphysodondiscus[J].JournalofSouthernAgriculture, 2016, 47(10):1772-1777. (in Chinese with English abstract)
[33] COHAN F M. Bacterial species and speciation[J].SystematicBiology, 2001, 50(4):513-524.
[34] WATANABE K, YAMAMOTO S, HINO S, et al. Population dynamics of phenol- degrading bacteria in activated sludge determined bygyrB- targeted quantitative PCR[J].AppliedandEnvironmentalMicrobiology, 1998, 64(4):1203-1209.

