QuEChERS- LC- MS/MS测定芹菜中吡虫啉和唑螨酯
刘 英 ,李韵之,陈列忠,王彦华,许振岚,蒋金花,汤 涛,陈文学,王 强,*,张昌朋,*
(1.海南大学 食品学院,海南 海口 570228;2.浙江省农业科学院 农产品质量标准研究所,省部共建国家重点实验室培育基地——浙江省植物有害生物防控重点实验室,农业部农药残留检测重点实验室,浙江 杭州 310021)
吡虫啉(imidacloprid),化学名称为1- (6- 氯吡啶- 3- 吡啶基甲基)- N- 硝基亚咪唑烷- 2- 基胺,是内吸性新烟碱类杀虫剂,主要防治蚜虫、飞虱、粉虱、叶蝉等害虫[1]。吡虫啉通过与烟碱型乙酰胆碱受体结合,干扰昆虫中枢神经系统的正常传导,进而杀死害虫[2]。唑螨酯(fenpyroximate),化学名称(E)- α- (1,3- 二甲基- 5- 苯氧基吡唑- 4- 基亚甲基氨基氧)- 对甲苯甲酸叔丁酯,是非内吸性苯氧吡唑类杀螨剂,主要防治红叶螨、全爪叶螨、小菜蛾、斜纹夜蛾、白粉虱等害虫[3]。唑螨酯通过选择性抑制昆虫体内细胞线粒体泛醌过氧化物酶,阻断线粒体氧化呼吸链而起到杀虫作用[3]。
目前,关于吡虫啉的残留分析方法主要有气相色谱法[4-5]、高相液相色谱法[6-7]和液相色谱串联质谱法[8-9],而关于唑螨酯的残留分析方法主要是高效液相色谱法[10-13]和液相色谱串联质谱法[14-16]。已报道的分析方法中多采用固相萃取小柱或层析柱净化,前处理步骤繁琐,检测周期长。QuEChERS(Quick, Easy, Cheap, Effective, Rugged and Safe)前处理技术是美国化学家Steven J. Lehotay和德国Michelangelo Anastassiadas提出的一种快速、简便、廉价、高效、耐用且安全的前处理技术[17-18]。该技术采用乙腈提取分离目标物,加入MgSO4或NaCl等盐类除水,加入乙二胺- N- 丙基硅烷(PSA)等吸附剂实现快速净化。与传统方法相比,QuEChERS前处理技术具有分析对象范围广、基质适用范围广、稳定性好、低成本、操作简单快捷等优点[19]。本研究采用QuEChERS前处理技术及液相色谱- 串联三重四极杆质谱联用仪(liquid chromatography- tandem mass spectrometry,LC- MS/MS),建立了芹菜根、茎、叶中吡虫啉、唑螨酯残留的分析方法,该方法操作简单、耗时短,且灵敏度、准确度、精密度均符合农药残留量分析要求。
1 材料与方法
1.1 仪器设备
三重四极杆液相色谱质谱联用仪(岛津LCMS- 8050);SPS402F电子天平(0.01 g);AB135- S电子天平(0.000 1 g);TYZD- ⅡA振荡器(姜堰市天仪电子仪器有限公司);VTX- 3000L涡旋仪;Sigma高速离心机;TD5A- WS台式大容量离心机(金坛市金南仪器制造有限公司)。
1.2 试剂与耗材
乙腈(色谱纯,德国默克股份两合公司),甲酸(色谱纯,美国Anaqua Chemicals),乙腈(分析纯,上海凌峰化学试剂有限公司)。WondaPak QuEChERS提取盐(NaCl 1 g,Na3C6H5O7·2H2O 1 g,Na2C6H6O7·1.5H2O 0.5 g,MgSO44 g)购自上海岛津技迩商贸有限公司;2 mL Agela Cleanert MAS- Q净化管(C1850 mg,PSA 50 mg,MgSO4150 mg)、2 mL Agela Cleanert MAS- Q净化管(C1850 mg,PSA 50 mg,PC 8 mg,MgSO4150 mg)、2 mL Agela Cleanert MAS- Q净化管(C1850 mg,PSA 50 mg, PC 50 mg,MgSO4150 mg) ,均购自天津博纳艾杰尔科技有限公司。吡虫啉(纯度99.0%)、唑螨酯(纯度98.0%)标准品均购自德国Dr. Ehrenstorfer GmbH公司。
1.3 样品前处理方法的优化
1.3.1 提取条件的优化
在优化提取条件中使用的空白基质是芹菜植株(即芹菜茎和叶)。在芹菜提取过程中分别用振荡器振荡提取2、30、60 min,比较3种不同提取时间对芹菜中吡虫啉、唑螨酯提取效果的影响。提取时间确定后,分别加入1.5 g无水乙酸钠+6 g无水硫酸镁和WondaPak QuEChERS提取盐,比较不同缓冲盐对吡虫啉、唑螨酯提取效果的影响。
1.3.2 净化条件的优化
在优化净化条件中使用的空白基质是芹菜根、茎、叶。芹菜根、茎、叶净化过程中分别使用具有不同石墨化碳(PestiCarb,PC)含量的净化管:Agela Cleanert MAS- Q净化管(C1850 mg,PSA 50 mg,MgSO4150 mg)、Agela Cleanert MAS- Q净化管(C1850 mg,PSA 50 mg,PC 8 mg,MgSO4150 mg)、Agela Cleanert MAS- Q净化管(C1850 mg,PSA 50 mg,PC 50 mg, MgSO4150 mg)进行净化处理,比较PC含量对芹菜根、茎、叶中吡虫啉、唑螨酯净化效果的影响。
1.4 样品前处理
1.4.1 提取
芹菜根:称取5 g(精确至0.01 g)样品于50 mL塑料离心管中,加入20 mL乙腈,振荡器振荡提取30 min后,加入WondaPak QuEChERS提取盐,2 810g离心5 min,待净化。
芹菜茎、叶:称取10 g(精确至0.01 g)样品于50 mL塑料离心管中,加入20 mL乙腈,振荡器振荡提取30 min后,加入WondaPak QuEChERS提取盐,2 810g离心5 min,待净化。
1.4.2 净化
芹菜根、茎:准确量取1.5 mL待净化上清液加入2 mL Agela Cleanert MAS- Q净化管(C1850 mg,PSA 50 mg, PC 8 mg, MgSO4150 mg)中,涡旋振荡1 min混匀,7 426g离心5 min,取上清液过0.22 μm有机滤膜,待上机测定。
芹菜叶:准确量取1.5 mL待净化上清液加入2 mL Agela Cleanert MAS- Q净化管(C1850 mg,PSA 50 mg,PC 50 mg,MgSO4150 mg)中,涡旋振荡1 min混匀,7 426g离心5 min,取上清液过0.22 μm有机滤膜,待上机测定。
1.5 仪器测定条件
1.5.1 液相色谱条件
色谱柱:Waters acquity UPLC®BEH C18(1.7 μm,2.1×100 mm);A相为0.1%甲酸水溶液(20%),B相为乙腈(80%);流速0.20 mL·min-1;柱温40 ℃;进样体积1.0 μL。
1.5.2 质谱条件
电离方式:正离子电离(ESI+),采用MRM多反应监测;Interface电压4.0 kV;雾化气流速3.0 L·min-1;干燥气流速10.0 L·min-1;加热气流速10.0 L·min-1;Interface温度300 ℃;DL温度250 ℃;Heat Block温度400 ℃;吡虫啉定量离子对(m/z)为256.05>175.1*,定性离子对(m/z)为256.05>209.05;唑螨酯定量离子对(m/z)为422.20>366.10*,定性离子对(m/z)为422.20>138.10。
1.6 标准曲线的绘制
分别称取吡虫啉、唑螨酯标准品用乙腈定容,得到质量浓度为100 mg·L-1的吡虫啉、唑螨酯标准母液。采用梯度稀释法,用乙腈分别配制0.005、0.010、0.020、0.050、0.100、0.200、0.500 mg·L-1质量浓度的吡虫啉、唑螨酯标准工作溶液。采用外标法定量,在1.5节仪器测定条件下进行测定,并用峰面积- 质量浓度绘制标准曲线。
2 结果与分析
2.1 提取方法的确定
对振荡提取时间进行了优化,分别考察了振荡2、30、60 min的添加回收率。由图1可知,振荡2 min,吡虫啉和唑螨酯回收率分别是53.85%、74.28%,其中吡虫啉的回收率低于70%,这可能是由于振荡时间不够,导致目标物吡虫啉没有提取出来。振荡30 min,吡虫啉和唑螨酯回收率分别是117.78%、94.03%。振荡60 min,吡虫啉和唑螨酯回收率分别是116.60%、110.88%。为保证加标回收率、缩短提取时间,同时考虑到尽可能减弱基质干扰,选取振荡提取时间为30 min。
对比加入1.5 g无水乙酸钠+6 g无水硫酸镁和WondaPak QuEChERS提取盐的回收率和相对标准偏差(relative standard deviations,RSDs)。结果表明,加入1.5 g无水乙酸钠、6 g无水硫酸镁时,吡虫啉的回收率和RSDs分别是117.78%和16.48%,唑螨酯的回收率和RSDs分别是74.28%、11.49%;加入WondaPak QuEChERS提取盐时,吡虫啉的回收率和RSDs分别是103.10%和3.74%,唑螨酯的回收率和RSDs分别是94.03%、4.75%,表明使用WondaPak QuEChERS提取盐体系更加稳定。因此,选取WondaPak QuEChERS提取盐作为体系缓冲盐。
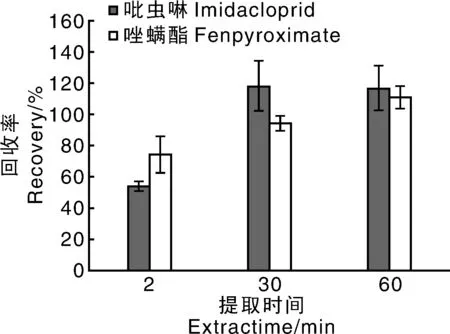
图1 提取时间对回收率的影响(n=3)Fig.1 Influence of extraction time on recovery (n=3)
2.2 净化方法的确定
比较PC含量对芹菜根、茎、叶中吡虫啉及唑螨酯添加回收率的影响以及对芹菜根、茎、叶净化效果的影响。结果(表1,图2)发现,Agela Cleanert MAS- Q净化管中的PC含量分别为0、8 mg时,吡虫啉在芹菜根、茎中的添加回收率为78.25%~113.36%,唑螨酯在芹菜根、茎中的添加回收率为78.76%~94.12%,吡虫啉及唑螨酯在芹菜根、茎中的添加回收率均能达到要求,且对芹菜根、茎的净化效果较好;吡虫啉在芹菜叶中的添加回收率分别为102.10%、112.08%,唑螨酯在芹菜叶中的添加回收率分别为96.15%、100.98%,吡虫啉及唑螨酯在芹菜叶中的添加回收率均能达到要求但芹菜叶的净化液颜色过深,0和8 mg PC不能有效去除色素等杂质。PC含量为50 mg时,吡虫啉在芹菜根、茎、叶中的添加回收率分别是81.07%、74.97%、96.32%,唑螨酯在芹菜根、茎、叶中的添加回收率分别是23.58%、18.40%、87.86%,对芹菜根、茎、叶的净化效果均较好,但唑螨酯在芹菜根、茎中的添加回收率低于70%,不能满足农药残留分析要求。综合考虑回收率和净化效果,芹菜叶选取含50 mg PC的2 mL Agela Cleanert MAS- Q净化管(C1850 mg,PSA 50 mg,PC 50 mg,MgSO4150 mg)进行净化,芹菜根、茎选取含8 mg PC的2 mL Agela Cleanert MAS- Q净化管(C1850 mg,PSA 50 mg,PC 8 mg,MgSO4150 mg)进行净化。
2.3 线性关系
经最小二乘法拟合得标准曲线如下:吡虫啉线性方程为y=5562220.4355x+21841.3211,R2=0.999 0;唑螨酯线性方程为y=21183203.2014x+37039.7381,R2=0.999 7。表明吡虫啉、唑螨酯在0.005~0.500 mg·L-1范围内线性关系良好。标准溶液典型色谱图见图3。
表1PC含量对吡虫啉及唑螨酯在芹菜根、茎、叶回收率的影响
Table1Effects of PC content on the recovery of imidacloprid and fenpyroximate in roots, stems and leaves of celery
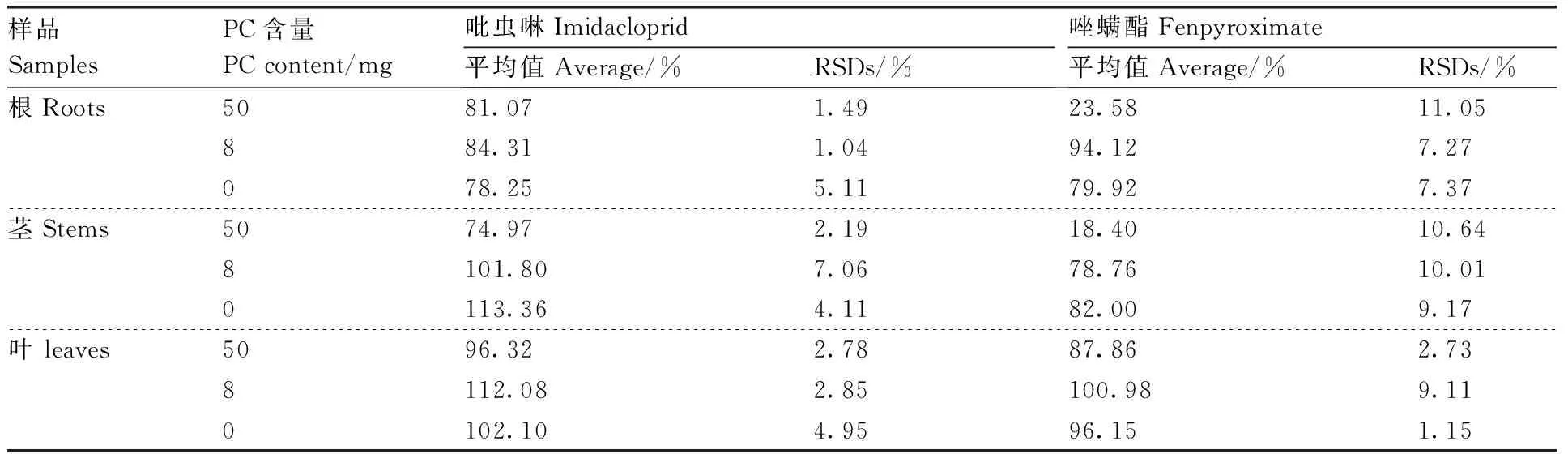
样品SamplesPC含量PCcontent/mg吡虫啉Imidacloprid平均值Average/%RSDs/%唑螨酯Fenpyroximate平均值Average/%RSDs/%根Roots5081.071.4923.5811.05884.311.0494.127.27078.255.1179.927.37茎Stems5074.972.1918.4010.648101.807.0678.7610.010113.364.1182.009.17叶leaves5096.322.7887.862.738112.082.85100.989.110102.104.9596.151.15

A,芹菜叶;B,芹菜茎;C,芹菜根。A, leaves of celery; B, stems of celery; C, roots of celery.图2 PC含量对芹菜根、茎、叶净化效果的影响Fig.2 Effects of PC content on purification of roots, stems and leaves of celery
2.4 方法的灵敏度
方法的灵敏度用检出限(limit of detections,LODs,S/N=3)和定量限(Limit of quantitations LOQs,S/N=10)来表示。吡虫啉、唑螨酯的LODs分别是0.120、0.015 μg·kg-1,吡虫啉在芹菜根、茎、叶的LOQs分别是1.65、0.87、1.08 μg·kg-1,唑螨酯在芹菜根、茎、叶的LOQs分别是1.24、0.75、0.78 μg·kg-1。
2.5 方法的准确度、精密度
在空白芹菜根、茎、叶样品中分别添加吡虫啉、唑螨酯标准溶液,使空白芹菜根、茎、叶样品中吡虫啉、唑螨酯的质量分数分别为0.05、0.10和1.00 mg·kg-1,每个质量分数进行5个重复,按照1.4节样品前处理方法进行提取、净化以及1.5节仪器测定条件进行测定,进行添加回收试验。结果表明,吡虫啉在芹菜根、茎、叶中的平均添加回收率为77.15%~103.48%,RSDs为1.40%~9.97%(表2)。唑螨酯在芹菜根、茎、叶中的平均添加回收率为77.35%~100.42%,RSDs为2.01%~6.95%(表3)。吡虫啉、唑螨酯在芹菜根、茎、叶中的添加回收率为77.15%~103.48%,RSDs为1.40%~9.97%,表明该方法具有较好的准确度和精密度,符合欧盟标准EN 15662∶2008添加回收率在70%~110%,RSDs低于10%的要求[20]。
2.6 该方法在芹菜中的应用
温室条件下,10%吡虫啉可湿性粉剂以300 g a.i.hm-2剂量,5%唑螨酯悬浮剂以375 g a.i.hm-2剂量喷施到芹菜植株上。施药后7 d,采集芹菜样品进行测定。结果(图3)表明,吡虫啉在芹菜根、茎、叶的残留量分别是0.60、0.32和0.75 mg·kg-1,唑螨酯在芹菜根、茎、叶的残留量分别是1.18、0.97和5.76 mg·kg-1。

A,吡虫啉和唑螨酯标准溶液(0.01 mg·L-1)色谱图;B,吡虫啉实测样品色谱图;C,唑螨酯实测样品色谱图。A, Chromatogram of imidacloprid and fenpyroximate in standard solution; B, Chromatogram of imidacloprid in samples; C, Chromatogram of fenpyroximate in samples.图3 吡虫啉和唑螨酯标准溶液(0.01 mg·L-1)及实测样品色谱图Fig.3 Chromatogram of imidacloprid and fenpyroximate in standard solution (0.01 mg·L-1) and samples
表2吡虫啉在芹菜根、茎、叶中的添加回收率
Table2Recovery and RSDs of imidacloprid in the roots, stems and leaves of celery
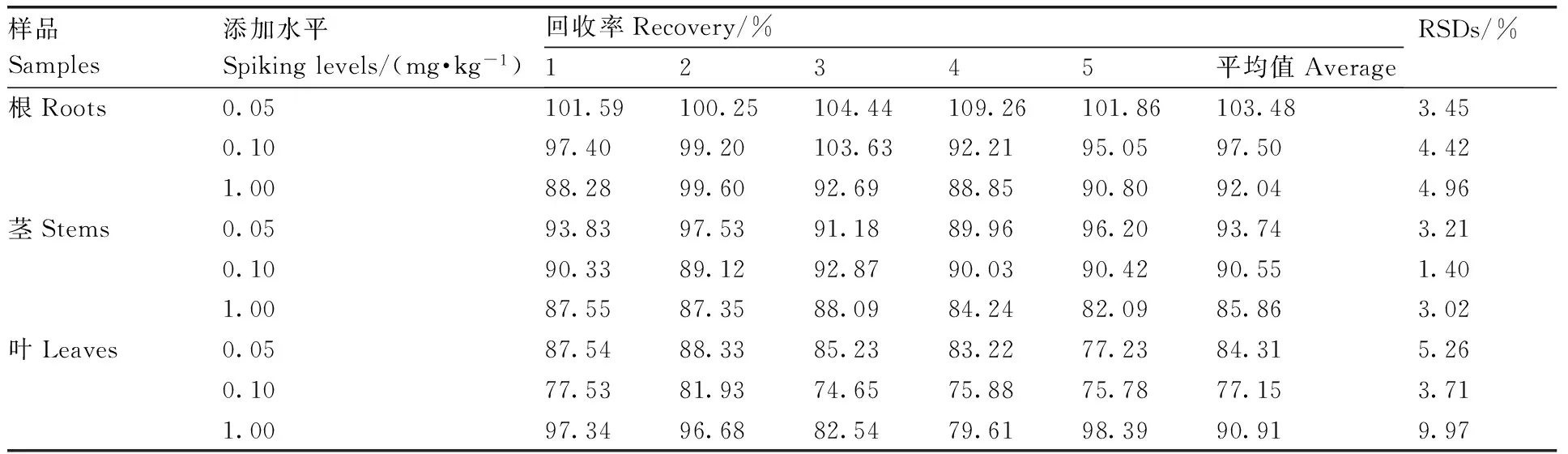
样品Samples添加水平Spikinglevels/(mg·kg-1)回收率Recovery/%12345平均值AverageRSDs/%根Roots0.05101.59100.25104.44109.26101.86103.483.450.1097.4099.20103.6392.2195.0597.504.421.0088.2899.6092.6988.8590.8092.044.96茎Stems0.0593.8397.5391.1889.9696.2093.743.210.1090.3389.1292.8790.0390.4290.551.401.0087.5587.3588.0984.2482.0985.863.02叶Leaves0.0587.5488.3385.2383.2277.2384.315.260.1077.5381.9374.6575.8875.7877.153.711.0097.3496.6882.5479.6198.3990.919.97
表3唑螨酯在芹菜根、茎、叶中的添加回收率
Table3Recovery and RSDs of fenpyroximate in the roots, stems and leaves of celery
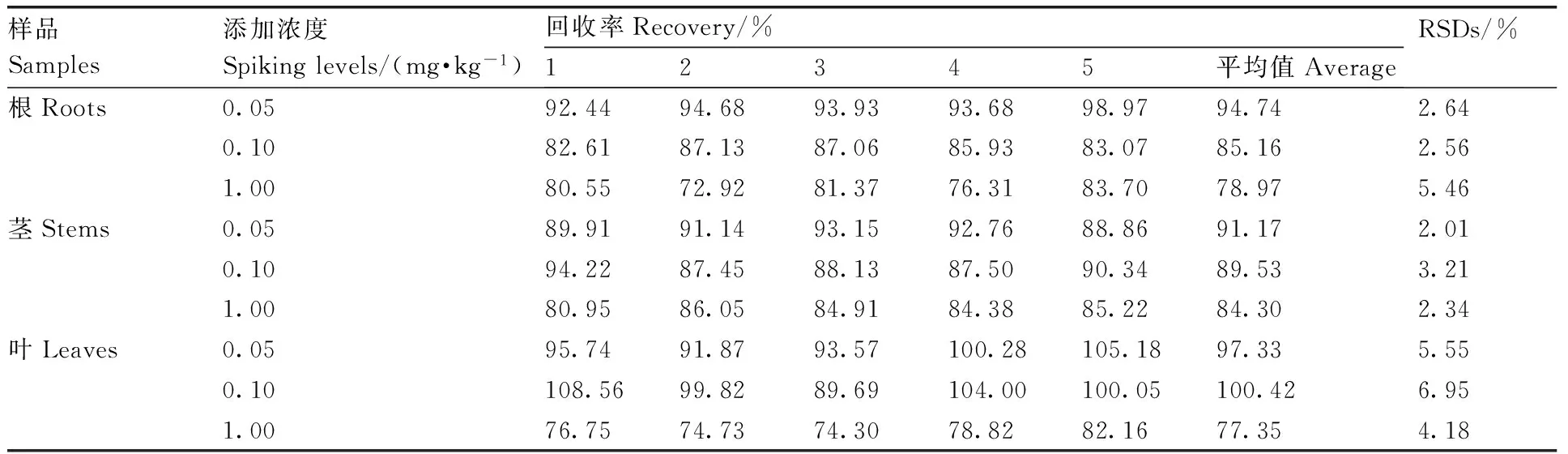
样品Samples添加浓度Spikinglevels/(mg·kg-1)回收率Recovery/%12345平均值AverageRSDs/%根Roots0.0592.4494.6893.9393.6898.9794.742.640.1082.6187.1387.0685.9383.0785.162.561.0080.5572.9281.3776.3183.7078.975.46茎Stems0.0589.9191.1493.1592.7688.8691.172.010.1094.2287.4588.1387.5090.3489.533.211.0080.9586.0584.9184.3885.2284.302.34叶Leaves0.0595.7491.8793.57100.28105.1897.335.550.10108.5699.8289.69104.00100.05100.426.951.0076.7574.7374.3078.8282.1677.354.18
3 结论与讨论
本试验通过乙腈振荡提取,PC、PSA、C18等净化材料净化,建立了吡虫啉和唑螨酯在芹菜根、茎、叶中的QuEChERS- LC- MS/MS分析检测方法。净化过程中,文献多采用弗罗里硅土、氧化铝等层析柱或氨基柱、C18等固相萃取小柱进行净化,但在上样、淋洗及洗脱等过程中需要大量有机溶剂且操作较为繁琐。本试验过程中使用商品化净化材料(Agela Cleanert MAS- Q净化管),因而无需上样、淋洗、洗脱等过程,减少了有机溶剂的大量使用,且该操作方法简单、方便、快速。
吡虫啉、唑螨酯在0.005~0.5 mg·L-1的范围内线性关系良好,样品低、中、高三档添加浓度的平均添加回收率为77.15%~103.48%,RSDs为1.40%~9.97%,方法的准确性及稳定性都符合欧盟标准EN 15662∶2008[20],且净化效果好,检测浓度较低,适合其在芹菜样品中的残留量分析。
[1] 王圣印, 刘永杰, 周仙红, 等. 新烟碱类杀虫剂吡虫啉的研究进展[J]. 江西农业学报, 2012, 24(3): 76-79.
WANG S Y, LIU Y J, ZHOU X H, et al. Research progress in new neonicotinoid insecticide imidacloprid[J].ActaAgriculturaeJiangxi, 2012, 24(3): 76-79. (in Chinese with English abstract)
[2] 段兵, 何太喜, 范媛媛, 等. 凝胶渗透色谱- 超高效液相色谱- 串联质谱测定茶叶中吡虫啉和啶虫脒[J]. 食品科学, 2016, 37(4): 238-241.
DUAN B, HE T X, FANG Y Y, et al. Determination of imidacloprid and acetamiprid in tea by Gel Permeation Chromatography- Ultra Performance Liquid Chromatography- Tandem Mass Spectrometry[J].FoodScience, 2016, 37(4): 238-241. (in Chinese with English abstract)
[3] 那娜. 杀螨剂唑螨酯对牙鲆及其鳃细胞系的毒性研究[D]. 青岛:中国海洋大学, 2008.
NA N. Toxic effects of fenpyroximate on FlounderParalichthyolivaceusand the gill cell line of flounder [D]. Qingdao: Ocean University of China, 2008. (in Chinese with English abstract)
[4] 潘永波, 张艳玲. 气相色谱法测定香蕉中的噻嗪酮和吡虫啉[J]. 农药, 2013, 52(12): 903-904.
PAN Y B, ZHANG Y L. Gas chromatography method for determination of buprofezin and imidacloprid in bananas[J].AGROCHEMICALS, 2013, 52(12): 903-904. (in Chinese with English abstract)
[5] 李广领, 姜金庆, 王自良, 等. 气相色谱法检测卷心菜中啶虫脒和吡虫啉残留[J]. 西北农业学报, 2010, 19(9): 71-74.
LI G L, JIANG J Q, WANG Z L, et al. Determination of acetamiprid and imidacloprid residue in cabbage by gas chromatography[J].ActaAgriculturaeBoreali-occidentalisSinica, 2010, 19(9): 71-74. (in Chinese with English abstract)
[6] 师君丽, 宋春满, 孔光辉, 等. 高效液相色谱法同时测定烟草中吡虫啉、啶虫脒、多菌灵和甲基硫菌灵[J]. 分析试验室, 2012, 31(12): 82-85.
SHI J L, SONG C M, KONG G H, et al, Simultaneous determination of imidacloprid, acetamiprid, carbendazim and thiophanate- methyl in tobacco by high performance liquid chromatography[J].ChineseJournalofAnalysisLaboratory, 2012, 31(12): 82-85. (in Chinese)
[7] 王梅, 尹显慧, 杨商海, 等. 高效液相色谱法测定甲维盐和吡虫啉在番茄及其土壤中的残留量[J]. 贵州农业科学, 2014,42(11):123-126.
WANG M, YIN X H, YANG S H, et al. Residue amount of emamectin benzoate and imidacloprid in tomato and soil determined by HPLC[J].GuizhouAgriculturalSciences, 2014, 42(11): 123-126. (in Chinese with English abstract)
[8] 张璇, 姜敏, 何锦惠, 等. 高效液相色谱- 质谱联用仪测定韭菜中多菌灵、吡虫啉等7种农药残留量[J]. 农药科学与管理, 2016, 37(4):41-47.
ZHANG X, JIANG M, HE J H, et al. Determination the residue of seven pesticides in leek by HPLC- MS[J].PesticideScienceandAdministration, 2016, 37(4): 41-47. (in Chinese with English abstract)
[9] 李俊芳, 杜光明, 李德强, 等. 苹果中痕量吡虫啉农药的固相萃取及高效液相色谱- 串联质谱分析[J]. 农药, 2016, 55(3): 194-197.
LI J F, DU G M, LI D Q, et al. Trace determination of imidacloprid residues in apple by solid phase extraction combine with High Performance Liquid Chromatography- tandem Mass Spectrometry[J].Agrochemicals, 2016, 55(3): 194-197. (in Chinese with English abstract)
[10] SEENIVASAN S, MURALEEDHARAN N N. Dissipation behavior of fenpyroximate residues in black tea and brew[J].InternationalJournalofAgriculturalScienceandFoodTechnology, 2015, 1(1): 3-6.
[11] AL- RAHMAN S H A, ALMAZ M M, OSAMA I A. Determination of degradation rate of acaricide fenpyroximate in apple, citrus, and grape by HPLC- DAD[J].FoodAnalyticalMethods, 2012, 5(2): 306-311.
[12] MALHAT F, ELMESALLAMY A, ASSY M, et al. Residues, half- life times, dissipation, and safety evaluation of the acaricide fenpyroximate applied on grapes[J].Toxicological&EnvironmentalChemistry, 2014, 95(8): 1309-1317.
[13] 朱兴江, 丁振华, 胡艳云, 等. 固相萃取高效液相色谱法检测蔬菜水果中的唑螨酯残留[J]. 光谱实验室, 2008, 25(2): 217-220.
ZHU X J, DING Z H, HU Y Y, et al. Determination of the residues of fenpyroximate in vegetables and fruits by high performance liquid chromatography with solid phase extraction[J].ChineseJournalofSpectroscopyLaboratory, 2008, 25(2): 217-220. (in Chinese)
[14] LEE J H, LEE Y J, KANG I H, et al. Analytical methods of fenpyroximate in herbal medicines[J].KoreanJournalofPesticideScience, 2014, 18(3): 141-147.
[15] 曾银欢, 周靓静, 吴慧珍, 等. 分散液液微萃取/液相色谱串联质谱法快速测定蜂蜜中10种杀螨剂[J]. 分析试验室, 2015, 34(2): 216-221.
ZENG Y H, ZHOU J J, WU H Z, et al. Rapid Determination of 10 Kinds of acaricides in honey by Dispersed Liquid Microextraction/Liquid Chromatography Tandem Mass Spectrometry[J].ChineseJournalofAnalysisLaboratory, 2015, 34(2): 216-221. (in Chinese)
[16] 王玉健, 黄惠玲, 徐志伟, 等. 高效液相色谱- 串联质谱法测定茶叶中唑螨酯、三唑酮、鱼藤酮、除虫脲及萎锈灵残留量[J]. 理化检验- 化学分册, 2014, 50(12): 1526-1529.
WANG Y J, HUANG H L, XU Z W, et al. HPLC- MS/MS determination of fenpyroximate, rotenone, triadimefon, diflubenzuron and carboxin in tea[J].PhysicalTestingandChemicalAnalysisPartB:ChemicalAnalysis, 2014, 50(12): 1526-1529. (in Chinese with English abstract)
[17] LEHOTAY S J, MASTOVSKA K, YUN S J. Evaluation of two fast and easy methods for pesticide residue analysis in fatty food matrixes[J].JournalofAoacInternational, 2005, 88(2): 630-638.
[18] ANASTASSIADES M, LEHOTAY S J, STAJNBAHER D, et al. Fast and easy multiresidue method employing acetonitrile extraction/partitioning and "dispersive solid- phase extraction" for the determination of pesticide residues in produce[J].JournalofAoacInternational, 2003, 86(2): 412-431.
[19] 鹿剑, 任水英. QuEChERS方法在食品中多组分农残检测中的研究进展J]. 中国酿造, 2016, 35(9): 28-32.
LU J, REN S Y. Research progress of QuEChERS method in multi- pesticides residue analysis in food[J].ChinaBrewing, 2016, 35 (9): 28-32. (in Chinese with English abstract)
[20] European Committee for Standardization- CEN. Foods of plant origin- Determination of pesticide residues using GC- MS and/or LC- MS/MS following acetonitrile extraction/partitioning and clean- up by dispersive SPE- QuEChERS- method: CEN/TC 275 15662: 2008 [S]. European Union, 2008.

