马齿苋- 益生菌联用对热毒证小鼠腹泻的预防效果
刘翠艳,陈四玉,孙桃桃,尚莉莉,杨明川,杨孜生,韩春杨
(安徽农业大学 动物科技学院,安徽 合肥 230036)
腹泻(diarrhea)是指排便次数明显增多、粪便含水量增加、便中含有粘液或便中带血的一种病症。畜禽腹泻特别是幼畜腹泻在我国许多地区普遍流行,除影响动物健康外,还会阻碍动物生长,严重者可造成死亡,对养殖业危害极大[1]。
在腹泻病的防治方面,养殖场多采用见效快的抗菌药物进行防治。但随着抗生素的大量使用,出现了诸如毒性反应、细菌耐药性等一系列问题,尤其是细菌耐药性的传播与蔓延,导致许多抗生素不能正常发挥作用。中兽医药历史悠久,许多中药具有抗菌、抗病毒、安全、环保、价廉、来源广泛等特点,且不易产生耐药性,被认为是替代抗生素的优势药物。药理学研究表明,有些中药可通过抑制病原菌生长[2-3]、改善机体肠道生理状况[4-5]、增强机体免疫力[6-7]等作用来防治腹泻。益生菌是一类对宿主有益的活性微生物,可改善机体肠道微环境,维持肠道菌群平衡,抵抗病原菌侵染,防治胃肠道疾病[8-11]。研究表明,中药与益生菌联用时对肠道疾病的治疗效果优于单独使用中药或益生菌[12-13]。为此,本研究尝试将具有清热解毒作用的中药马齿苋与益生菌联合用于预防产肠毒素大肠埃希菌(ETEC)配合干姜水提液诱发的小鼠腹泻,收到了较好的效果。
1 材料与方法
1.1 材料
1.1.1 菌种
大肠埃希菌(编号CVCC 231),购自中国兽医微生物菌种保藏管理中心;枯草芽孢杆菌、乳酸菌、酵母菌,由中国微生物菌种保藏管理委员会农业微生物中心提供。
1.1.2 药材
马齿苋,购自北京同仁堂四通桥店;干姜,购自合肥乐家老铺中药饮片有限公司。
1.1.3 实验动物
144只昆明种健康小鼠,雄性,体质量(20±2) g,购自安徽医科大学实验动物中心,生产许可证号:SCXK(皖)2011- 2012,饲养于清洁级动物房,环境温度23±2 ℃,相对湿度40%~60%。
1.2 方法
1.2.1 混合益生菌菌液的制备
将前期筛选出的3株益生菌(枯草芽孢杆菌、乳酸菌、酵母菌各1株)分别活化培养24 h后,采用显微计数方法进行菌落计数,然后用无菌生理盐水稀释至相同浓度(1.0×108cfu·mL-1),以1∶1∶1的比例混合均匀。
1.2.2 干姜水提液的制备
取干姜饮片,微波干燥后,冷水浸泡2 h,煮沸,保持微沸40 min,过滤,药渣再加水反复提取2次,过滤。合并3次滤液,旋转蒸发仪浓缩至0.5 g·mL-1,4 ℃保存备用。
1.2.3 含药饲料的制备
取中药马齿苋,微波干燥,超微粉碎。试验前分别按1.0、2.5、5.0 g·kg-1的比例混入饲料中,制成与正常小鼠饲料形态相同的颗粒饲料。
1.2.4 动物分组及处理
144只小鼠适应性饲养3 d后,随机分为9组,每组16只(表1)。整个试验期内,空白组和模型组小鼠饲喂普通饲料,其他各组小鼠或喂饲含药饲料或/和灌胃混合益生菌菌液[菌液浓度为1.0×108cfu·mL-1,灌胃剂量0.02 mL·g-1BW(体质量),每天1次],10 d后构建小鼠腹泻造模。具体造模方法如下:以0.028 mL·g-1BW的剂量灌胃干姜水提液(0.5 g·mL-1),每天1次;10 d后以0.02 mL·g-1BW剂量腹腔注射7.5×107cfu·mL-1的ETEC菌液,连续3 d。空白组不做任何处理。造模期间,各组小鼠处理同前。试验结束后,小鼠眼球采血,分离血清;收集十二指肠、回肠、结肠组织,其中一部分固定于4%多聚甲醛溶液中,剩余部分置于-80 ℃冰箱保存备用。
1.2.5 检测指标
(1)统计小鼠腹泻率
腹泻的判断标准:①临床症状。小鼠精神萎靡,被毛逆立,少动,拉黄色软便或稀便,肛门及尾部粘有黄色稀便。②剖检病变。小鼠肠壁变薄,肠管内有黄色稀薄内容物。③组织病理变化肠组织结构破坏,肠绒毛脱落,炎性细胞浸润等。
腹泻率计算:小鼠的腹泻只数与总只数的百分比值。
(2)检测肠道组织炎症因子的变化
取-80 ℃保存的小鼠肠道组织,按照RNAiso Plus(TaKaRa)法提取总RNA,反转录后以β- actin为参考基因,按照荧光染料说明书的方法对组织中的相关因子进行real- time PCR检测,利用2-ΔΔCt法计算目的基因的相对表达量。每组数据做3个平行重复孔,并进行3次重复试验。引物由上海生工股份有限公司合成,7对引物碱基序列如表2。
(3)制作肠道组织病理切片
将固定在4%多聚甲醛溶液中的肠道组织块修剪成5 mm3大小,流水缓慢冲洗12 h后,用梯度酒精脱水(70%,80%各20 min;95%,3 h;100%,40 min),二甲苯透明(20 min),浸蜡(60 ℃,90 min),包埋;待石蜡凝固后,4 μm切片,捞片、固定;二甲苯脱蜡后,梯度酒精水化,HE染色,脱水后封片。光学显微镜下观察,拍照。
(4)检测血液中Cl-、Ca2+水平
按照生化试剂盒操作说明,应用全自动生化仪测定小鼠血清中电解质(Cl-、Ca2+)含量。
1.2.6 统计学分析
本文中所有试验各重复3次,所得数据均采用SPSS 19.0软件进行单因素方差分析,采用Duncan进行多重比较,以平均数±标准误(Mean±SEM)表示,P<0.05表示差异显著。
表1试验分组及给药
Table1Animal grouping and treatment
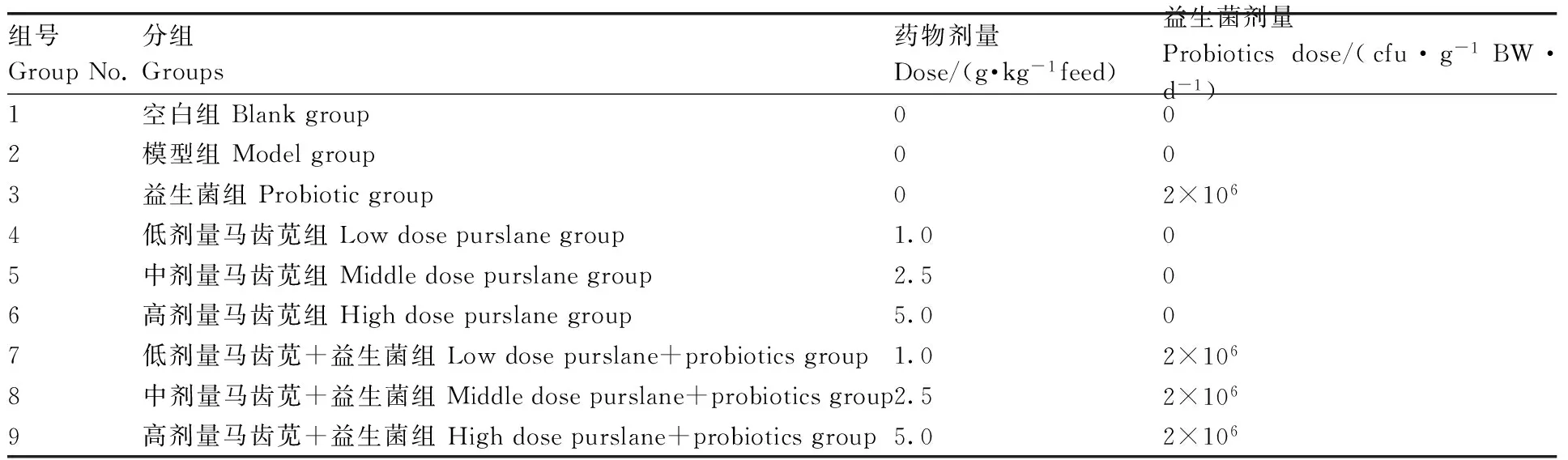
组号GroupNo.分组Groups药物剂量Dose/(g·kg-1feed)益生菌剂量Probioticsdose/(cfu·g-1BW·d-1)1空白组Blankgroup002模型组Modelgroup003益生菌组Probioticgroup02×1064低剂量马齿苋组Lowdosepurslanegroup1.005中剂量马齿苋组Middledosepurslanegroup2.506高剂量马齿苋组Highdosepurslanegroup5.007低剂量马齿苋+益生菌组Lowdosepurslane+probioticsgroup1.02×1068中剂量马齿苋+益生菌组Middledosepurslane+probioticsgroup2.52×1069高剂量马齿苋+益生菌组Highdosepurslane+probioticsgroup5.02×106
表2Real- time PCR引物序列
Table2Sequences of primers used for real- time PCR

基因Gene上游引物序列Upstreamprimersequence(5'-3')下游引物序列Downstreamprimersequence(5'-3')产物大小Productsize/bpTNF-αCCACGTCGTAGCAAACCACCGTGAGGAGCACGTAGTCGG186IL-1βTGCCACCTTTTGACAGTGATGATGTGCTGCTGCGAGATTTG136IL-6CCCTTGCTGGTGGATGTTCCCGTTGGTGGTGTTGAT156IL-10TGGGTTGCCAAGCCTTATCGTTCAGCTTCTCACCCAGGGA118IFN-γCGGCACAGTCATTGAAAGCCTGCATCCTTTTTCGCCTTGC268TGF-β1AGCTGCGCTTGCAGAGATTAAGCCCTGTATTCCGTCTCCT189β-actinAATCGTGCGTGACATCAAAGAAGGAAGGCTGGAAAA179
2 结果
2.1 马齿苋与益生菌联用对小鼠腹泻率的影响
各组小鼠的腹泻率见表3。根据表3可知,攻菌后24 h,模型组小鼠的腹泻率高达87.5%,明显高于其他用药组;除低剂量马齿苋+益生菌组的腹泻率与益生菌组相同外,其他马齿苋用药组的腹泻率均低于益生菌组,其中高剂量马齿苋+益生菌组的腹泻率最低(12.5%)。表明马齿苋和益生菌联合作用能够有效预防ETEC配合干姜水提液诱发的小鼠腹泻。
2.2 肠道炎症因子的相对表达量
由图1可知,与空白组相比,模型组TNF-α、IL- 6、IL- 10、IL- 1β、TGF-β1、IFN-γ表达均显著升高(P<0.05),说明ETEC感染造成小鼠肠道损伤,导致肠道组织中各炎症相关因子表达增加。与模型组相比,低剂量马齿苋组、中剂量马齿苋组肠道组织中的IL- 1β、IL- 6、IFN-γ的表达显著降低(P<0.05);高剂量马齿苋组肠道组织中TNF-α、IL- 1β、IL- 6、TGF-β1、IFN-γ的表达显著降低(P<0.05);低剂量马齿苋+益生菌组肠道组织中TNF-α、IL- 6、IL- 10、IL- 1β、TGF-β1、IFN-γ的表达均显著降低(P<0.05);中剂量马齿苋+益生菌组肠道组织中IL- 1β、IL- 10、IL- 6、IFN-γ的表达显著降低(P<0.05);高剂量马齿苋+益生菌组肠道组织中TNF-α、IL- 1β、IL- 10、IL- 6、TGF-β1、IFN-γ均显著降低(P<0.05);益生菌组肠道组织中IL- 1β、IL- 10、IL- 6、TGF-β1、IFN-γ的表达均显著降低(P<0.05)。结果表明,各用药组均能缓解ETEC感染对肠道组织造成的炎症反应,其中高剂量马齿苋+益生菌更能有效的预防ETEC感染。
2.3 肠道组织病理学变化
光学显微镜观察各组小鼠十二指肠、回肠和结肠的组织切片,结果见图2—4。由图2和图3可知,空白组小鼠十二指肠、回肠绒毛排列整齐,组织结构完整,而模型组小鼠十二指肠、回肠绒毛毛部分断裂、变粗、变短,上皮细胞脱落,肠腺变形明显,表明造模后小鼠小肠结构出现病变;各用药组小鼠十二指肠和回肠组织结构有所恢复,其中高剂量马齿苋+益生菌组小鼠肠绒毛基本完整。由图4可知,各组小鼠结肠组织结构完整,无病变,表明ETEC配合干姜水提液感染主要造成小鼠小肠组织结构损伤。
表3马齿苋与3株益生菌联用对小鼠腹泻率的影响
Table3The effect of purslane combined with three probiotics on diarrhea rate in mice

组别Groups腹泻率Diarrhearate/%攻菌第1天Thefirstdayafterattackbacteria攻菌第2天Theseconddayafterattackbacteria攻菌第3天Thethirddayaf-terattackbacteria空白组Blankgroup0.00.00.0模型组Modelgroup87.550.050.0益生菌组Probioticsgroup37.50.00.0低剂量马齿苋组Lowdosepurslanegroup25.00.00.0中剂量马齿苋组Middledosepurslanegroup25.00.00.0高剂量马齿苋组Highdosepurslanegroup25.00.00.0低剂量马齿苋+益生菌组Lowdosepurslane+probioticsgroup37.525.012.5中剂量马齿苋+益生菌组Middledosepurslane+probioticsgroup25.00.00.0高剂量马齿苋+益生菌组Highdosepurslane+probioticsgroup12.512.50.0
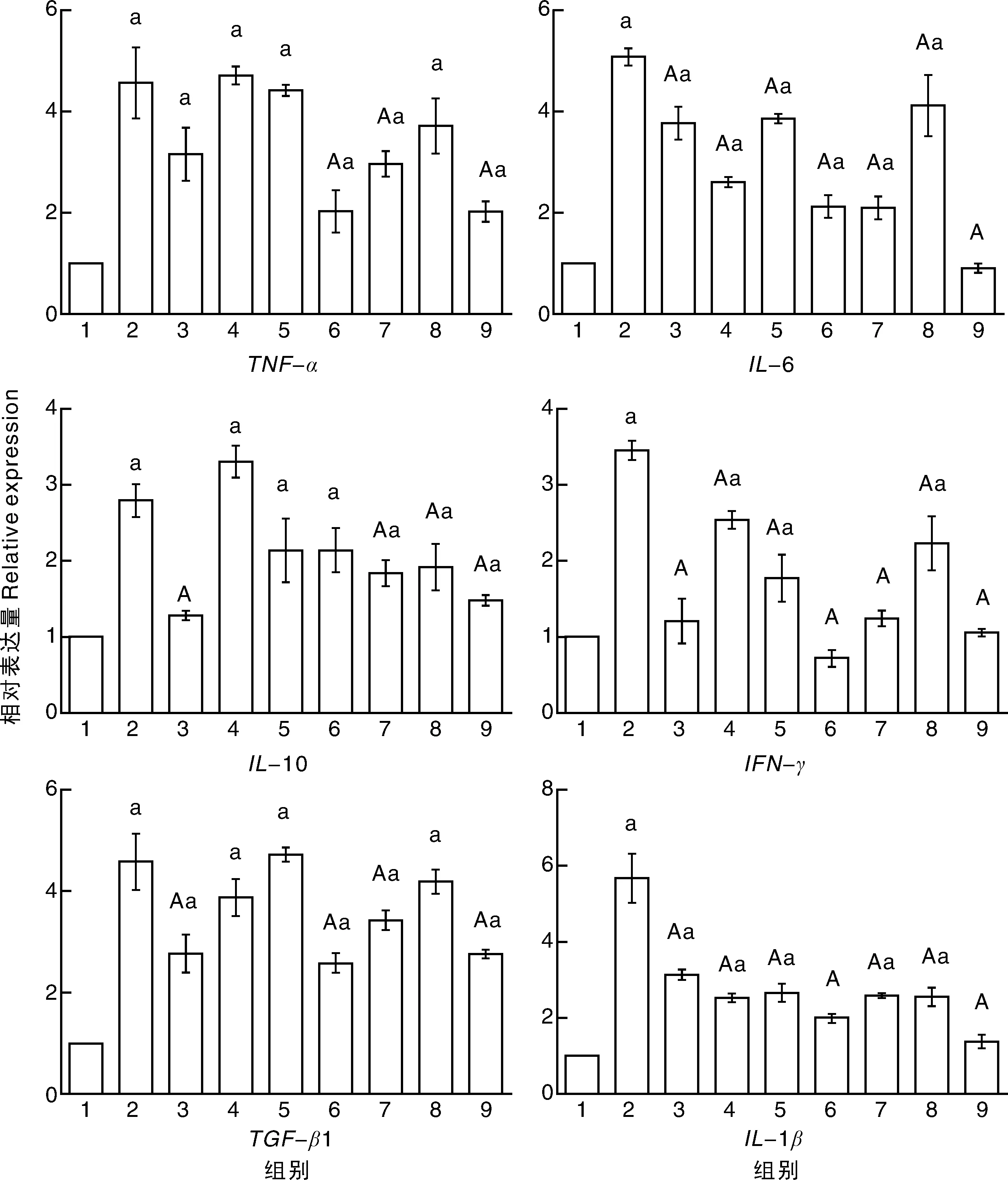
与空白组相比,a表示P<0.05;与模型组相比,A表示P<0.05;图中横轴数字1、2、3分别代表空白组、模型组、益生菌组;4、5、6分别代表低、中、高剂量马齿苋组;7、8、9分别代表低、中、高剂量马齿苋+益生菌组Compared with the blank group, a showed P<0.05; Compared with model group, A showed P<0.05.The numbers 1-3 below horizontal axis represent blank group, model group and probiotics group, respectively, 4-6 represent the low, middle and high dose purslane group, respectively, and 7-9 represent the low, medium and high dose purslane + probiotics group, respectively图1 各目的基因mRNA表达情况Fig.1 Relative expression levels of target genes’ mRNA
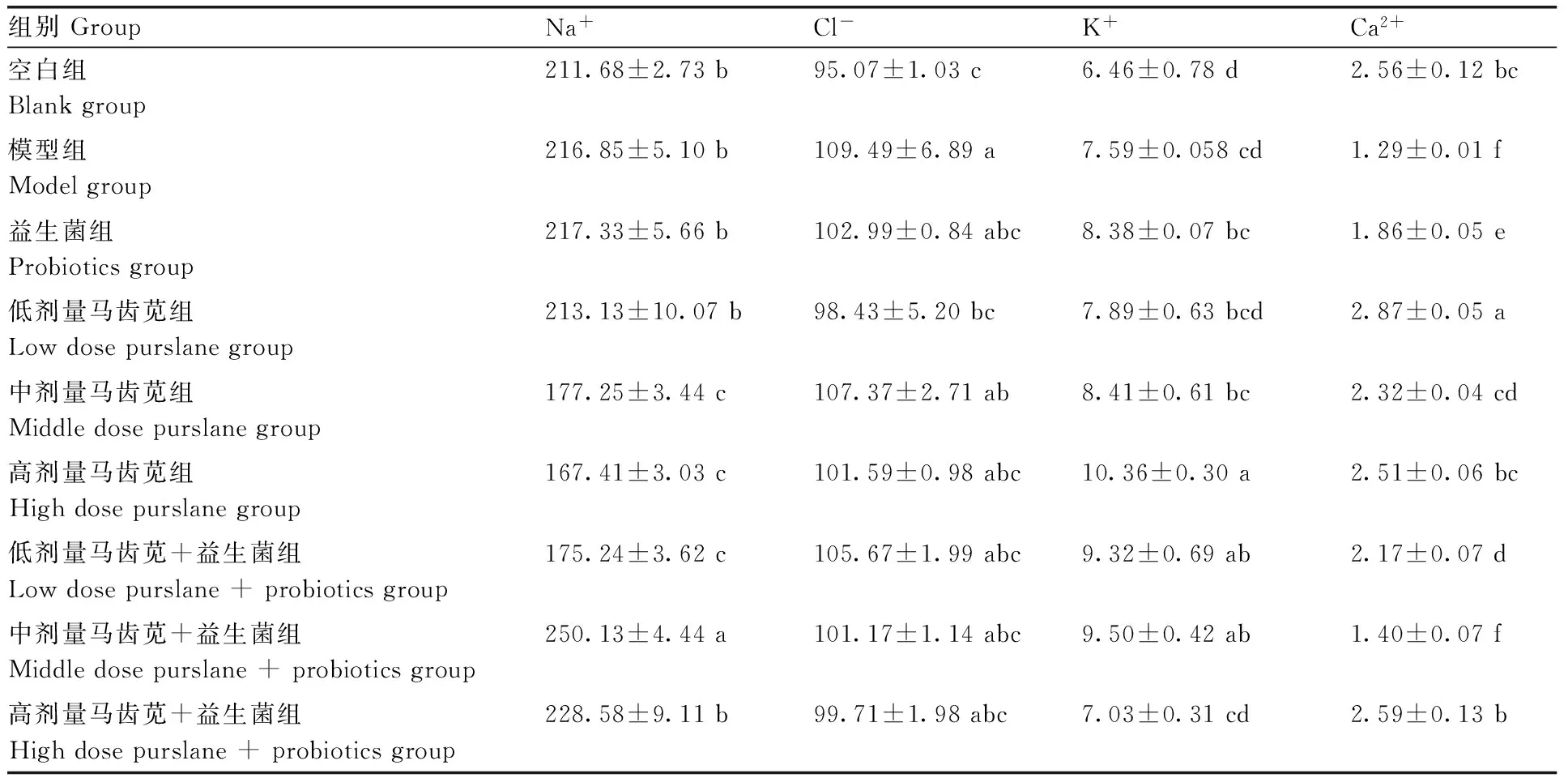
2.4 马齿苋与3种益生菌联用对小鼠电解质指标的影响
电解质指标检测结果见表4。由表4可知,与空白组相比,模型组小鼠血清中的Cl-含量显著升高(P<0.05),Ca2+含量显著降低(P<0.05),表明造模后小鼠部分电解质紊乱。与模型组相比,不同剂量的马齿苋组以及与益生菌联用组小鼠的电解质指标含量有所恢复,其中高剂量马齿苋+益生菌组的效果优于其他用药组,能够很好的恢复腹泻造成的电解质紊乱。
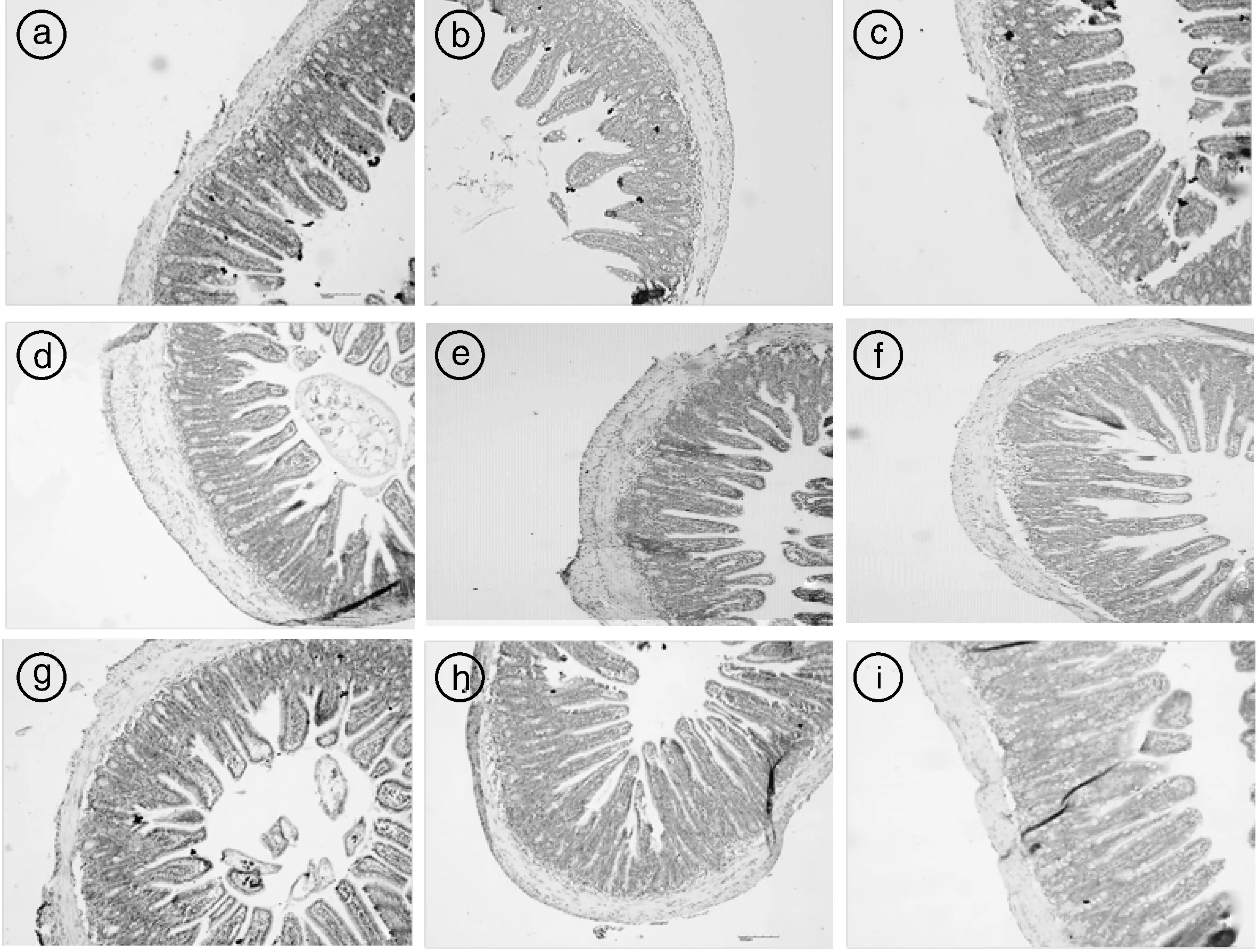
图中字母a- c分别代表空白组、模型组、益生菌组;d- f分别代表低、中、高剂量马齿苋组;g- i分别代表低、中、高剂量马齿苋+益生菌组。下同。The letters a- c represent blank group, model group and probiotics group, respectively, d- f represent the low, middle and high dose purslane group, respectively, and g- i represent the low, medium and high dose purslane + probiotics group, respectively. The same as below.图2 小鼠十二指肠HE染色病理观察(100×)Fig.2 Pathological observation of duodenal by HE staining in mice (100×)
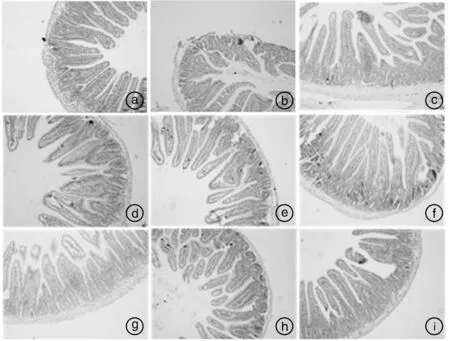
图3 小鼠回肠HE染色病理观察(100×)Fig.3 Pathological observation of ileum by HE staining in mice (100×)
3 讨论
本研究初步探讨了中药马齿苋与益生菌联用对小鼠腹泻的预防作用,试验采用产肠毒素大肠杆菌(ETEC)配合干姜水提液构建小鼠腹泻模型,通过提前给小鼠饲喂马齿苋、益生菌以及马齿苋与益生菌的混合物,观察小鼠的精神、腹泻发生情况等。造模结果表明,攻菌后小鼠被毛逆立、精神萎靡,粪便呈黄色软便或稀便,肛门周围有稀便、粘液粘附;病理解剖发现,模型组小鼠腹腔内有大量液体,肠内含有黄色炎性分泌物,结肠内粪便多为不成形的软便或稀便。这与邓燕莉[1]、曹玲芝[14]等采用ETEC复制的小鼠腹泻模型症状一致。中药及益生菌预防试验结果发现,攻菌后马齿苋组小鼠的腹泻率明显低于模型组,马齿苋与益生菌联用组的腹泻率更低。说明马齿苋与益生菌联用可有效预防ETEC配合干姜水提液引起的小鼠腹泻的发生。
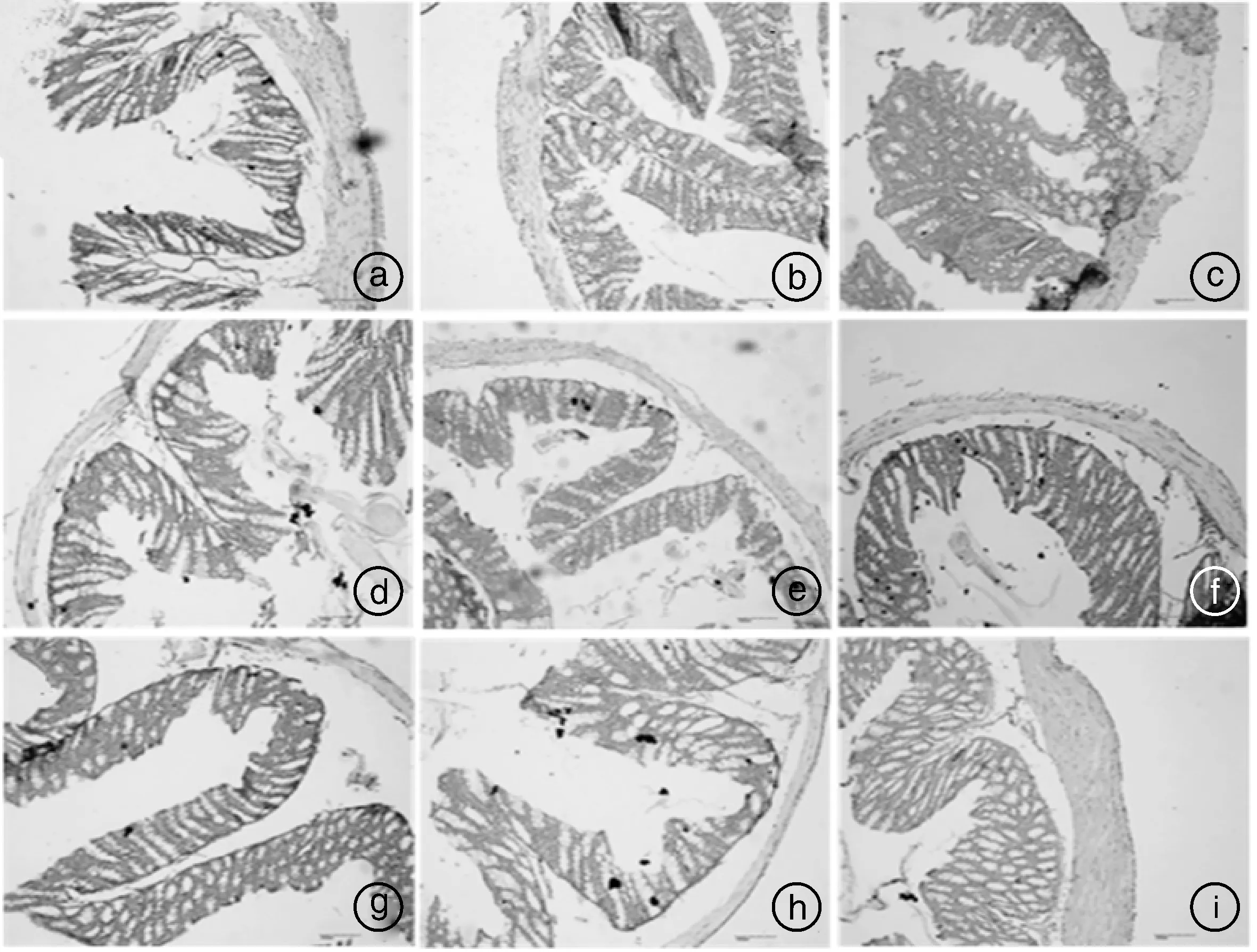
图4 小鼠结肠HE染色病理观察(100×)Fig.4 Pathological observation of colon by HE staining in mice (100×)
表4马齿苋与3株益生菌联用对小鼠电解质指标的影响
Table4Effect of purslane combined with three probiotics on biochemical indexes in mice
mmol·L-1
同列数据无相同小写字母表示差异显著(P<0.05)。
Data marked without the same lowercase letter in the same column indicated significant differences atP<0.05.
从炎症因子的角度,有研究表明,ETEC可起肠道组织的一系列变化,激发小肠上皮细胞发生炎症反应,刺激机体释放大量的炎症介质,导致炎症因子表达升高、抗炎因子分泌降低[15-16],其中TNF- α、IL- 1β、IL- 6、IFN- γ是常见的炎症因子,IL- 10是常见的抗炎因子,TGF- β1是一种潜在的细胞抗炎因子。TNF- α是一种多效性的细胞因子,在炎症反应的发生中具有至关重要的作用,能够触发中性粒细胞和单核细胞的趋化以及增加内皮细胞粘附分子的表达,并激活间质细胞和内皮细胞进一步分泌炎症因子,如IL- 1β、IL- 6等,放大炎症连锁反应,造成肠粘膜损伤[17-18];TGF- β是一种多功能生长因子,是生长因子超家族中具有免疫调控功能的一大类细胞因子家族,广泛分布在肠道中,由上皮细胞、成纤维细胞、免疫T细胞等合成和分泌,其中以TGF- β1比例最高、活性最强。Alberto等[19]的研究发现,ETEC感染肠上皮细胞后,导致TNF-α、IL- 1β等的表达升高。本研究结果表明,给小鼠腹腔注射ETEC后,模型组小鼠肠道组织中IL- 1β、IL- 6、TNF-α、IFN-γ、IL- 10、TGF-β1的表达量较空白组显著升高(P<0.05),与赵宁[20]、毛磊[21]的研究结果一致;各用药组小鼠肠道组织中IL- 1β、IL- 6、IFN-γ的表达量较模型组显著降低(P<0.05),其中高剂量马齿苋+益生菌组小鼠肠道组织中IL- 1β、IL- 6、IL- 10、TNF-α、IFN-γ、TGF-β1的表达显著降低(P<0.05),说明各组药物对ETEC配合干姜水提液引起的肠道炎症反应均有一定的预防作用,特别是高剂量马齿苋与+益生菌联用效果最好。
腹泻通常可以导致机体电解质失衡。本研究造模使用的病原菌ETEC能够分泌肠毒素,肠毒素可定植在肠道细胞上,致使环磷酸腺苷含量升高,引起囊性纤维化跨膜调控子(CFTR)的磷酸化,激活CETR的氯离子通道,导致肠道细胞电解质分泌异常,大量液体滞留在腹腔内不被吸收代谢。本试验结果表明,模型组小鼠血液Cl-含量较空白组显著升高,与Gareau等[22]的研究结果一致。
可见,较高剂量的马齿苋(5.0 g·kg-1feed)与益生菌(2×106cfu·g-1BW·d-1)联合应用可以显著减轻ETEC配合干姜水提液引起的小鼠肠道损伤,有效预防腹泻的发生。其作用机制与下调IL- 1β、IL- 6、TNF- α、IFN- γ等促炎因子的表达,调节机体电解质平衡等有关。
[1] 邓燕莉. 厚朴酚与和厚朴酚抗腹泻作用及分子机理研究 [D]. 长沙:湖南农业大学,2012.
DENG Y L. Studies on the anti- bacterial diarrhea and molecule mechanism of magnolol and honokiol [D]. Changsha: Hunan Agricultural University, 2012. (in Chinese with English abstract)
[2] 陈国妮,孙飞龙,闫亚茹,等. 马齿苋黄酮类化合物抑菌机理的研究[J]. 化学与生物工程,2015,32(10):34-37.
CHEN G N, SUN F L, YAN Y R, et al. Study on antimicrobial mechanism of purslane flavonoids[J].Chemistry&Bioengineering, 2015, 32(10):34-37. (in Chinese)
[3] 向双云,周珍辉,李玉冰,等. 8种中草药对大肠杆菌的体外抑菌试验[J]. 黑龙江畜牧兽医,2016,502(10):167-169.
XIANG S Y, ZHOU Z H, LI Y B, et al. Bacteriostatic test of 8 kinds Chinese herbal medicine onE.coliinvitro[J].HeilongjiangAnimalScienceandVeterinaryMedicine, 2016, 502(10):167-169. (in Chinese)
[4] 冯澜,李绍民,代立娟,等. 马齿苋多糖对溃疡性结肠炎小鼠肠黏膜细胞因子及肠道菌群的影响[J]. 中国微生态学杂志,2015,27(2):139-142.
FENG L, LI S M, DAI L J, et al. Effects of polysaccharides fromPortulacaoleraceaL. on intestinal mucosal cytokines and intestinal flora in mice with ulcerative colitis[J].ChineseJournalofMicroecology, 2015, 27(2):139-142. (in Chinese with English abstract)
[5] 胡新俊,李春香,王广,等. 马齿苋多糖对肠道微生态失调小鼠的调整作用研究[J]. 中国微生态学杂志,2010,22(9):781-783.
HU X J, LI C X, WANG G, et al. Effects ofPortulacapolysaccharide on the dysbacteria in intestinal tract of mice[J].ChineseJournalofMicroecology, 2010, 22(9):781-783. (in Chinese with English abstract)
[6] 葛剑,杨翠军,孙茂红,等. 马齿苋多糖对雏鸡免疫器官指数及抗氧化功能的影响[J]. 中国饲料,2012,461(9):15-18.
GE J, YANG C J, SUN M H, et al. Effects of polysaccharide fromPortulacaoleraceaon immune organ index and antioxidant function in chicks[J].Chinafeed, 2012, 461(9):15-18. (in Chinese)
[7] 赵蕊,高旭,邵兴月. 马齿苋多糖对荷宫颈癌小鼠免疫刺激活性的研究[J]. 中国免疫学杂志,2014,30(10):1344-1348, 1368.
ZHAO R, GAO X, SHAO X Y. Immune stimulation research ofPortulacaoleraceaL. polysaccharides on cervical tumor- bearing mice[J].ChineseJournalofImmunology, 2014, 30(10):1344-1348, 1368. (in Chinese with English abstract)
[8] 张媛媛,黄广明,劳晔. 益生菌枯草芽孢杆菌PB6菌株对动物肠道病原菌的抑菌谱研究[J]. 饲料研究,2014,398(13):46-48.
ZHANG Y Y, HUANG G M, LAO Y. Study on the bacteriostatic spectrum ofBacillussubtilisPB6 Strain to animal enteric pathogenic bacteria[J].FeedResearch, 2014, 398(13):46-48. (in Chinese)
[9] XIE Z L, BAI D P, XIE L N, et al. Intestinal lactic acid bacteria from Muscovy duck as potential probiotics that alter adhesion factor gene expression[J].GeneticsandMolecularResearch, 2015, 14(4):12262-12275.
[10] QIU J W, HE X L, ZHANG B, et al. Effect on Muc2 gene knockdown in Ht29 cells by CRISPR/Cas9 on probiotics- mediated inhibition ofE.coliK1 adhesion and invasion[J].JournalofSouthernMedicalUniversity, 2016, 36(6):819-823.
[11] SALMINEN S, ISOLAURI E, SALMINEN E. Clinical uses of probiotics for stabilizing the gut mucosal barrier: successful strains and future challenges[J].AntonieVanLeeuwenhoekInternationalJournalofGeneralandMolecularMicrobiology, 1996, 70(2):347-358.
[12] 郭抗萧,谭周进,谢梦洲,等. 超微七味白术散与酵母菌协同治疗小鼠菌群失调腹泻[J]. 应用与环境生物学报,2015,113(1):61-67.
GUO K X, TAN Z J, XIE M Z, et al. The synergic effect of ultra- micro powder Qiweibaizhusan combined with yeast on dysbacteriotic diarrhea mice[J].ChineseJournalofAppliedandEnvironmentalBiology, 2015, 113(1):61-67. (in Chinese with English abstract)
[13] 王大海. 中草药与微生态制剂对仔猪肠炎和增重的试验研究 [D]. 福州:福建农林大学, 2011.
WANG D H. The reasearch of Chinese medical herbs and probiotic on controlling diarrhea and weight gain in piglet [D]. Fuzhou: Fujian Agriculture and Forestry University, 2011. (in Chinese with English abstract)
[14] 曹玲芝. 四君子汤对小鼠大肠杆菌性腹泻防治机制的研究 [D]. 保定:河北农业大学,2009.
CAO L Z. The study on prevention mechanism of Si jun zi tang onE.coli- induced diarrhea of mice [D]. Baoding: Agricultural University of Hebei Province, 2009. (in Chinese with English abstract)
[15] TANG Z, XU L, SHI B, et al. Oral administration of synthetic porcine beta- defensin- 2 improves growth performance and cecal microbial flora and down- regulates the expression of intestinal toll- like receptor- 4 and inflammatory cytokines in weaned piglets challenged with enterotoxigenicEscherichiacoli[J].AnimalScienceJournal, 2016, 87(10):1258-1266.
[16] TARANU I, MARIN D E, PISTOL G C, et al. Induction of pro- inflammatory gene expression byEscherichiacoliand mycotoxin zearalenone contamination and protection by aLactobacillusmixture in porcine IPEC- 1 cells[J].Toxicon, 2015, 97:53-63.
[17] CHEN C, LU M, PAN Q, et al. Berberine improves intestinal motility and visceral pain in the mouse models mimicking diarrhea- predominant irritable bowel sndrome (IBS- D) symptoms in an opioid- receptor dependent manner[J].PLoSOne, 2015, 10(12):e0145556.
[18] LEE S, GIM H, SHIIM J H, et al. The traditional herbal medicine, Ge- Gen- Tang, inhibits pacemaker potentials by nitric oxide/cGMP dependent ATP- sensitive K(+) channels in cultured interstitial cells of Cajal from mouse small intestine[J].JournalofEthnopharmacol, 2015, 170:201-209.
[19] FINAMORE A, ROSELLI M, IMBINTO A, et al.Lactobacillusamylovorusinhibits the TLR4 inflammatory signaling triggered by enterotoxigenicEscherichiacolivia modulation of the negative regulators and involvement of TLR2 in intestinal Caco- 2 cells and pig explants[J].PLoSOne, 2014, 9(4):e94891.
[20] 赵宁. 产肠毒素性大肠杆菌感染小鼠致腹泻LncRNA表达谱的构建 [D]. 银川:宁夏大学,2016.
ZHAO N. LncRNA expression signatures in response to EnterotoxigenicEscherichiacoliinfection in mice [D]. Yinchuan: Ningxia University, 2016. (in Chinese with English abstract)
[21] 毛磊. 不同锌源对产肠毒性大肠杆菌的生长及对小肠上皮细胞免疫调节功能的影响 [D]. 雅安:四川农业大学, 2014.
MAO L. Effects of different sources and levels of zinc on growth of ETEC and immunity of small intestine [D]. Ya’an: Sichuan Agricultural University, 2014. (in Chinese with English abstract)
[22] GAREAU M G, BARRETT K E. Fluid and electrolyte secretion in the inflamed gut: novel targets for treatment of inflammation- induced diarrhea[J].CurrentOpinioninPharmacology, 2013, 13(6):895-899.

