胃腺癌组织长链非编码RNA TUG1表达变化及其与p53蛋白的关系
陈庆勇,王娜娜,曹璋,何双,吴淑华,张骞,李红
(滨州医学院附属医院,山东滨州256603)
胃癌是我国常见的恶性肿瘤之一,因其早期症状隐匿,约80%患者发现时已属于进展期。近年来,在胃癌手术治疗、化疗以及放疗方面均取得了较大进展,但胃癌术后5年生存率仍不理想。目前,胃癌已成为危害我国人民群众身体健康的重大公共卫生问题之一[1]。长链非编码RNA(lncRNA)是指转录本超过200个核苷酸的非编码RNA,其本身不编码蛋白。牛磺酸上调基因1(TUG1)是lncRNA的一种,近年研究发现,其在多种恶性肿瘤中异常表达,可能与肿瘤的发生、发展密切相关[2,3]。p53是一种常见的抑癌基因,在调控肿瘤细胞周期过程中具有重要作用。本研究观察了TUG1在胃腺癌组织中的表达变化,并分析其与临床病理特征的关系,进一步分析TUG1表达与p53表达的相关性,从而为胃腺癌的预后评估及治疗寻找新的靶标。
1 材料与方法
1.1 标本来源 收集滨州医学院附属医院2016年1~7月手术切除的胃腺癌组织及其癌旁正常组织(距肿瘤边缘>2 cm)108例份,液氮中保存。标本来源患者男64例、女44例,年龄38~79岁、中位年龄61岁;肿瘤直径2.5~11.0 cm,平均7 cm;临床分期:Ⅰ期12例,Ⅱ期25例,Ⅲ期58例,Ⅳ期13例。所有患者为首诊胃癌,并经组织病理学检查证实为腺癌,且术前未行任何抗肿瘤治疗。本研究经滨州医学院附属医院医学伦理委员会批准,患者或其家属知情同意。
1.2 主要试剂 TRIzol、cDNA合成试剂盒及定量聚合酶链反应(PCR)试剂均购自美国Invitrogen公司。TUG1上游引物:5′-TCAAGACCTGGACCTGGAAC-3′;下游引物:3′-AGTTTGCACTGAGGGTCTGG-5′。甘油醛-3-磷酸脱氢酶(GAPDH)上游引物:5′-CTCGCTTCGGCAGCACA-3′,下游引物:5′-AACGCTTCACGAATTTGCGT-3′。所有引物序列由上海吉玛制药技术有限公司合成。p53单克隆抗体购自福建迈新生物技术有限公司;SP试剂盒及DAB显色试剂均购自北京中山生物技术有限公司。
1.3 胃腺癌组织TUG1检测
1.3.1 RNA提取 从液氮中取出组织,剪取约100 mg,加入TRIzol 1 mL,用匀浆器匀浆。将匀浆后样品置于25 ℃水浴锅中孵育5 min,以便核酸蛋白复合体完全解离,其余步骤参照试剂盒说明书进行。
1.3.2 RNA浓度和纯度测定 取RNA样品2 μL,用1×TE缓冲液稀释10倍,测定样品在260、280 nm波长处的吸光度(A)值。RNA浓度=A260×稀释倍数×40 ng/μL。A260/A280为1.8~2.1,表明提取的RNA质量合格,符合后续实验要求。
1.3.3 cDNA合成 取RNA 0.8 μg、0.5 μg/μL Oligo(dT)18 1 μL、2.5 mmol/L dNTPs Mix 1.6 μL,加无RNA酶的H2O至总体积14.5 μL。将混合液置于65 ℃水浴5 min,冰上放置2 min。短暂离心后,在离心管中依次加入RT反应液5×First-Strand Buffer 4 μL、0.1 mol/L DTT 1 μL、RNase ihibitor 0.3 μL、SuperScript Ⅲ RT 0.2 μL,37 ℃恒温静置1 min;混匀,依次50 ℃温育60 min、70 ℃温育15 min,获得cDNA待用或置于-20 ℃保存。
1.3.4 实时荧光定量PCR 将所有cDNA样品分别配置real-time PCR反应体系。PCR反应体系:2×Master Mix 5 μL,10 μmol/L PCR特异性上下游引物各0.5 μL,加H2O至总体积8 μL。轻弹管底,使溶液充分混合,5 000 r/min短暂离心,转入PCR反应管内;再加入cDNA 2 μL,然后进行real-time PCR扩增。PCR反应条件:95 ℃ 10 min,95 ℃ 10 s、60 ℃ 60 s共40个循环;扩增反应结束,95 ℃ 10 s、60 ℃ 60 s、95 ℃ 15 s,并从60 ℃缓慢加热至99 ℃。采用2-ΔΔCT法计算目的基因相对表达量,其中高于均值为高表达、低于均值为低表达。
1.4 胃腺癌组织p53表达检测 采用免疫组化法。标本全部经4%中性甲醛溶液固定,石蜡包埋,常规制片,按免疫组化SP法染色。所有操作步骤按试剂盒说明书进行。p53阳性着色定位于细胞核,呈黄色或棕褐色颗粒。每张切片随机选取10个高倍(400×)视野,每视野计数100个细胞,根据细胞染色强度和阳性细胞比例综合判断结果。细胞染色强度评分:无染色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。阳性细胞比例评分:≤5%为0分,>5%~25%为1分,>25%~50%为2分,>50%~75%为3分,>75%为4分。两项得分乘积≥4为阳性表达。
2 结果
2.1 胃腺癌组织及癌旁正常组织TUG1表达比较 胃腺癌组织TUG1相对表达量为2.36±1.01、高表达90例(83.3%),高于癌旁正常组织的0.93±0.54、18例(16.7%),二者比较P均<0.01。
2.2 胃腺癌组织TUG1表达与患者临床病理特征的关系 TUG1相对表达量在胃腺癌低分化者高于高分化者,浸润深度T3、T4者高于T1、T2者,有区域淋巴结转移者高于无区域淋巴结转移者,有远处转移者高于无远处转移者,临床分期高者高于临床分期低者(P均<0.05),但不同年龄、性别、肿瘤直径及有无脉管侵犯、神经侵犯患者TUG1相对表达量比较差异均无统计学意义(P均>0.05)。见表1。
表1 胃腺癌组织TUG1表达与患者临床病理特征的关系
2.3 胃腺癌组织及癌旁正常组织p53表达比较 胃腺癌组织p53阳性表达率为61%(66/108),癌旁正常组织为39%(42/108),二者比较P<0.01。
2.4 胃腺癌组织TUG1表达与p53表达的关系 Pearson相关分析显示,TUG1高表达与p53阳性表达呈正相关关系(r=0.204,P<0.05)。见表2。
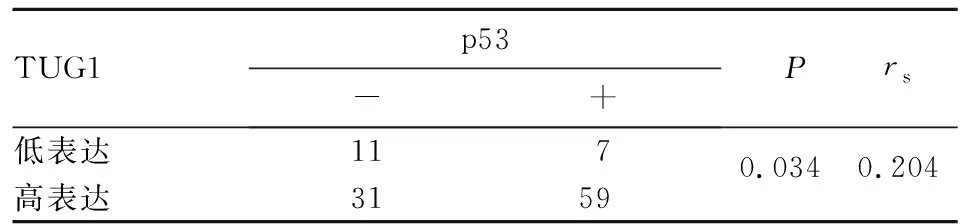
表2 胃腺癌组织TUG1表达和p53表达的关系
3 讨论
胃癌的发生一般经历慢性浅表性胃炎、慢性萎缩性胃炎、肠上皮化生、上皮内瘤变等多个阶段,最终发展为进展期胃癌。在整个过程中,环境、饮食等因素发挥重要作用,同时伴随着多种癌基因激活、抑癌基因失活或缺失等改变。
lncRNA没有完整的开放阅读框架,不编码蛋白质,以RNA的形式发挥作用。越来越多研究表明,lncRNA在细胞代谢过程中具有重要作用,包括细胞增殖、分化、凋亡、侵袭等[4,5]。
TUG1在人类各种组织细胞中广泛表达,是调控视网膜及神经系统正常发育的必需基因,在小鼠大脑皮层发育的多个关键时期均能检测到高表达[6]。研究表明,TUG1在非小细胞肺癌、结直肠癌、肝细胞癌、胆管癌、B细胞淋巴瘤等组织中异常表达[7~9]。Baratieh等[10]研究发现,TUG1在胃癌组织中表达显著上调,且与患者临床病理特征密切相关。Zhang等[11]研究表明,TUG1在胃癌组织中表达升高,其表达变化能够促进胃癌细胞增殖。Isin等[12]研究表明,多发性骨髓瘤患者血浆TUG1水平明显高于体检健康者。Ren等[13]研究表明,在胃癌细胞BGC-823和SGC-7901中,TUG1可通过负性调节miRNA-145-5p,促进胃癌细胞的增殖、侵袭能力。但也有研究发现,TUG1在多种恶性肿瘤组织中低表达。Zhang等[14]研究表明,在非小细胞肺癌组织中TUG1表达明显低于癌旁正常组织,TUG1低表达与肿瘤患者预后差、肿瘤大小及TNM分期密切相关,且TUG1可作为非小细胞肺癌患者预后的独立预测因子。Fan等[15]研究表明,TUG1在乳腺癌组织中低表达,且与突变型p53表达及淋巴结转移密切相关。TUG1在不同肿瘤中的表达不一致,我们认为可能与各肿瘤的病因和发病机制不同有关。本研究选取108例份胃腺癌组织及癌旁正常组织,经real-time PCR检测发现,TUG1在胃腺癌组织中的高表达率及相对表达量均高于癌旁正常组织;进一步分析发现,TUG1高表达与患者肿瘤大小、浸润深度、区域淋巴结转移及临床分期有关。
TUG1启动子包含p53结合位点,可以由p53直接诱导表达,故p53对于TUG1表达具有重要的调控作用。p53是一种抑癌基因,按基因型不同,可分为野生型和突变型,其突变型由于空间结构发生变化,失去了抑癌基因作用,从而能促进肿瘤生长[16]。但在胃腺癌组织中鲜见TUG1表达与p53表达关系的报道。本研究结果显示,在胃腺癌组织中p53阳性表达率为61%,且与TUG1高表达呈正相关关系。由于本研究所选病例数相对较少,其结论是否准确还需要大样本量进一步验证。有研究结果表明,TUG1可上调HOBX7表达,而HOBX7启动子能与PRC2的关键分子EZH2结合。有研究认为,TUG1介导的对肿瘤细胞生长调控作用部分归因于对HOXB7的调节,从而参与AKT和MAPK信号通路[14]。本研究虽然发现TUG1高表达与p53阳性表达具有相关性,但其具体作用机制尚不清楚,有待于我们进一步研究。
综上所述,TUG1在胃腺癌组织中高表达,其在胃腺癌发生、发展过程中可能具有癌基因作用,且与肿瘤组织分化程度、浸润深度及临床分期密切相关。此外,TUG1高表达与p53阳性表达呈正相关关系。因此,检测TUG1和p53表达,将有助于评估胃腺癌临床分期及患者预后。

