阿尔茨海默病患者外周血和脑组织GPI基因表达观察及其功能的生物信息学分析
马国维,钟欣,杜可,宫世强,刘明妍,魏敏杰
(中国医科大学药学院,沈阳110122)
阿尔茨海默病(AD)是一种慢性神经退行性疾病,主要临床表现为记忆力逐渐减退、认知功能障碍、行为异常和社交障碍等[1,2]。早期明确诊断可大大减轻AD患者家庭负担和医疗系统压力[3]。然而目前主流的检测方法,如简易智能状态检查量表、CT或MRI检查、18F-脱氧核糖葡萄糖正电子扫描、脑电图、生物学标志物检测等[4~7],均存在一定局限性。近年来生物信息学预测和计算机技术在肿瘤研究的各个方面取得较大进展[8],我们通过生物信息学分析,尝试对AD的发病机制进行分析探讨。近年来能量代谢是AD发病机制研究的热点[9]。生物能量缺陷是与脑老化和AD相关认知衰退的主要原因之一[10,11]。大脑利用全身约25%的葡萄糖,其中大部分通过糖酵解和线粒体氧化磷酸化转导能量以支持突触传递[12]。糖酵解是所有生物体进行葡萄糖分解代谢所必须经过的共同阶段,其中磷酸葡萄糖异构酶(GPI)基因表达障碍可能使大脑对葡萄糖的利用和代谢产生影响。在细胞质中,GPI基因在糖酵解和糖异生途径中起关键作用;在细胞外,GPI基因是脊髓和感觉神经元的神经营养因子,并且作为诱导免疫球蛋白分泌的淋巴因子而发挥作用[13]。鉴于上述背景,2017年7月~2018年8月,本研究通过Gene Expression Omnibus(GEO)数据库,观察了在AD患者脑组织与外周血GPI基因表达变化,并分析GPI基因的功能及其与AD发病的关系。
1 材料与方法
1.1 脑组织、外周血标本来源 健康老年人大脑额叶皮质样本18例份、颞叶皮质样本19例份、海马样本19例份、外周血样本14例份及AD患者大脑额叶皮质样本15例份、颞叶皮质样本10例份、海马样本29例份、外周血样本14例份。外周血样本来自加拿大魁北克省蒙特利尔市部分医院、诊所和老年人护理院。脑组织样本分别来源于美国肯塔基大学阿尔茨海默病研究中心的脑库尸检标本与2008年12月15日~2011年2月24日获得的日本Hisayama市居民尸检样本。
1.2 GPI基因检测 采用GEO芯片技术。通过NCBI的GEO数据库(https://www.ncbi.nlm.nih.gov/geo/),筛选出GDS810、GDS4758、GDS2601三个AD相关芯片,芯片分别采用GPL96[HG-U133A] Affymetrix Human Genome U133A Array、GPL6244 [HuGene-1_0-st] Affymetrix Human Gene 1.0 ST Array [transcript (gene) version]、GPL1211-NIA MGC下载并预处理GPI基因表达资料。各待检样本中GPI表达量通过R语言编写的Shiny应用程序(http://scangeo.dartmouth.edu/ScanGEO/)进行计算。
1.3 GPI相关基因及相关生物学功能分析 利用STRING在线软件(https://string-db.org/)绘制GPI相关基因蛋白-蛋白相互作用(PPI)网络图,纳入条件为分子与分子间连接达到5个或5个以上的基因,从而获得GPI高度相关基因,图形输出以SVG和PNG格式生成。GPI基因相关生物学功能分析采用在线网站Metascape(http://metascape.org/)的基因本体(GO)分析以及京都基因和基因组百科全书(KEGG)功能富集分析,筛选GPI基因可能参与并主要影响的生物学功能或通路。收集P<0.01、基因最小计数3个和富集因子>1.5的富集,选择富集中具统计学意义的术语(P<0.05)作为该集合的富集结果。
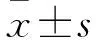
2 结果
2.1 AD患者及健康老年人外周血、脑组织GPI基因表达变化 外周血芯片(GDS2601)分析结果显示,健康老年人外周血GPI基因表达量在男性为4.08±0.25、女性为2.78±0.34,男性AD患者GPI基因表达量为3.60±0.45、女性为2.48±0.21;两者女性外周血GPI基因表达量均低于男性(P均<0.05);相同性别人群中,AD患者外周血GPI基因表达量低于健康老年人(P均<0.05)。脑组织芯片(GDS4758)分析结果显示,AD患者海马组织GPI基因表达明显下调,低于额叶、颞叶皮质(P均<0.05),且在男性、女性中表现出相同趋势。见表1。脑组织芯片(GDS810)分析结果显示,正常老年人及轻、中、重度AD患者海马组织GPI基因表达量分别为11.59±0.41、11.40±0.58、11.26±0.43、10.77±0.78,GPI基因表达量随AD病情加重而持续减少(P均<0.05)。
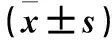
表1 AD患者与健康老年人脑组织GPI基因表达量比较
注:与额叶、颞叶皮质比较,*P<0.05。
2.2 GPI相关基因及生物学功能分析 通过PPI网络图,共筛选出10个与GPI高度相关基因,分别为PKM、TPI1、PFKL、PKLR、PGM1、PFKP、ENO3、PFKM、H6PD、TKT。见图1。GO分析及KEGG功能富集分析结果显示,GPI基因与其相关10个基因在功能富集上与糖酵解、合成、分解、代谢等能量代谢过程高度相关。见图2。提示GPI基因与其相关基因可能参与AD患者海马脑区能量代谢的功能调控。
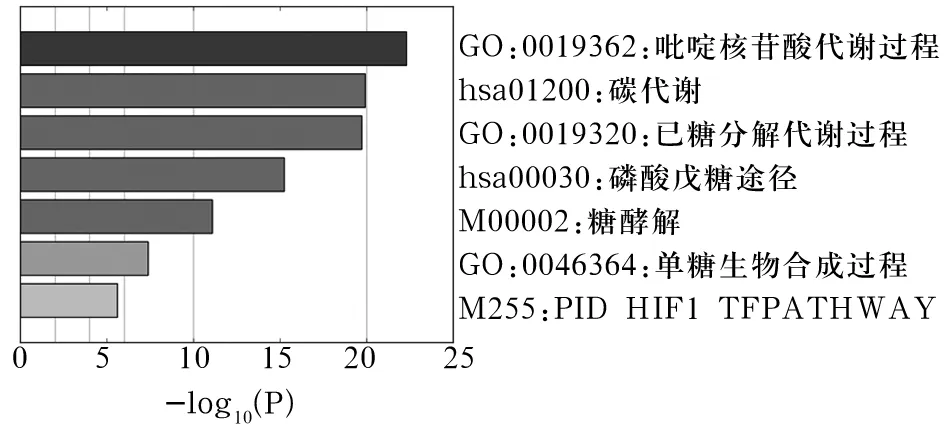
图2 GPI基因功能富集分析结果
3 讨论
目前,生物信息学预测和计算机技术已广泛用于肿瘤研究的各个方面,但在AD相关研究中使用生物信息学分析的报道较少。本研究利用GEO数据库筛选出3个适用于AD的芯片,共检测了138个样本,结果显示,健康老年人中,女性外周血GPI基因表达量低于男性,且低于男性AD患者;相同性别人群中,AD患者外周血GPI基因表达量低于健康老年人。脑组织芯片分析结果显示,AD患者海马组织GPI基因表达明显下调,低于额叶、颞叶皮质,但与性别无关;GPI基因表达量随AD病情加重而持续减少。上述结果提示,AD患者GPI基因表达下调不受性别影响,可以直接通过血液检测观察GPI基因表达变化;同时,GPI基因仅在脑部海马区表达大幅下调,且随AD病情恶化而表达减少,提示可以通过检测GPI基因判断AD并评估病情严重程度。由于GPI基因在外周血与海马组织中的表达一致,而且GPI基因在其他脑区差异表达不明显,故GPI基因可作为一个新的AD生物标志物。由于无法在AD患者存活期采集到海马区样本,而血液样本相对来说容易获得,因此有望通过检测AD患者血液样本GPI基因来辅助诊断AD。
大脑的能量消耗很高,需要使用全身约25%的葡萄糖来维持其能量消耗,其中大部分通过糖酵解和线粒体氧化磷酸化转导能量,这也是神经、骨髓等组织细胞在有氧情况下获得部分能量的有效方式[14]。葡萄糖代谢受损和线粒体功能异常是正常脑老化和AD早期阶段的特征。有学者在脑老化和AD的动物模型及晚期AD尸检标本中观察到神经炎症,但对神经炎症是否为大脑衰老和AD的驱动力仍存在争议,目前认为炎症反应可能仅仅是衰老或AD早期发生能量代谢功能障碍的结果。近年来越来越多的细胞实验、动物模型实验和人类样本研究结果均显示,能量代谢在氧化应激和大脑炎症反应中具有重要作用。大脑代谢炎症轴中能量代谢、氧化应激和神经炎症相互影响,可能作为脑老化和AD病因的综合机制。当葡萄糖利用率和线粒体能量转导能力下降,神经元对葡萄糖的摄取减少,神经元电子传递活性降低,氧化产物生成增多,最终导致一些神经疾病的发生[15]。
GPI基因在海马区表达特异性下调,提示AD的发生、发展与GPI基因功能异常有关。我们通过PPI网络与功能富集分析探索GPI基因的相关基因和生物学功能,共筛选出10个与GPI高度相关基因,分别为PKM、TPI1、PFKL、PKLR、PGM1、PFKP、ENO3、PFKM、H6PD、TKT;GPI基因与其相关基因在功能富集上与糖酵解、合成、分解、代谢等能量代谢过程高度相关。PKM可以催化磷酸烯醇丙酮酸转移到ADP产生ATP的糖酵解酶。PFKL、PFKP、PFKM能通过ATP催化D-果糖6-磷酸磷酸化为果糖1,6-二磷酸(糖酵解的第一步)。同样参与糖酵解过程的基因还有PKLR、PGM1、TPI1、ENO3,而且PKLR在糖酵解过程中具有关键作用。H6PD参与氧化葡萄糖-6-磷酸和葡萄糖及其他己糖-6-磷酸。TKT可以通过与焦磷酸辅因子硫胺的共价中间体,催化二碳酮醇基团从酮糖供体转移到醛糖受体。这些基因皆与能量代谢密切相关。我们认为,AD病程进展与能量代谢功能障碍密不可分,而GPI基因可能是其中的关键基因。GPI主要作为糖酵解酶参与糖酵解过程,并能参与糖代谢、糖合成过程[16]。脑组织GPI基因表达异常可严重影响脑组织的正常功能[17]。最近有动物实验表明,GPI基因及其受体表达增加可能会加强体内学习和记忆形成的突触机制[18]。但是GPI在AD发生、发展中的具体分子机制还有待更深入地研究。
综上所述,AD患者外周血及海马组织GPI基因表达下调,随AD病情加重,其表达持续减少;GPI基因与其相关基因可能参与AD患者海马脑区能量代谢的功能调控。继续对GPI基因进行更深入研究,有望为AD的基础研究和临床诊治提供进一步的理论指导。

