岩藻低聚糖的酶法制备及活性分析
王凤舞,阙 斐,寇玲赟,迟 方,王 莹,*
(1.青岛农业大学食品学院,山东 青岛 266109;2.浙江经贸职业技术学院,浙江 杭州 310018)
岩藻聚糖硫酸酯又称岩藻多糖、褐藻糖胶,是一种高分子质量硫酸杂多糖。经研究表明,它具有广泛的药理学活性,包括抗氧化、抗凝血、抗炎、抗肿瘤、免疫调节、抗菌抗病毒、降血糖血脂、促益生菌生长[1-4]等。岩藻聚糖硫酸酯在治疗癌症、糖尿病、肥胖等领域也具有良好的应用前景,目前已经成为海洋药物研究的热点之一[5-8]。在美国、日本、德国和挪威,该糖均已经作为治疗的候选药物进入临床研究[9];在俄罗斯已作为一种多功能保健食品于2006年上市[10];在中国作为一种治疗慢性肾病[8]的海洋药物的主要成分,也已经成功开发上市[11-12]。
岩藻聚糖硫酸酯的相对分子质量从几万到几十万不等,而大分子多糖口服生物利用度较低,对其进行降解获得低分子质量的产物是提高其生物利用度的有效手段[13-15]。研究报道,分子质量在5~50 kDa的岩藻聚糖硫酸酯具有更高的生物活性[16],比如:对于抗氧化、抗血栓、抗炎、抗补体、抑制癌细胞等方面都比大分子多糖具有优势[17-22]。低分子质量岩藻聚糖硫酸酯的抗氧化活性不仅与分子质量有关系,还与硫酸根的含量、取代基位置等因素有密切关系[23-26]。目前,在岩藻聚糖硫酸酯的降解方法中,酶法降解由于其专一性强、条件温和、不损失硫酸根、重复性好等优势,被公认为最理想的方法。
目前,有关岩藻聚糖硫酸酯酶解产物抗氧化活性的报道较少,少数的研究也都是在实验选定的水平中进行比较寻优,没有实现在整个范围内进行最优化。鉴于上述方法过程高度的复杂性,实验运用人工神经网络与遗传算法[27-28]联合对酶解过程进行最优化,从而实现在指定范围内得到最高抗氧化活性的酶解产物。为进一步验证人工神经网络和遗传算法联合对酶解条件的预测与优化是否准确,对酶解产物的抗氧化活性进行体内实验对比验证,为生产应用提供一定实验支撑。
1 材料与方法
1.1 材料与试剂
产酶菌MD3由山东省中韩食品生物技术研究中心前期筛选获得;SPF级雄性小白鼠,8 周龄,由青岛大任富城畜牧有限公司提供。
岩藻聚糖硫酸酯 日照洁晶海洋生物技术开发有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 美国Sigma公司;VC青岛农业大学校医院;丙二醛(methane dicarboxylic aldehyde,MDA)、过氧化氢酶(catalase,CAT)、抑制羟自由基能力以及蛋白质定量测定试剂盒 南京建成生物工程研究所;C-buffer(20 mmol/L pH 8.0 Tris-HCl溶液,含0.2 mol/L NaCl)。
种子培养基:岩藻聚糖质量分数0.2%,蛋白胨质量分数0.4%,用过膜海水配制;产酶培养基:岩藻聚糖质量分数0.2%,蛋白胨质量分数0.2%,用过膜海水配制。
1.2 仪器与设备
超净工作台 苏净集团安泰公司;UH-1200B超声波细胞破碎仪 天津奥特赛恩斯仪器有限公司;FD-1D-80冷冻干燥机 北京博医康实验仪器有限公司;DU-800型紫外-可见分光光度计 美国贝克曼公司;SHA-B水浴恒温振荡器 常州国华电器有限公司;1100高效液相色谱仪 安捷伦科技有限公司;TGL-16M高速台式冷冻离心机 湖南湘仪离心机仪器有限公司;PPM-18S/T膜分离设备 三达膜(厦门)有限公司。
1.3 方法
1.3.1 岩藻聚糖硫酸酯酶的制备
将活化后的菌种MD3接种于种子培养基,25 ℃、180 r/min水浴恒温振荡器培养12 h制备一级种子液。随后按照体积分数10%接入250 mL三角瓶(装50 mL产酶培养基),25 ℃、150 r/min培养48 h,获得发酵产物。随后将培养液在10 000 r/min冷冻离心10 min,收集菌体。每2 g湿菌体用50 mL冷冻C-buffer复溶,在冰浴保护下于500 W进行超声破碎15 min(工作5 s,停止5 s),10 000 r/min冷冻离心10 min,取上清液得到粗酶液,将其冷冻干燥成粉末备用,在使用时用蒸馏水复溶至冻干前的体积。
1.3.2 酶活力测定
酶活力的测定采用铁氰化钾法,具体步骤参考王莹[30]方法。
1.3.3 基本酶解工艺条件优化
量取2 mg/mL岩藻聚糖样液(用C-buffer溶解)4 mL,按加酶量12 U/mg加入岩藻聚糖硫酸酯酶,调节C-buffer用量,使反应体系总体积为10 mL,在25 ℃、120 r/min水浴振荡器酶解2 h,所得酶解液于80 ℃灭酶20 min,10 000 r/min离心15 min,取上清液,备用。考察加酶量(0、6、12、18、24、30、36 U/mg)、酶解时间(0、5、10、15、20、25 h)、酶解温度(20、25、30、35、40、45、50 ℃)3 个因素对酶解产物分子质量分布及DPPH自由基清除率的影响,确定后续试验的优化范围。并在此优化范围内,参照均匀设计和正交试验原理,设计122 组试验,从而为BP网络的建模提供“教师信号”,并为后续遗传算法的优化奠定基础。
1.3.4 分子质量分布测定
以高效凝胶排阻色谱方法检测分子质量的变化。色谱条件如下:色谱柱:TSK-gel G4000 PWXL(30 cm×7.8 mm,10 μm);柱温:40 ℃;流动相:0.2 mol/L NaCl溶液;流速:0.5 mL/min;检测器:示差检测器。以分子质量为4.11、5、66.9、140、148 、410、670 kDa的葡聚糖系列为标准品。采用Agilent GPC软件分析分子质量分布。
1.3.5 人工神经网络建模
使用3 层前向神经网络模拟酶解条件与产物抗氧化活性的关系,学习方法采用BP算法[29]。建模过程选用前馈式3 层神经网络,输入层有3 个神经元,分别为酶解时间、加酶量、酶解温度。隐含层为一层,并通过试行误差法确定神经元个数,输出层有1 个神经元,代表酶解产物的DPPH自由基清除率。参照均匀设计和正交设计的思想,在试验考察范围内,设计实施122 组试验,随机选取其中的107 组数据作为BP网络的训练样本,剩余的15 组数据作为检验样本。上述建模过程利用Matlab软件实现,输出层采用Purelin函数作为传递函数,训练函数为Traingdm,设定BP网络训练步数为2000,网络性能的目标误差为0.01。
1.3.6 遗传算法优化
利用Matlab软件的遗传算法工具箱对上述BP网络模型进行寻优。以BP网络模型预测结果的相反数作为适应度函数返回值编写成M文件,作为遗传算法的调用函数,进行寻优。初始种群数目设定20,变异概率0.05,交叉概率0.75,最大传代数为100 代,其他参数设定为软件默认。
1.3.7 体内实验样品的制备
在1.3.3节基本酶解工艺条件下,选用遗传算法寻优获得的最优酶解条件,在此条件下对岩藻聚糖硫酸酯进行酶解。将上清液经截留分子质量为250 Da的超滤膜过滤,除去小分子盐类。截留液用旋转蒸发仪进行浓缩后冷冻干燥,得到岩藻低聚糖组;岩藻聚糖硫酸酯组为提前将酶于80 ℃灭酶20 min后,其余制备流程与岩藻低聚糖组相同。
1.3.8 小鼠的分组与饲养
将40 只标记好的小鼠分成5 组,分别为:空白组、模型组、阳性组、岩藻聚糖硫酸酯组和岩藻低聚糖组。将小鼠在温度(20±2)℃进行饲养,让小鼠自由取食3 d,以适应环境。3 d后,用200 mg/(kg·d)(以体质量计,下同)的D-半乳糖(20 mg/mL)皮下注射各组小鼠(空白组用等量生理盐水注射),建立小鼠衰老模型。空白组和模型组小鼠灌胃0.1 mL/(10 g·d)的生理盐水,阳性组小鼠灌胃等体积VC,剂量为200 mg/(kg·d),岩藻聚糖硫酸酯组和岩藻低聚糖组分别灌胃等体积剂量为200 mg/(kg·d)冻干样品(用生理盐水溶解)。每天定时灌胃1 次,皮下注射1 次,持续42 d。
1.3.9 小鼠的血浆和肝脏组织上清液的制备
在处死小鼠之前的24 h,停止喂食,保障自由饮水。取小鼠眼球血1~2 mL于预先加入10 μL 50%柠檬酸钠的2 mL离心管内,4 000 r/min、4 ℃低温离心5 min,取上清液,备用。脱颈处死小鼠,解剖取肝脏,-20 ℃保存。使用时用组织研磨器研磨均匀,制成10%肝脏组织匀浆,5 000 r/min、4 ℃低温离心5 min,取上清液备用。1.3.10 抗氧化能力的测定
体外实验抗氧化能力采用DPPH自由基清除率测定方法,参照王莹[30]方法。体内抗氧化能力依据CAT活性、抑制羟自由基能力及MDA含量测定,参见试剂盒说明书。
1.4 数据处理
2 结果与分析
2.1 加酶量对产物分子质量分布和DPPH自由基清除率的影响
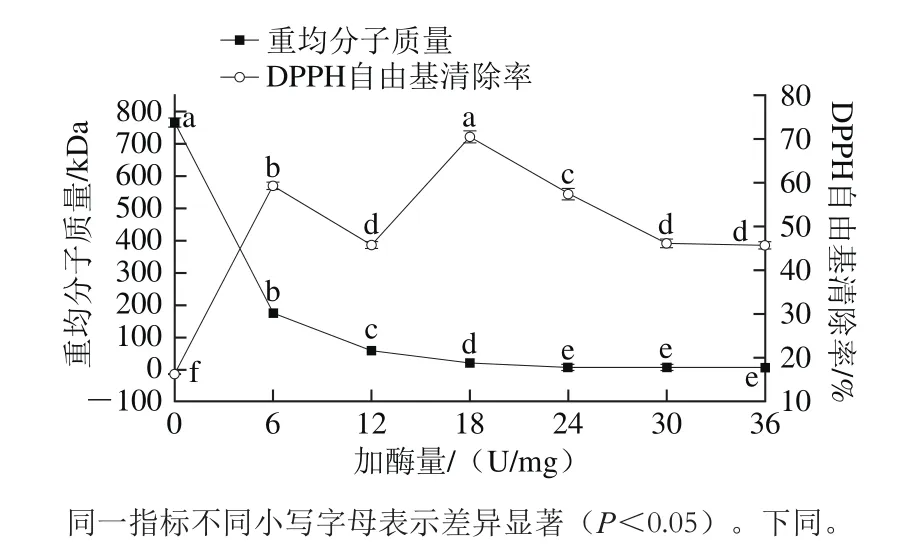
图1 加酶量对酶解产物分子质量分布和DPPH自由基清除率的影响Fig. 1 Effects of enzyme concentration on molecular weight distribution and DPPH scavenging activity of hydrolysates
在不同加酶量条件下,会获得不同分子质量的岩藻聚糖硫酸酯,同时,其分子质量与其生物活性存在着很大的相关性[18,20,31-32]。由图1可知,在25 ℃酶解2 h的条件下,加酶量达到24 U/mg以上时,酶解产物的分子质量均不存在显著差异(P>0.05),说明酶的作用完全;且当加酶量在0~24 U/mg范围内时,酶解产物的DPPH自由基清除率出现了显著变化,涵盖了最小值16.32%和最大值70.44%,这个范围属于酶的有效降解范围,因此,综合分子质量的变化结果,选择加酶量范围为0~24 U/mg。
2.2 酶解时间对产物分子质量分布和DPPH自由基清除率的影响
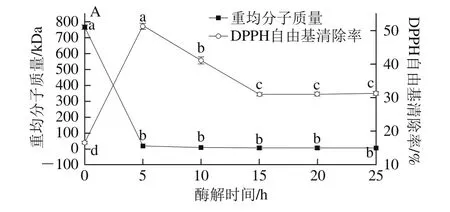
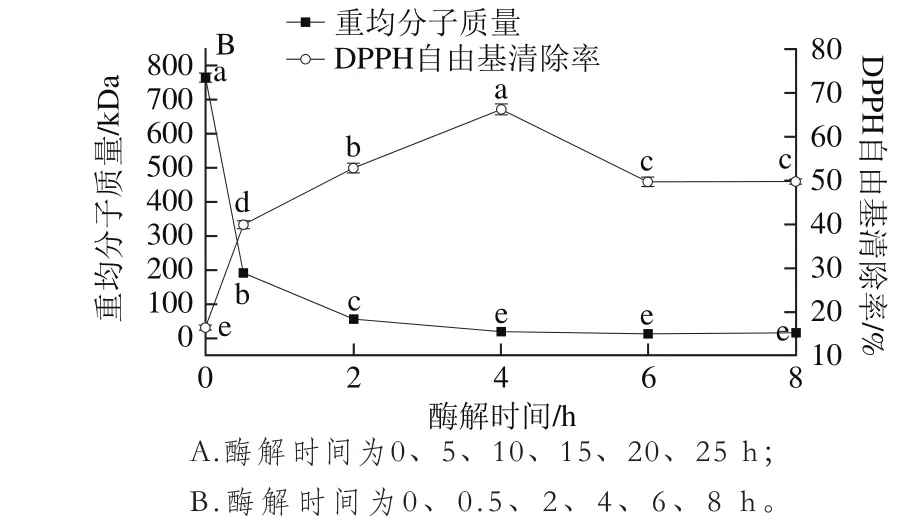
图2 酶解时间对酶解产物分子质量分布和DPPH自由基清除率的影响Fig. 2 Effects of hydrolytic time on molecular weight distribution and DPPH scavenging activity of hydrolysates
由图2A可知,在加酶量12 U/mg、酶解温度25℃条件下,酶解5、10、15、20、25 h时酶解产物的分子质量分布没有显著性差异(P>0.05),说明酶解5 h酶已经作用完全,且在5 h以内产物的DPPH自由基清除率就涵盖了最高值(51.18%)和最低值(16.50%),因此应该继续补充8 h以内的酶解实验。由图2B可知,酶解4 h以后产物分子质量分布没有显著性差异,且0~4 h内酶解产物的DPPH自由基清除率出现整个范围内的最高值(66.13%)和最低值(16.50%),属于酶的有效降解范围,因此后续优化试验范围设定在0~4 h。
2.3 酶解温度对产物分子质量分布和DPPH自由基清除率的影响
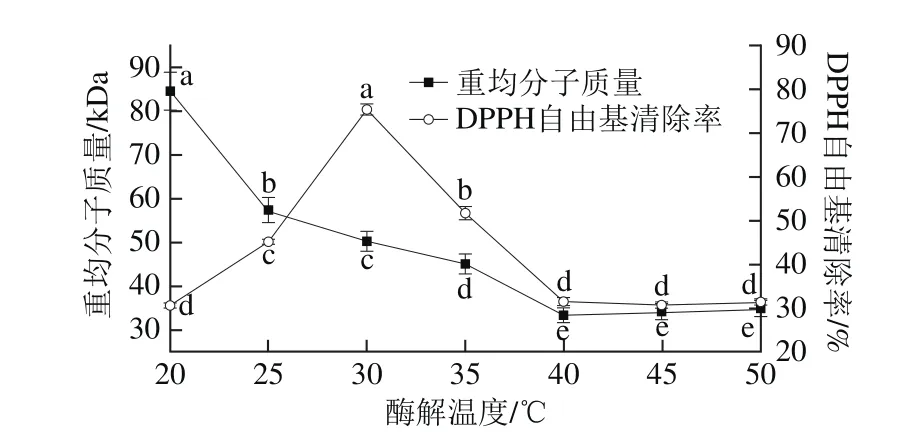
图3 酶解温度对酶解产物分子质量分布和DPPH自由基清除率的影响Fig. 3 Effects of hydrolytic temperature on molecular weight distribution and DPPH scavenging activity of hydrolysates
由图3可知,在加酶量12 U/mg、酶解时间2 h条件下,酶解温度达到40 ℃以上,对酶解产物分子质量没有显著影响(P>0.05),在20~40 ℃内,酶解产物的DPPH自由基清除率涵盖了最低值(30.68%)和最高值(75.40%),属于酶的有效降解范围,因此,综合分子质量的变化结果,将酶解温度设定为20~40 ℃。
综合上述单因素试验结果,选择加酶量0~24 U/mg、酶解时间0~4 h、酶解温度20~40 ℃作为人工神经网络的模拟范围。
2.4 BP网络模型的建立
在优化范围内实施122 组试验作为BP网络的教师信号,数据见表1,检验样本数据见表2。通过Matlab软件,利用教师信号对上述BP网络模型对DPPH自由基清除率进行训练。试错法确定BP网络模型隐含层神经元个数为20 个,BP网络模型经过不到50 步训练后,网络性能达到稳定。15 个检验样本的预测误差总和为49.8,其中最大误差小于8%(图4),说明该BP网络模型能够很好地模拟酶解过程产物的DPPH自由基清除率,该模型训练总时间仅为3.3 s,说明建模过程十分快速。
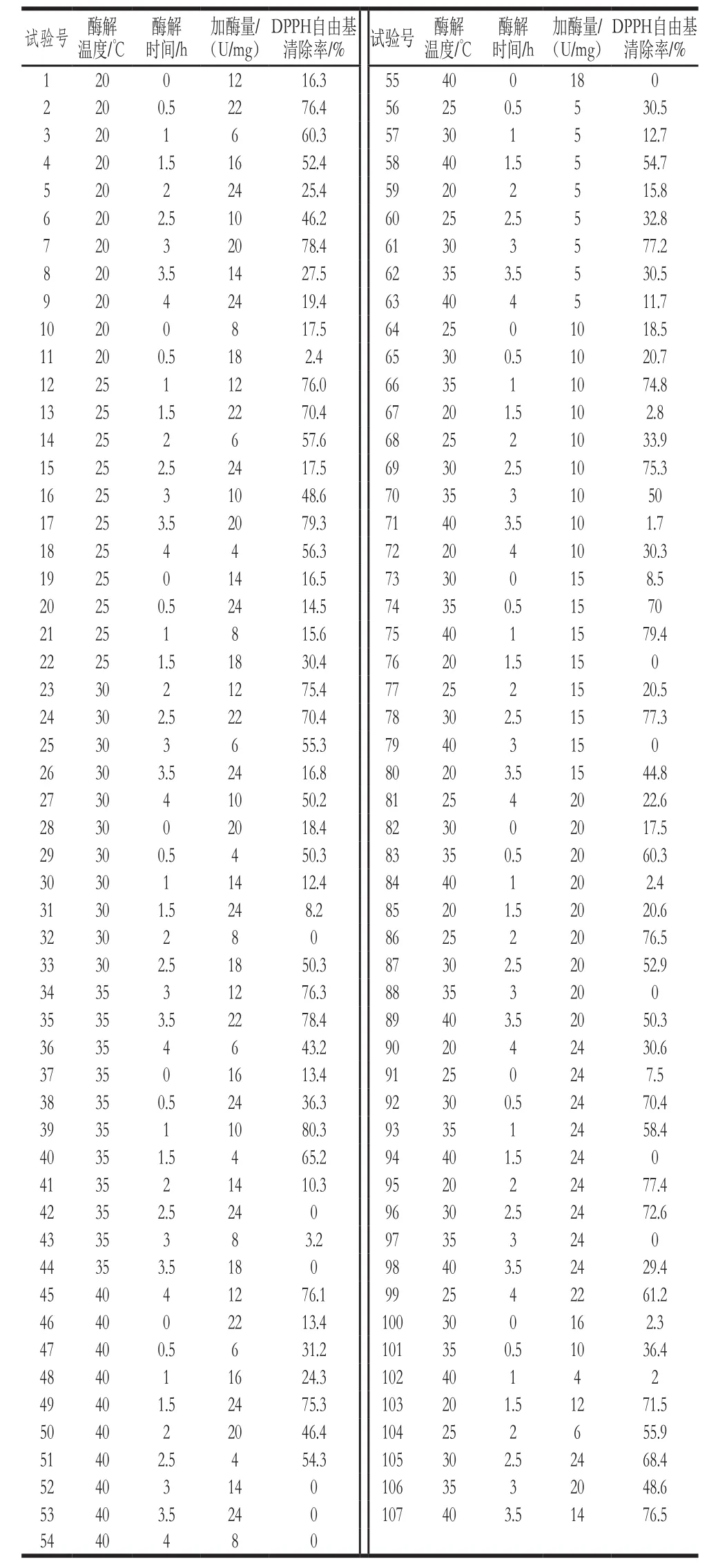
表1 BP网络的训练样本Table1 Training samples for BP network
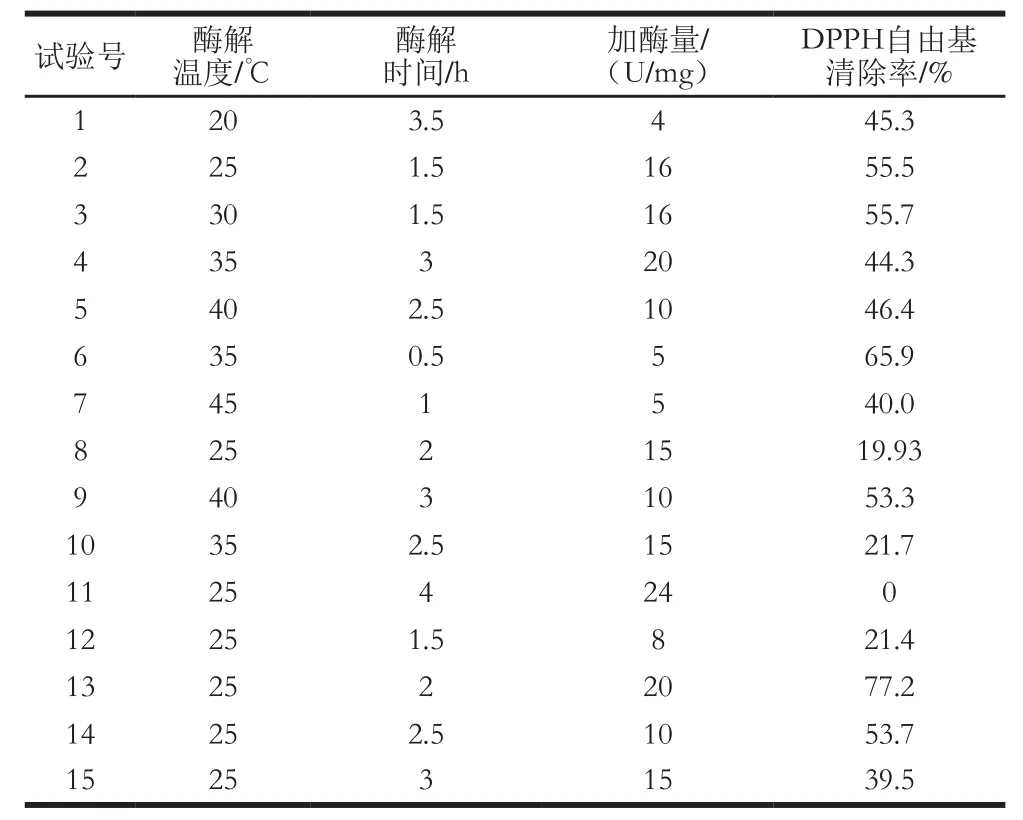
表2 BP网络检验样本Table2 Test samples for BP network
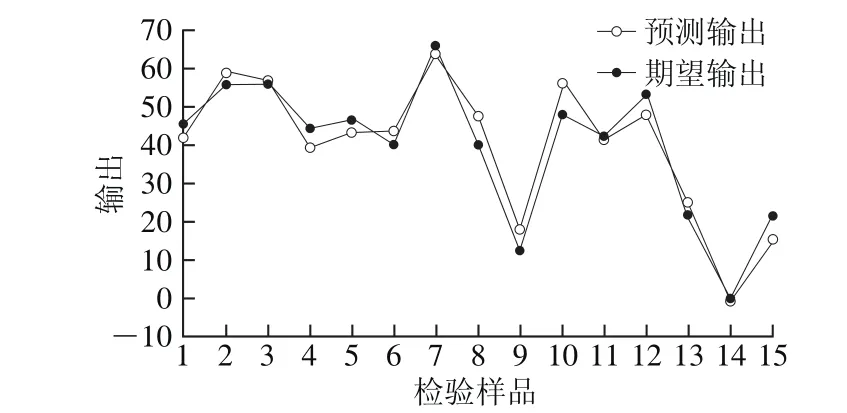
图4 BP网络预测与期望输出Fig. 4 Predicted and expected output of BP network
2.5 应用GA对酶解条件进行寻优
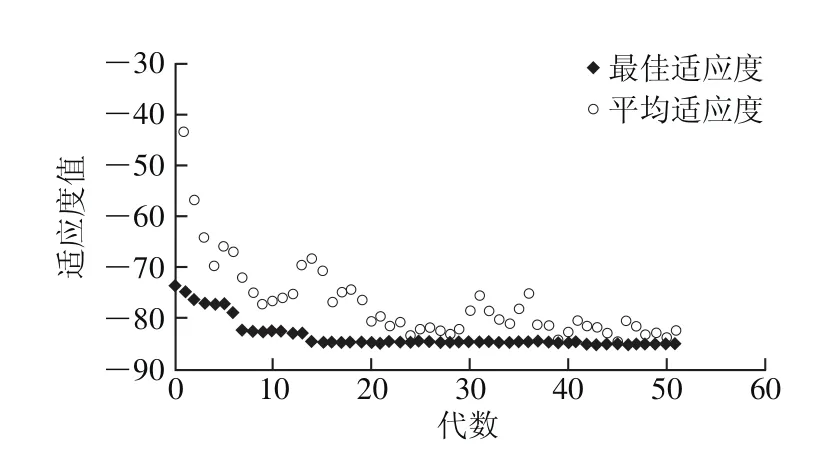
图5 GA的寻优进化曲线Fig. 5 Evolutionary curve of GA optimization
利用Matlab软件GA工具箱,经过51 代进化,由图5可知,GA寻优得到最大DPPH自由基清除率85.1%,对应的酶解条件为酶解温度26.4 ℃、酶解时间2.3 h、加酶量20.7 U/mg。
2.6 最优结果验证
以最优条件为基础,在酶解温度26 ℃、酶解时间2.3 h、加酶量20.7 U/mg的条件下进行岩藻聚糖硫酸酯的酶解,测定酶解产物的DPPH自由基清除率达到83.7%,与预测值85.1%误差仅1.4%,说明利用人工神经网络与遗传算法联合的方法对酶解过程进行寻优是可行的。并利用高效凝胶排阻色谱测定酶解产物的重均分子质量为18.2 kDa。
2.7 体内抗氧化实验结果
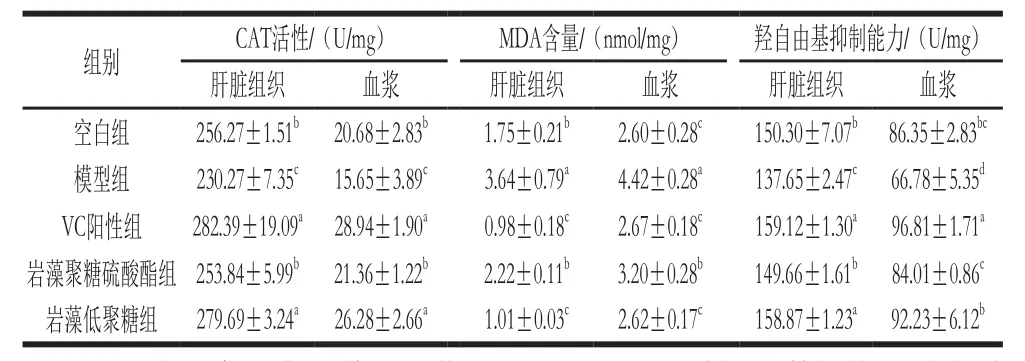
表3 小鼠血浆和肝脏组织中CAT活性、MDA含量、羟自由基抑制能力Table3 CAT activity, MDA content and hydroxyl radical scavenging activity in rat serum and liver tissues
由表3可知,模型组与空白组相比,模型组小鼠的肝脏组织和血浆的CAT活性、羟自由基抑制能力有显著性下降,MDA含量显著升高说明模型建立成功。与模型组相比,岩藻聚糖硫酸酯组和岩藻低聚糖组小鼠的肝脏组织和血浆的CAT活性和羟自由基抑制能力都有显著提高,MDA含量显著降低,说明岩藻聚糖硫酸酯和岩藻低聚糖都具有抗氧化能力。且岩藻低聚糖组肝脏和血浆的CAT活性、羟自由基抑制能力显著高于岩藻聚糖硫酸酯组,MDA含量显著低于岩藻聚糖硫酸酯组,说明小分子的岩藻低聚糖有更好的抗氧化效果。与阳性对照组VC相比,岩藻聚糖硫酸酯组抗氧化能力较弱,岩藻低聚糖组与其相当(除血浆中抑制羟自由基能力以外);上述结果可以说明,岩藻低聚糖组比岩藻聚糖硫酸酯组具有更显著的抗氧化活性,进一步印证BP网络模型与遗传算法联合优化效果显著,所获得的岩藻聚糖硫酸酯酶法降解产物抗氧化活性显著增强。
3 讨 论
本实验运用人工神经网络和遗传算法,以产物抗氧化活性为指标优化酶解条件,实现了整个酶解范围内的优化。宋亮[33]、王共明[34]、杨青丹[35]等都是通过使用单因素试验、正交试验等来优化酶解工艺;文献[36-37]研究发现DPPH自由基清除率与其分子质量有关,且分子质量越小抗氧化活性越好;Millet等[38]从钩角藻岩藻多糖中得到了低分子质量(8 kDa)的组分,发现其具有很高的抗血栓活性;Zhuang Cun等[39]从鼠尾藻中分离出多个不同分子质量的岩藻低聚糖组分,并发现岩藻低聚糖组分显著延长了患癌小鼠的存活时间,存活率分别比对照组高了3.49 倍和2.15 倍。但上述所有的研究都是在很小的实验范围内进行比较寻优,没有实现多维空间内的最优化。本实验发现当酶解温度、加酶量、酶解时间分别为20~40 ℃、0~24 U/mg、0~4 h时,酶解产物分子质量会发生显著变化,以此作为优化范围。通过107 组试验数据作为教师信号的训练样本,建立了模拟岩藻聚糖硫酸酯酶解过程的BP网络模型,并利用15 组数据对模型进行检验,所建模型预测值与实际输出误差小于8%,该模型训练总时间仅为3.3 s,可以用于对酶解过程的模拟。利用遗传算法对上述模型进行寻优,得到酶解产物的最大DPPH自由基清除率为85.1%,此时对应的酶解条件为酶解温度26.4 ℃、酶解时间2.3 h、加酶量20.7 U/mg,测得上述酶解产物的重均分子质量为18.3 kDa。考虑到实际生产,在酶解温度26 ℃、酶解时间2.3 h、加酶量20.7 U/mg时进行酶解,测得其DPPH自由基清除率为83.7%。并测得上述酶解产物的重均分子质量为18.2 kDa。体内动物实验结果表明,岩藻低聚糖比岩藻聚糖硫酸酯在清除羟自由基、降低MDA含量及CAT活性方面具有更显著的抗氧化作用,为工业化制备高抗氧化活性岩藻聚糖硫酸酯酶解产物提供了实验支撑。同时,利用BP网络并联合GA进行寻优的模式,可以推广到酶解产物的任意一种生物活性,只要实验误差在合理的范围内,便可期待进行模拟和寻优。
[1] VOA T S, KIM S K. Fucoidans as a natural bioactive ingredient for functional foods[J]. Journal of Functional Foods, 2013, 5(1): 16-27.DOI:10.1016/j.jff.2012.08.007.
[2] KIM H, LEE A, JUNG W K, et al. Effects of fucoidan on cell morphology and migration in osteoblasts[J]. Food Science and Biotechnology, 2015, 24(2): 699-704. DOI:10.1007/s10068-015-0091-2.
[3] SONG Y F, WANG Q K, HE Y H, et al. The positive effects of fucoidans extracted from the brown seaweed Saccharina japonica on protection against CCl4-induced liver injury[J]. Journal of Applied Phycology, 2017, 29: 2077-2087. DOI:10.1007/s10811-017-1097-3.
[4] LAURA M, MARIA T A, ELENA M M, et al. In vitro anti-canine distemper virus activity of fucoidan extracted from the brown alga Cladosiphon okamuranus[J]. Virusdisease, 2014, 25(4): 474-480.DOI:10.1007/s13337-014-0228-6.
[5] HAN Y S, LEE J H, CHANG H S, et al. Inhibition of Lewis lung cancer cell growth and migration by fucoidan[J]. Original Paper, 2014, 10: 269-276. DOI:10.1007/s13273-014-0030-y.
[6] LI B, LU F, WEI X J, et al. Fucoidan: structure and bioactivity[J].Molecules, 2008, 13(8): 1671-1695. DOI:10.3390/molecules13081671.
[7] WIJESINGHEA W, JEONA Y J. Biological activities and potential industrial applications of fucose rich sulfated polysac charides and fucoidans isolated from brown seaweeds: a review[J]. Carbohydrate Polymers, 2012, 88(1): 13-20. DOI:10.1016/j.carbpol.2011.12.029.
[8] LEE S H, KO C I, JEE Y, et al. Anti-inflammatory effect of fucoidan extracted from Ecklonia cava in zebrafish model[J]. Carbohydrate Polymers, 2013, 92(1): 84-89. DOI:10.1016/j.carbpol.2012.09.066.
[9] KIM S K, RATIH P. Biological activities and potential health benefits of fucoxanthin derived from marine brown algae[J]. Carbohydrate Polymers,2011, 84(1): 14-21. DOI:10.1016/B978-0-12-387669-0.00009-0.
[10] KWAK J Y. Fucoidan as a marine anticancer agent in preclinic development[J]. Marine Drugs, 2014, 12(2): 851-857. DOI:10.3390/md12020851.
[11] SVETLANA E, MIKHAIL K, ANTONIO T, et al. Are multifunctional marine polysaccharides a myth or reality?[J]. Frontiers in Chemistry,2015(3): 39. DOI:10.3389/fchem.2015.00039.
[12] WANG J, ZHANG Q B, JIN W H, et al. Effects and mechanism of low molecular weight fucoidan in mitigating the peroxidative and renal damage induced by adenine[J]. Carbohydrate Polymers, 2011, 84(1): 417-423. DOI:10.1016/j.carbpol.2010.11.055.
[13] WANG J, WANG F, YUN H. Effect and mechanism of fucoidan derivatives from Laminaria japonica in experimental adenine-induced chronic kidney disease[J]. Carbohydrate Polymers, 2012, 139(3): 807-813.DOI:10.1016/j.jep2011.12.022.
[14] WU Y, YE M, DU Z Z. Carboxymethylation of an exopolysaccharide from Lachnum and effect of its derivatives on experimental chronic renal failure[J]. Carbohydrate Polymers, 2014, 114: 190-195. DOI:10.1016/j.carbpol.2014.07.075.
[15] NAGAMINE T, NAKAZATO K, TOMIOKA S, et al. Intestinal absorption of fucoidan extracted from the brown seaweed, Cladosiphon okamuranus[J]. Marine Drugs, 2014, 13(1): 48-64. DOI:10.3390/md13010048.
[16] 闫相勇, 刘翼翔, 凌绍梅, 等. 低分子量岩藻聚糖酶法制备工艺[J]. 农业工程学报, 2014, 30(4): 279-285. DOI:10.3969/j.issn.1002-6819.2014.04.034.
[17] 陈安进. 不同分子质量海带岩藻聚糖硫酸酯抗血栓活性及机理研究[D]. 青岛: 中国海洋大学, 2012: 18-20.
[18] WANG P A, HUNG Y L, PHAN N N, et al. The in vitro and in vivo effects of the low molecular weight fucoidan on the bone osteogenic differentiation properties[J]. Cytotechnology, 2016, 68(4): 1349-1359.DOI:10.1007/s10616-015-9894-5.
[19] CHEN A J, ZHANG F, SHI J, et al. Study on antithrombotic and antiplatelet activities of low molecular weight fucoidan from Laminaria japonica[J]. Journal of Ocean University of China, 2012, 11(2): 236-240.DOI:10.1007/s11802-012-1874-1.
[20] SHU Z, SHI X, NIE D, et al. Low-molecular-weight fucoidan inhibits the viability and invasiveness and triggers apoptosis in IL-1β-treated human rheumatoid arthritis fibroblast synoviocytes[J]. Inflammation,2015, 38(5): 1777-1786. DOI:10.1007/s10753-015-0155-8.
[21] 董诗竹. 海带低分子量岩藻聚糖硫酸酯的制备及其抗血栓活性研究[D]. 青岛: 中国海洋大学, 2011: 22-26.
[22] 袁松. 不同分子量海带岩藻聚糖硫酸酯对大鼠抗胃溃疡作用的研究[D]. 青岛: 中国海洋大学, 2014: 12-15.
[23] 曲桂燕. 五种褐藻岩藻聚糖硫酸酯提取纯化及其功能活性的比较研究[D]. 青岛: 中国海洋大学, 2013: 19-25.
[24] 李芳. 不同分子量海带岩藻聚糖硫酸酯消化吸收、免疫及抗病毒活性的比较研究[D]. 青岛: 中国海洋大学, 2012: 28-29.
[25] 邓志程, 吉宏武, 曹文红, 等. 人工神经网络优化酶法制备马氏珠母贝低聚肽的工艺研究[J]. 广东农业科学, 2014, 41(24): 99-104.DOI:10.16768/j.issn.1004-874x.2014.24.008.
[26] 尚朝杰, 王维民, 谌素华, 等. 应用神经网络优化芒果果汁的酶解工艺[J]. 食品工业科技, 2014, 35(19): 238-241. DOI:10.13386/j.issn1002-0306.2014.19.042.
[27] ETHAIB S, OMAR R, MAZLINA M K S. Development of a hybrid PSO-ANN model for estimating glucose and xylose yields for microwave-assisted pretreatment and the enzymatic hydrolysis of lignocellulosic biomass[J]. Neural Computing and Applications, 2016:1-11. DOI:10.1007/s00521-016-2755-0.
[28] ALI B, MOHAMED H, RAFIK B, et al. Antioxidant and free radical-scavenging activities of smooth hound (Mustelus mustelus)muscle protein hydrolysates obtained by gastrointestinal proteases[J].Food Chemistry, 2009, 114(4): 1198-1205. DOI:10.1016/j.foodchem.2008.10.075.
[29] 马锐. 人工神经网络原理[M]. 北京: 机械工业出版社, 2014: 85-90.
[30] 王莹. 岩藻聚糖硫酸酯酶产生菌的筛选、酶学性质研究及酶解产物抗氧化活性预测系统的建立[D]. 青岛: 中国海洋大学, 2013: 60-76.
[31] PARK E J, CHOI J I. Melanogenesis inhibitory effect of low molecular weight fucoidan from Undaria pinnatifida[C]//22nd International Seaweed Symposium, Copenhagen, 2017: 1-5.
[32] WANG T, ZHU M, HE Z Z. Low-molecular-weight fucoidan attenuates mitochondrial dysfunction and improves neurological outcome after traumatic brain injury in aged mice: involvement of sirt3[J]. Cellular and Molecular Neurobiology, 2016, 36(8): 1257-1268. DOI:10.1007/s10571-015-0323-2.
[33] 宋亮, 曹龙奎, 刁静静, 等. 玉米ACE抑制肽水解酶的筛选及酶解条件的优化[J]. 食品工业科技, 2012, 33(16): 204-208. DOI:10.13386/j.issn1002-0306.2012.16.080.
[34] 王共明, 张健, 王茂剑, 等. 仿刺参卵酶解工艺条件优化[J]. 食品科学, 2012, 33(23): 193-198.
[35] 杨青丹, 胡婷春. 稻草秸秆酶解工艺优化研究[J]. 食品与发酵科技,2010, 46(5): 24-27. DOI:10.3969/j.issn.1674-506X.2010.05-007.
[36] 赵雪. 海带岩藻聚糖硫酸酯的化学组成及活性的研究[D]. 青岛:中国海洋大学, 2004: 34-69.
[37] ZHAO X, XUE C H, CAI Y P, et al. The study of antioxidant activities of fucoidan from Laminaria japonica[J]. 高技术通讯: 英文版, 2005,11(1): 91-94.
[38] MILLET J, JOUAULT C S, MAURAY S, et al. Antithrombotic and anticoagulant activities of a low molecular weight fucoidan by the subcutaneous route[J]. Thrombosis and Haemostasis, 1999, 81(3): 391-395.
[39] ZHUANG C, ITOH H, MIZUNO T, et al. Antitumor active fucoidan from the brown seaweed, umitoranoo (Sargassum thunbergii)[J].Bioscience, Biotechnology, and Biochemistry, 1995, 59(4): 563-567.DOI:10.1271/bbb.59.563.

