圆叶葡萄种子发育过程中多酚积累特性
魏 征,郭文锋,黄 羽*,尹 玲,曲俊杰,张雅丽,卢 江,4,*
(1.中国农业大学食品科学与营养工程学院,北京 100083;2.广西农业科学院广西作物遗传改良生物技术重点开放实验室,广西 南宁 530007;3.广西农业科学院葡萄与葡萄酒研究所,广西 南宁 530007;4.上海交通大学农业与生物学院,葡萄与葡萄酒研究中心,上海 200240)
圆叶葡萄起源于美国东南部地区,很少在美国以外的地方种植[1-2]。与真葡萄相比,因其具有较强的抗性(抗氧化、抗癌、抗菌和抗炎等),可耐高温高湿环境,对根瘤蚜、霜霉病和白粉病等真菌类疾病免疫[3-6],而备受葡萄育种学家的青睐。本实验室陆续从美国引进多个圆叶葡萄品种,定植于广西、云南和福建等地,可实现一年两熟[7-8]。
多酚类化合物是葡萄果实中重要的次生代谢产物[3,9-10]。在葡萄属植物中,目前只在圆叶葡萄中检测到鞣花酸类化合物,包括鞣花酸衍生物和鞣花单宁,为圆叶葡萄中多酚的主要形式[10-12]。葡萄果实中的多酚大多分布在果皮和种子中,其中果皮中占28%~35%,种子中占60%~70%,果肉中不到10%[1,3,13-14]。本实验室前期针对圆叶葡萄中以鞣花酸为主的多酚化合物提取工艺进行了优化[15],随后对比了广西、云南和美国地区不同品种圆叶葡萄多酚积累差异,发现广西地区圆叶葡萄含有更高的鞣花酸及前体物。其中,果皮中积累更高的鞣花酸衍生物,如鞣花酸和鞣花酸葡萄糖,种子中含有更高的鞣花酸生物合成前体物,如五-O-没食子酰葡萄糖[12]。
在葡萄生长发育过程中,果实中多酚组成和含量发生着巨大的变化[16-17]。研究表明,葡萄中的多酚从幼果期开始逐步积累,但在转色和成熟过程中,不同类别多酚变化有较大的差异。如欧亚种酿酒葡萄成熟过程中,酚酸和黄烷-3-醇的组成和含量在不同葡萄品种、不同年份之间显著不同[18]。但对圆叶葡萄,较多研究分析了美国不同地区气候因子和农艺学措施对不同品种多酚积累的影响,而较少涉及生长发育期的积累变化[1,19-20],尤其是当圆叶葡萄被引种到我国后,相关营养品性分析不足。本实验室前期对圆叶葡萄果皮发育过程中的多酚特性进行了分析,发现其果皮中积累最高比例的鞣花酸及前体物(主要是鞣花酸衍生物),在发育过程中具有显著的品种特异性,而在其种子中的积累特性尚不明确。
本研究以栽培于广西地区2 个圆叶葡萄‘Noble’和‘Carlos’和2 个真葡萄‘赤霞珠’和‘雷司令’为实验材料,深入分析圆叶葡萄种子发育过程中多酚积累和变化规律,为丰富我国葡萄种质资源,也为圆叶葡萄营养品性分析、品质调控和农艺学措施改良提供理论依据。
1 材料与方法
1.1 材料与试剂
圆叶葡萄(红色‘Noble’和白色‘Carlos’)及对照真葡萄(红色‘赤霞珠’和白色‘雷司令’)于2013年和2014年连续两年采收于广西农业科学院葡萄与葡萄酒研究所明阳双季葡萄基地。‘Noble’和‘Carlos’从幼果期(盛花期后第21天)开始采样,每两周1 次至转色,转色后每一周1 次至完熟,共采收9 次;‘赤霞珠’和‘雷司令’在幼果期、转色期和完熟期3 个时期采样,共采收3 次。种子经手工分离,预冷处理,真空冷冻48 h,-80 ℃保存备用。此外,种子被分离时,记录分离前后及冷冻干燥前后质量差异,以确定种子干质量占鲜质量的百分比,结果以鲜质量表示。
乙腈和甲醇(均为色谱纯) 美国Thermo Fisher公司;甲酸(色谱纯) 美国VWR公司;标准品鞣花酸、没食子酸、槲皮素、山柰酚、杨梅酮、芦丁、表儿茶素和咖啡酸(均为色谱纯) 美国Sigma-Aldrich公司;五-O-没食子酰葡萄糖、白藜芦醇(均为色谱纯)北京索莱宝科技有限公司。超纯水使用德国Merck微孔协同水净化系统获得。其他试剂均为国产分析纯。
1.2 仪器与设备
Triple TOF 4600 MS/MS型液相色谱-质谱联用仪(Eksigent ultra LC 110液相系统,Duospray离子源和质谱自动校准系统) 美国AB SCIEX公司;LGJ-18冷冻干燥机 北京四环科技仪器有限公司;Milli-Q Advantage A10型微孔协同水净化系统 德国Merck集团;RE-52旋转蒸发仪 上海亚荣生化仪器厂;FW-135中草药粉碎机(30~200 目) 天津泰斯特有限公司;HMQLVORTEX-5旋涡混合仪 海门市其林贝尔仪器制造有限公司;SB-5200超声波清洗机 宁波新芝生物科技有限公司;Allegra X-30R离心机 美国Beckman Coulter公司;-80 ℃超低温冰箱 美国Thermo Fisher公司。
1.3 方法
1.3.1 提取预处理
对冻干后的葡萄种子,参考文献[15,21-22]的方法进行脱脂处理。葡萄种子冻干后,经粉碎机粉粹,按料液比1∶20(g/mL)加入石油醚,室温条件下避光浸提12 h,分离上清液,重复2 次,将残渣平铺于培养皿上,避光蒸去石油醚。加入砂浆,液氮磨细,过60 目筛(0.25 mm),-80 ℃保存。
1.3.2 圆叶葡萄多酚的提取
圆叶葡萄种子中多酚提取参考文献[15,21-22]的方法。称取0.500 0 g葡萄种子(已脱脂)干样于50 mL离心管中,按料液比1∶30(g/mL)加入丙酮提取液(丙酮-水-盐酸,70∶29∶1,V/V),旋涡30 s,置于超声波清洗机中,25 ℃、616 W条件下超声提取28 min,7 600 r/min离心20 min,残渣重复提取2 次,合并上清液,35 ℃真空旋蒸除去溶剂,色谱纯甲醇(含1%甲酸)定容至5 mL,-80 ℃保存。样品先经0.22 μm纤维素膜过滤,再上超高效液相色谱-串联三重四极杆飞行时间质谱(ultra performance liquid chromatography tandem triple quadrupole time-of-flight mass spectrometry,UPLC Triple TOF-MS/MS)检测。所有提取及检测均平行测定3 次。
1.3.3 UPLC-Triple TOF-MS/MS的测定
UPLC-Triple TOF-MS/MS分析条件参考文献[12]的方法。
色谱条件:ZORBAX SB-C18窄径柱(2.1 mm×150 mm,5 µm);柱温35 ℃;流动相A为0.5%甲酸溶液,流动相B为乙腈。洗脱梯度:0~1 min,5% B;1~20 min,5%~60% B;20~21 min,60%~95% B;21~30 min,柱子冲洗平衡。流速300 μL/min,进样量10 μL。
质谱条件:离子源载气1和2(空气)压力55 psi;幕帘气(氮气)压力30 psi;离子源温度550 ℃;离子源喷雾电压-4.5 kV;碰撞能量(-40±10)eV;质量扫描范围100~2 000 Da。
1.3.4 定性及定量分析
定性及定量分析参考文献[12]的方法。
定性分析:使用Peak View 2.0和Marker View 1.2.1软件进行离线自建多酚数据库及在线Chemspider、Mass Bank和Phenol-Explorer三大数据库检索、比对。通过总离子流图、保留时间、精确分子质量、Triple TOF MS/MS同位素峰及特征碎片离子信息确认多酚化合物组成。
定量分析:使用Multi Quant 3.0软件进行定量分析。鞣花酸、五-O-没食子酰葡萄糖、没食子酸、表儿茶素、槲皮素、山柰酚、杨梅酮、咖啡酸、芦丁和白藜芦醇分别使用各自标准品定量,其他鞣花酸及前体物、黄烷-3-醇、黄酮醇、羟基苯甲酸、羟基肉桂酸和芪类分别以没食子酸当量(gallic acid equivalent,GAE)、(-)表儿茶素当量((-)-epicatechin equivalent,EE)、芦丁当量(rutin equivalent,RE)、GAE、咖啡酸当量(caffeic acid equivalent,CAE)和白藜芦醇当量(resveratrol equivalent,REE)定量。样品运行时每隔5 h运行一次质谱自动校准,每天重新制作标准曲线(线性范围0~5、0~10 mg/L或5~50 mg/L,R2≥0.999)。
1.4 数据处理
2 结果与分析
圆叶葡萄中主要多酚化合物前期已有报道,但其多酚组成尚未被完全阐明,在不同报道中亦有较大差异[1,10-11,14,23]。整体上来说,圆叶葡萄中多酚根据其结构被分为不同的类别,从简单的酚酸(羟基苯甲酸和羟基肉桂酸)到复杂的单宁(水解和缩合单宁)[10]。在2 个圆叶葡萄‘Noble’和‘Carlos’及2 个真葡萄‘赤霞珠’和‘雷司令’发育期的种子中共检测到106 种多酚化合物,包括48 种鞣花酸及前体物、24 种黄酮醇、20 种羟基苯甲酸、9 种黄烷-3-醇、3 种芪类和2 种羟基肉桂酸[24]。
2.1 圆叶葡萄种子发育过程中鞣花酸及前体物组分分析
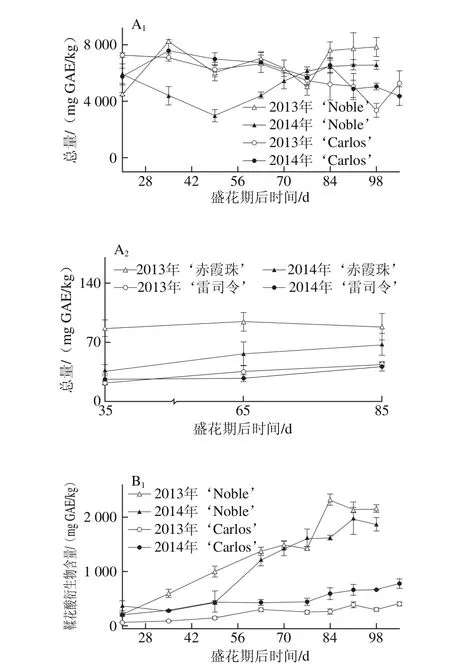
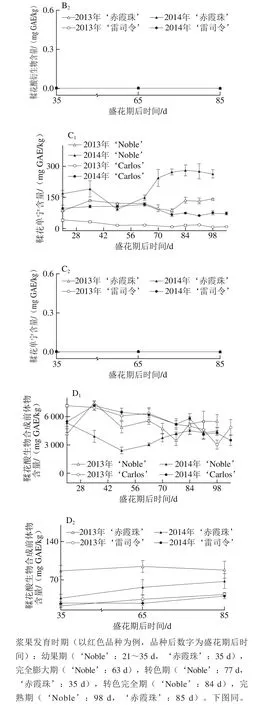
图1 圆叶葡萄种子发育过程中总量(A)和各类别(B~D)鞣花酸及前体物分布Fig. 1 Total ellagic acids (A) and different categories (B-D) of ellagic acids and distribution of their precursors in muscadine seeds during berry development
鞣花酸及前体物是圆叶葡萄种子中最丰富的多酚类别,在2 个品种发育期样品中共检测到48 种,包括13 种鞣花酸衍生物,22 种鞣花单宁和13 种鞣花酸生物合成前体物。而在真葡萄中未检测到鞣花酸类化合物,仅检测到5 种鞣花酸生物合成前体物[24],与前期研究所认为的鞣花酸类化合物为圆叶葡萄中特有多酚,非圆叶葡萄果实中不含鞣花酸类化合物相一致[1,3,11,14,23]。如图1所示,与真葡萄相比,圆叶葡萄种子中鞣花酸及前体物含量更高[25-26],其在2013年‘Noble’和‘赤霞珠’中分别为4 518.55~7 835.90 mg GAE/kg和86.53~94.05 mg GAE/kg,前者平均是后者的74.8 倍(图1A)。此外,其含量具有显著的年份差异,如红色‘Noble’和‘赤霞珠’中的鞣花酸及前体物在2013年显著高于2014年,而在白色‘Carlos’和‘雷司令’中则在两年间无显著性差异。

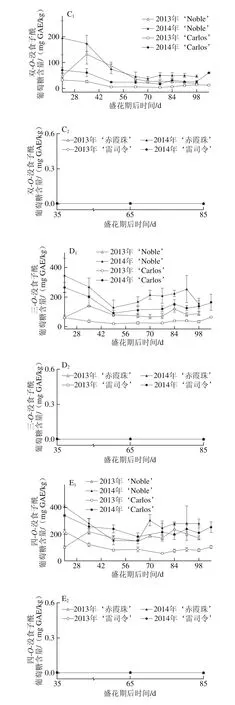
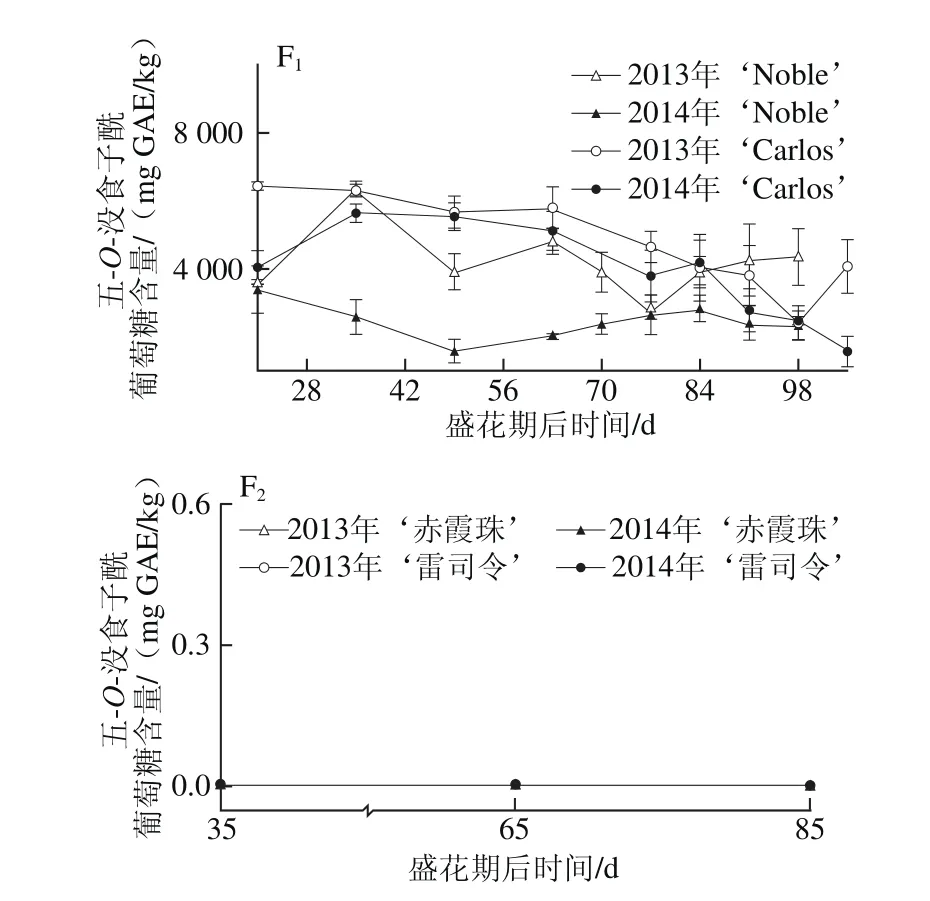
图2 圆叶葡萄种子发育过程中总量(A)和5 种(B~F)没食子酰葡萄糖分布Fig. 2 Distribution profiles of total (A) galloyl-glucoses and five categories(B-F) of galloyl-glucoses in muscadine seeds during berry development
就组成类别分析,圆叶葡萄种子中鞣花酸生物合成前体物最为丰富,如在2014年‘Carlos’中达到3 524.67~7 183.30 mg GAE/kg,占鞣花酸及前体物总量的80.6%~94.8%,而鞣花酸类化合物所占比例相对较低,如鞣花酸衍生物和鞣花单宁分别占3.7%~17.8%和1.2%~1.7%(图1B~D),与前期研究相一致[12]。五-O-没食子酰葡萄糖是圆叶葡萄中最主要的鞣花酸生物合成前体物,其次为没食子酸甲酯、没食子酸和四-O-没食子酰葡萄糖;而真葡萄中检测到的少量鞣花酸生物合成前体物,主要是没食子酸和没食子酸甲酯[24]。同时,圆叶葡萄种子中检测到5 种没食子酰葡萄糖(从单-到五-O-)的积累,且随着没食子酰数目的增多,相应的没食子酰葡萄糖含量显著增加,只有少数例外,如图2所示。Pastrana-Bonilla等[1]发现种植于美国佐治亚州南部的10 个圆叶葡萄种子中没食子酸含量平均为69 mg/kg,本实验测定含量均比其高,可能是因为品种、地区和生长发育期的共同影响。另外,在不同年份间,两圆叶葡萄种子中鞣花酸生物合成前体物和五-O-没食子酰葡萄糖平均含量均在2013年大于2014年,而没食子酸和没食子酸甲酯则与之相反,在2013年小于2014年;真葡萄‘赤霞珠’中的鞣花酸生物合成前体物、没食子酸和没食子酸甲酯在2013年大于2014年,而在‘雷司令’中两年间无显著性差异。
多酚化合物的组成和浓度既受遗传因素影响,在不同成熟期也表现出明显的差异[17]。前人研究认为,种子中鞣花酸生物合成前体物在浆果发育期显著增加,转色以后逐渐降低[20,27]。本研究发现,鞣花酸及前体物含量在不同色泽圆叶葡萄发育期种子中有较大差异,如在红色‘Noble’幼果期较高,随后至转色期逐渐下降,完全转色后再次上升,并至果实完熟无显著性差异;而白色‘Carlos’则从幼果期到完全膨大期无显著性差异,随后至果实完熟略有下降,两年的规律相同(图1A)。就鞣花酸及前体物组成来说,两圆叶葡萄种子中的鞣花酸生物合成前体物、5 种没食子酰葡萄糖总量及五-O-没食子酰葡萄糖均与其鞣花酸及前体物的变化趋势相同,而两年的鞣花酸衍生物和2014年‘Noble’的鞣花单宁含量则随着浆果成熟显著增加,至果实完熟时达到最高(图1B~D、图2)。同时,两真葡萄种子中的鞣花酸生物合成前体物亦随着浆果发育显著上升,2013年‘赤霞珠’是个例外,其在浆果发育过程中无显著性差异。
2.2 圆叶葡萄种子发育过程中黄烷-3-醇组分分析
黄烷-3-醇是圆叶葡萄种子中第二大丰富的多酚化合物,尤其是在白色品种中,如图3所示。在2014年‘Carlos’中达到661.73~6 237.34 mg EE/kg;而黄烷-3-醇却是真葡萄种子中含量最丰富的多酚,亦在白色品种中含量更高,如在2013年‘雷司令’中为605.63~827.49 mg EE/kg,但仅为‘Carlos’中的7.2%(图3A)。这与Narduzzi等[26]的发现不同,其认为白色真葡萄中由于B环没有3′,4′,5′-取代黄酮醇而无法积累黄烷-3-醇,而红色品种则可以积累黄烷-3-醇,进而认为在黄烷-3-醇积累上,色泽差异远大于品种。就年份来说,圆叶葡萄种子中的黄烷-3-醇在两年间无显著性差异,而真葡萄则在2014年显著低于2013年。此外,圆叶葡萄种子中的黄烷-3-醇,从幼果期开始显著增加,在转色期时达到最高,随后至果实完熟时显著下降;真葡萄‘雷司令’在2013年的变化情况与圆叶葡萄相似,2014年不受发育期的影响,而‘赤霞珠’则分别在2013年幼果期和2014年果实完熟时含量最高。
真葡萄中的黄烷-3-醇,包括单体,也包括聚合体(二聚体和三聚体)[26],其在果皮和种子中的显著差异在于种子中的黄烷-3-醇平均聚合度更低(<8),同时含有较高的没食子酰化体[28-30]。在2 个品种圆叶葡萄种子中共检测到9种黄烷-3-醇,包括3 种没食子酰化体、3 种二聚体、1 种单体、1 种糖基化体和1 种三聚体;而在2 个真葡萄中共检测到8 种,比圆叶葡萄少1 种二聚体[24]。在这些类别中,圆叶葡萄以单体为主,其次为没食子酰化体,如在2014年‘Noble’中平均分别占总黄烷-3-醇含量的50.5%和40.1%,而真葡萄中主要是没食子酰化体,其次为单体(图3B~F)。另外,糖基化体未在红色‘Noble’中检测到,三聚体仅在白色品种中检测到,包括‘Carlos’和‘雷司令’。就年份来说,圆叶葡萄中的没食子酰化体和二聚体在2014年显著大于2013年,而在真葡萄中则2014年显著小于2013年,同时,‘赤霞珠’中的单体也在2014年小于2013年。此外,在果实发育过程中,除2013年‘Carlos’种子中糖基化体在果实完熟时含量显著最高外,圆叶葡萄中其他类别黄烷-3-醇与总黄烷-3-醇的变化情况类似,均在转色时含量最高。
就个体黄烷-3-醇而言,真葡萄种子中只存在原花青素类(亚基为儿茶素和表儿茶素)[28-30]。本研究发现圆叶葡萄种子中的黄烷-3-醇同时包括原花青素和原花翠素类(亚基为表没食子儿茶素),其中表儿茶酸最为丰富,其次为表儿茶酰-3-O-没食子酸和4-甲基-表没食子儿茶素没食子酸酯[24]。Pastrana-Bonilla等[1]发现美国佐治亚州南部地区成熟的圆叶葡萄‘Carlos’种子中的表儿茶素含量为11 892 mg/kg mf,而在广西南宁地区两年平均为2 831.20 mg/kg mf,表明其含量具有显著的地区差异。
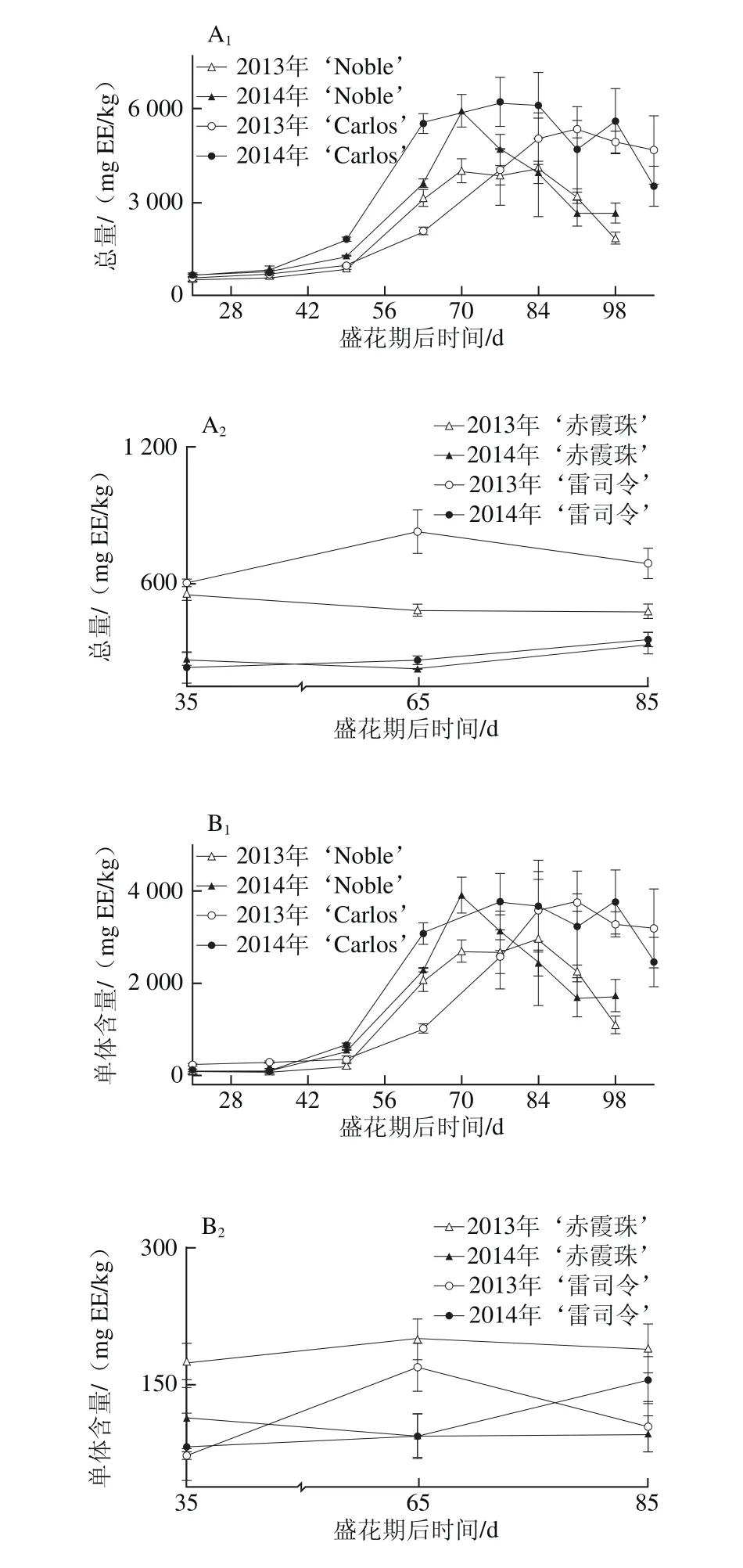
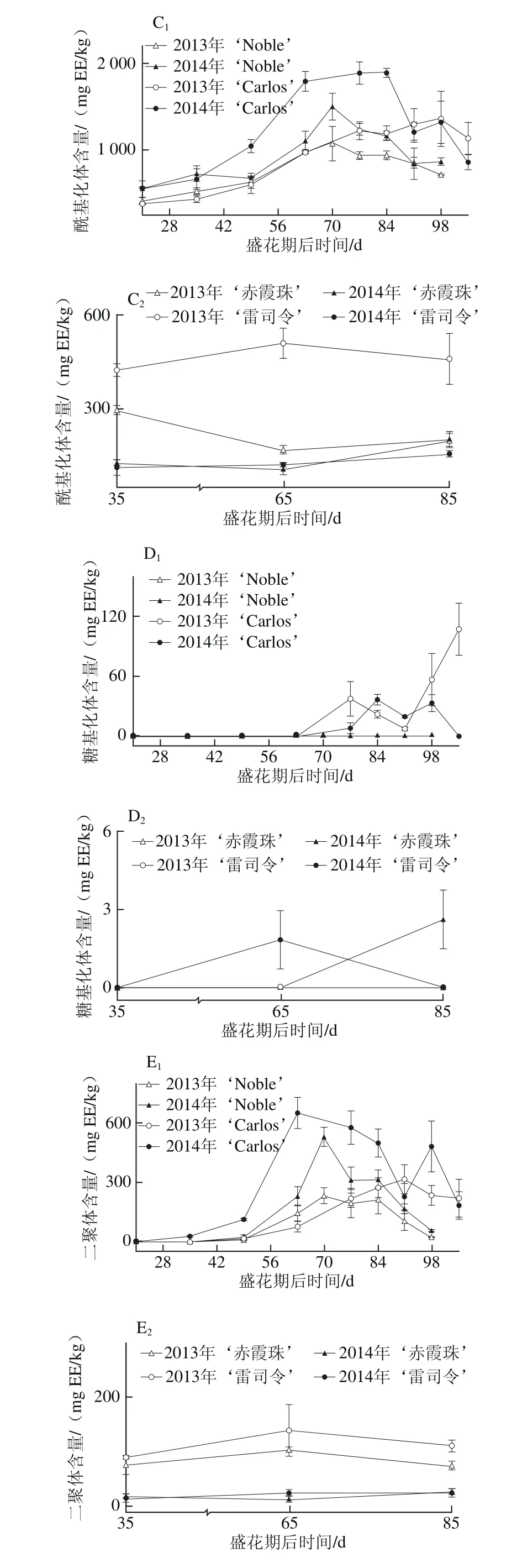
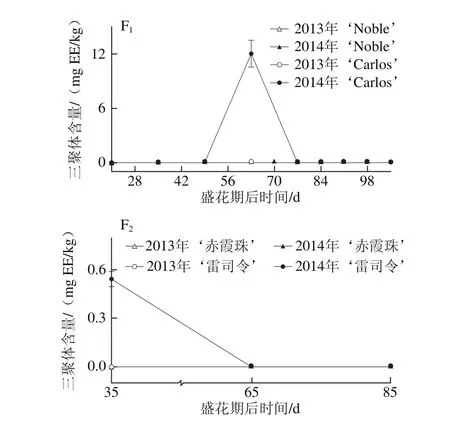
图3 圆叶葡萄种子发育过程中总(A)和各类别(B~F)黄烷-3-醇分布Fig. 3 Distribution profiles of total flavan-3-ols (A) and different categories(B-F) of flavan-3-ols in muscadine seeds during berry development
2.3 圆叶葡萄种子发育过程中黄酮醇组分分析
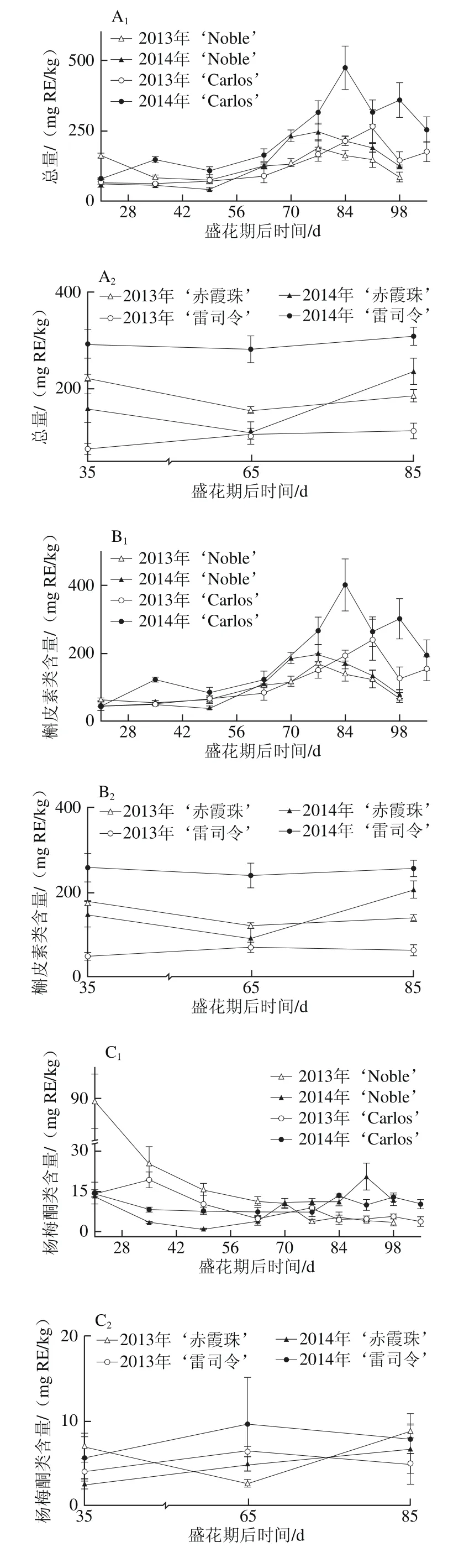
黄酮醇如槲皮素、山柰酚和杨梅酮主要存在于圆叶葡萄果皮中[3,31],但其含量与真葡萄相比较低[12,23,32]。如图4所示,黄酮醇亦存在于圆叶葡萄种子中,但其含量与真葡萄种子相比无显著性差异,如图4A所示。同时,其含量表现出明显的品种和年份差异性,如在白色品种‘Carlos’中2014年(81.12~473.40 mg RE/kg)显著高于2013年(67.91~265.15 mg RE/kg),‘雷司令’的变化情况与‘Carlos’相同,而两红色品种则在两年间无显著性差异。在浆果发育过程中,圆叶葡萄种子中的黄酮醇含量在幼果期较低,完全膨大后显著上升,转色完全时达到最高,随后至果实完熟显著下降;真葡萄中则在果实完熟时含量最高(2013年‘赤霞珠’除外)。
在圆叶葡萄中检测到23 种黄酮醇,有8 种槲皮素类、6 种杨梅酮类、6 种山柰酚类、2 种异鼠李素类和1 种丁香亭衍生物;真葡萄中共检测到21 种,缺少1 种杨梅酮类(双脱氢杨梅酮-3-O-鼠李糖苷)和1 种山柰酚衍生物(山柰酚-乙酰基-己糖苷)。槲皮素衍生物(主要是槲皮素-3-O-半乳糖苷和双脱氢槲皮素)均是圆叶葡萄和真葡萄种子中含量最丰富的类型,其在浆果发育过程中的变化与各自黄酮醇变化趋势相同(图4B~F)。其次,圆叶葡萄中为杨梅酮衍生物,且除2013年‘Noble’在幼果期显著较高外,在其他发育期均无显著性差异;而真葡萄中为山柰酚衍生物,且随着浆果成熟含量显著上升(2013年‘赤霞珠’除外)。此外,两圆叶葡萄中杨梅酮衍生物在2013年幼果期显著高于2014年,而山柰酚和异鼠李素衍生物则在2013年转色至完熟时显著低于2014年。
2.4 圆叶葡萄种子发育过程中羟基苯甲酸组分分析
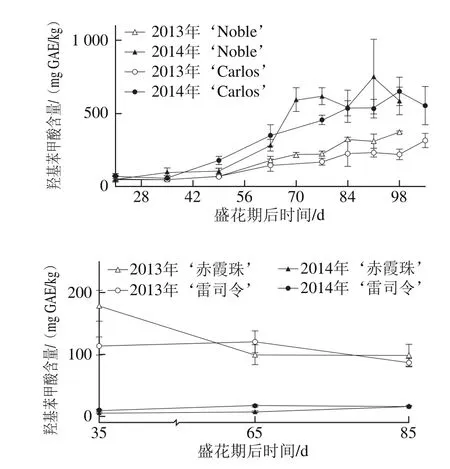
图5 圆叶葡萄种子发育过程中羟基苯甲酸分布Fig. 5 Distribution profiles of hydroxy benzoic acid in muscadine seeds during berry development
如图5所示,圆叶葡萄种子中的羟基苯甲酸含量显著高于其在真葡萄中的含量,如在2014年‘Noble’和‘赤霞珠’种子中分别为50.70~618.08 mg GAE/kg和7.16~17.48 mg GAE/kg。同时,羟基苯甲酸含量具有显著的年份差异,如在圆叶葡萄中2014年显著高于2013年,而真葡萄中则刚好相反。就羟基苯甲酸组成来说,短叶苏木酚酸和双羟基苯甲酸是圆叶葡萄种子中最主要的类型,而真葡萄种子中则主要为双和单羟基苯甲酸[24]。此外,圆叶葡萄种子中的羟基苯甲酸在幼果期较低,浆果膨大后显著升高,两年的变化情况相同。真葡萄在2014年的变化情况与圆叶葡萄相同,而在2013年则主要积累在幼果期。
2.5 圆叶葡萄种子发育过程中羟基肉桂酸组分分析
圆叶葡萄种子中的羟基肉桂酸含量较低,且主要积累在圆叶葡萄的幼果期,如图6所示。在2014年盛花期第21天的‘Noble’和‘Carlos’中分别为3.48 mg CAE/kg和5.31 mg CAE/kg,而2013年更低,在两品种中分别为1.89 mg CAE/kg和0 mg CAE/kg。此外,其在2014年转色期前也有一定的积累,如在盛花期第70天时的‘Noble’和第77天时的‘Carlos’中含量分别为0.62 mg CAE/kg和2.15 mg CAE/kg。菊苣酸和对-香豆酰-4-O-葡萄糖是圆叶葡萄中仅有的类型,而在2 个真葡萄品种中均未检测到[24]。
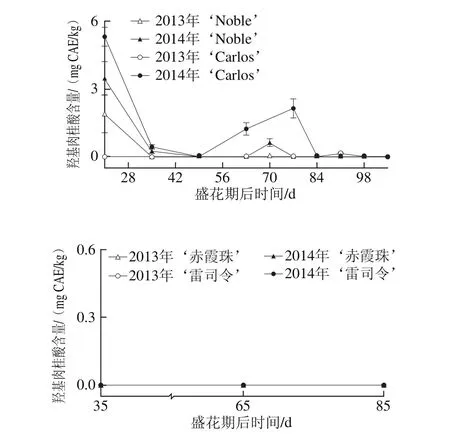
图6 圆叶葡萄种子发育过程中羟基肉桂酸分布Fig. 6 Distribution profiles of hydroxy cinnamic acid in muscadine seeds during berry development
2.6 圆叶葡萄种子发育过程中芪类组分分析
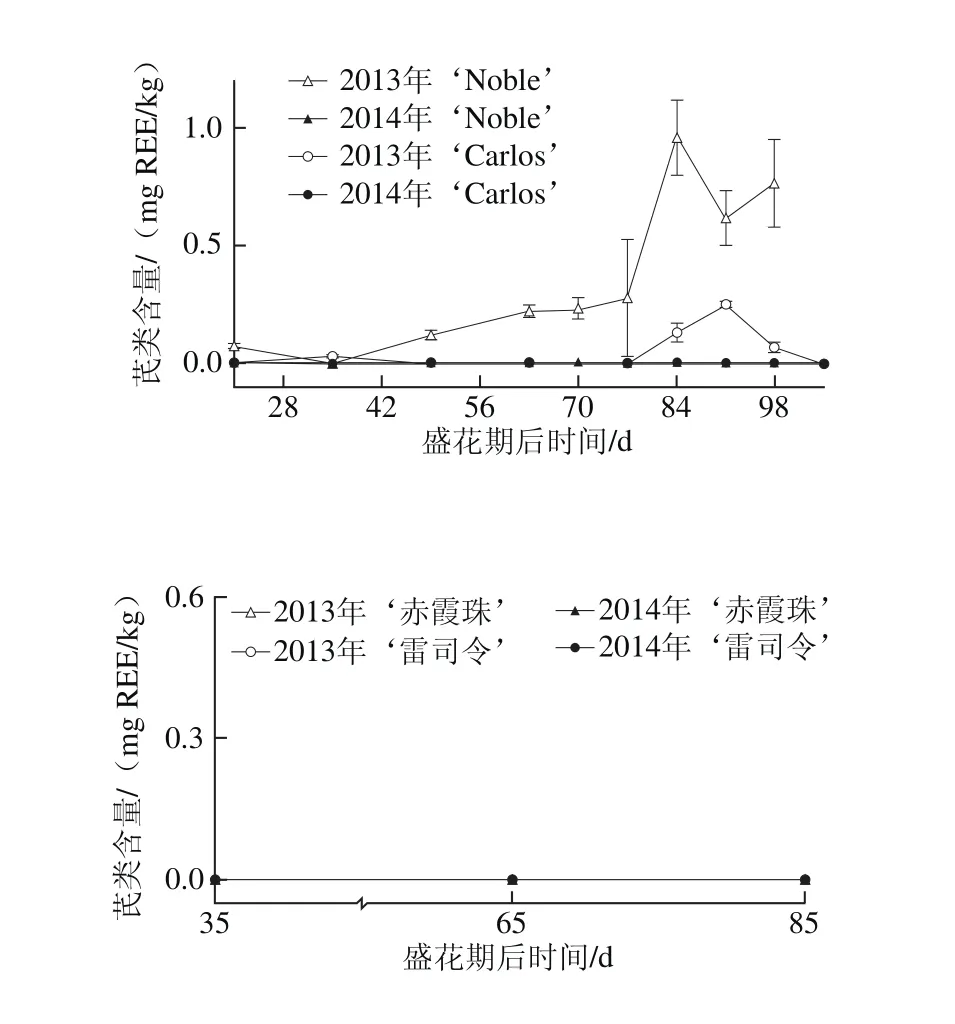
图7 圆叶葡萄种子发育过程中芪类分布Fig. 7 Distribution profiles of stilbene in muscadine seeds during berry development
如图7所示,痕量和少量的芪类化合物仅在2013年圆叶葡萄种子中检测到,其在‘Noble’和‘Carlos’中的含量分别为0~0.77 mg REE/kg和0~0.25 mg REE/kg。白藜芦醇是种子中最主要的类型[24]。另外,2013年‘Noble’中的芪类化合物,随着果实发育含量显著增加。而在真葡萄种子中,未检测到芪类化合物的积累。
3 结 论
本研究以栽培于广西南宁地区的2 个圆叶葡萄‘Noble’和‘Carlos’和2 个真葡萄‘赤霞珠’和‘雷司令’为实验材料,分析了圆叶葡萄种子发育过程中多酚类化合物的组成和积累规律。
在4 个葡萄品种发育期的种子样品中共检测到106 种多酚,包括48 种鞣花酸及前体物、24 种黄酮醇、20 种羟基苯甲酸、9 种黄烷-3-醇、3 种芪类和2 种羟基肉桂酸。
鞣花酸及前体物(主要是前体物)和黄烷-3-醇(主要是没食子酰化体和单体)分别是圆叶葡萄和真葡萄种子中最主要的多酚类型,但在不同年份和不同品种间具有较大差异。
前体物在圆叶葡萄‘Noble’幼果期种子较高,然后逐渐下降,完全转色后再次上升,‘Carlos’在转色前种子中较高,随后略有下降。黄烷-3-醇在真葡萄‘雷司令’种子中2013年随着浆果发育显著升高,转色时含量达到最高,随后有所下降,2014年不受发育期的影响;‘赤霞珠’则分别在2013年幼果期和2014年果实完熟时种子中含量最高。
[1] PASTRANA-BONILLA E, AKOH C C, SELLAPPAN S, et al.Phenolic content and antioxidant capacity of muscadine grapes[J].Journal of Agricultural and Food Chemistry, 2003, 51(18): 5497-5503.DOI:10.1021/jf030113c.
[2] CONNER P J. Characteristics of promising muscadine grape (Vitis rotundifolia Michx.) selections from the university of Georgia(USA) breeding program[C]. In Proceedings of the X International Conference on Grapevine Breeding and Genetics, 2014, 1046: 303-307. DOI:10.17660/ActaHortic.2014.1046.41.
[3] MARSHALL D A, STRINGER S J, SPIERS J D. Stilbene, ellagic acid, flavonol, and phenolic content of muscadine grape (Vitis rotundifolia Michx.) cultivars[J]. Pharmaceutical Crops, 2012, 3(1):69-77. DOI:10.2174/2210290601203010069.
[4] XU C M, YAGIZ Y, HSU W, et al. Antioxidant, antibacterial, and antibiofilm properties of polyphenols from muscadine grape (Vitis rotundifolia Michx.) pomace against selected foodborne pathogens[J].Journal of Agricultural and Food Chemistry, 2014, 62(28): 6640-6649.DOI:10.1021/jf501073q.
[5] XU C M, YAGIZ Y, MARSHALL S, et al. Application of muscadine grape (Vitis rotundifolia) pomace extract to reduce carcinogenic acrylamide[J]. Food Chemistry, 2015, 182: 200-208. DOI:10.1016/j.foodchem.2015.02.133.
[6] YU Y, JIAO L, FU S F, et al. Callose synthase family genes involved in the grapevine defense response to downy mildew disease[J]. Phytopathology,2016, 106(1): 56-64. DOI:10.1094/PHYTO-07-15-0166-R.
[7] 黄羽, 彭宏祥, 林玲, 等. 四个鲜食加工兼用型圆叶葡萄品种在广西引种栽培初报[J]. 广西农学报, 2010, 25(3): 20-22. DOI:10.3969/j.issn.1003-4374.2010.03.007.
[8] 周咏梅, 黄羽, 林玲, 等. 4 个圆叶葡萄品种的果实品质比较分析[J]. 南方农业学报, 2015, 46(6): 1063-1066. DOI:10.3969/J:issn.2095-1191.2015.6.1063.
[9] KOOL M M, COMESKEY D J, COONEY J M, et al. Structural identification of the main ellagitannins of a boysenberry (Rubus loganbaccus × baileyanus Britt.) extract by LC-ESI-MS/MS, MALDITOF-MS and NMR spectroscopy[J]. Food Chemistry, 2010, 119(4):1535-1543. DOI:10.1016/j.foodchem.2009.09.039.
[10] SANDHU A K, GU L W. Antioxidant capacity, phenolic content, and profiling of phenolic compounds in the seeds, skin, and pulp of Vitis rotundifolia (muscadine grapes) as determined by HPLC-DAD-ESIMSn[J]. Journal of Agricultural and Food Chemistry, 2010, 58(8):4681-4692. DOI:10.1021/jf904211q.
[11] LEE J, JOHNSON J V, TALCOTT S T. Identification of ellagic acid conjugates and other polyphenolics in muscadine grapes by HPLCESI-MS[J]. Journal of Agricultural and Food Chemistry, 2005, 53(15):6003-6010. DOI:10.1021/jf050468r.
[12] WEI Z, LUO J M, HUANG Y, et al. Profile of polyphenol compounds of five muscadine grapes cultivated in the United States and in newly adapted locations in China[J]. International Journal of Molecular Sciences, 2017, 18(3): 631. DOI:10.3390/ijms18030631.
[13] BROWN J C, JIANG X P. Activities of muscadine grape skin and polyphenolic constituents against Helicobacter pylori[J]. Journal of Applied Microbiology, 2013, 114(4): 982-991. DOI:10.1111/jam.12129.
[14] MARSHALL-SHAW D A, STRINGER S J, SAMPSON B J, et al.Storage retention of stilbene, ellagic acid, flavonol, and phenolic content of muscadine grape (Vitis rotundifolia Michx.) cultivars[J].Journal of Food Chemistry and Nutrition, 2014, 2(2): 81-92.
[15] 魏征, 赵雅娇, 黄羽, 等. 响应面试验优化超声波辅助提取圆叶葡萄鞣花酸和总酚工艺[J]. 食品科学, 2015, 36(12): 29-35. DOI:10.7506/spkx1002-6630-201512006.
[16] BINDON K A, MADANI S H, PENDLETON P, et al. Factors affecting skin tannin extractability in ripening grapes[J]. Journal of Agricultural and Food Chemistry, 2004, 62(5): 1130-1141.DOI:10.1021/jf4050606.
[17] YANG B R, LIU P Z. Composition and biological activities of hydrolyzable tannins of fruits of phyllanthus emblica[J]. Journal of Agricultural and Food Chemistry, 2014, 62(3): 529-541. DOI:10.1021/jf404703k.
[18] 毕鹤琼. 酿酒葡萄成熟过程中果皮非花色苷酚的组成及变化分析[D].北京: 中国农业大学, 2010: 13-30.
[19] LEE J, TALCOTT S T. Fruit maturity and juice extraction influences ellagic acid derivatives and other antioxidant polyphenolics in muscadine grapes[J]. Journal of Agricultural and Food Chemistry,2004, 52(2): 361-366. DOI:10.1021/jf034971k.
[20] MBELE A, BASHA S M, MUSINGO M. Changes in phenolics content and antioxidant activity of muscadine grape cultivars during berry development and ripening[J]. International Journal of Fruit Science, 2008, 8(4): 304-317. DOI:10.1080/15538360802597598.
[21] XU C M, ZHANG Y L, ZHU L, et al. Influence of growing season on phenolic compounds and antioxidant properties of grape berries from vines grown in subtropical climate[J]. Journal of Agricultural and Food Chemistry, 2011, 59(4): 1078-1086. DOI:10.1021/jf104157z.
[22] ZHU L, ZHANG Y L, LU J. Phenolic contents and compositions in skins of red wine grape cultivars among various genetic backgrounds and originations[J]. International Journal of Molecular Sciences, 2012,13: 3492-3510. DOI:10.3390/ ijms13033492.
[23] YOU Q, CHEN F, WANG X, et al. Analysis of phenolic composition of Noble Muscadine (Vitis rotundifolia) by HPLC-MS and the relationship to its antioxidant capacity[J]. Journal of Food Science,2012, 77(10): C1115-C1123. DOI:10.1111/j.1750-3841.2012.02888.x.
[24] 魏征. 圆叶葡萄多酚积累特性分析[D]. 北京: 中国农业大学, 2017:53-81.
[25] KOPONEN J M, HAPPONEN A M, MATTILA P H, et al. Contents of anthocyanins and ellagitannins in selected foods consumed in Finland[J]. Journal of Agricultural and Food Chemistry, 2007, 55:1612-1619. DOI:10.1021/jf062897a.
[26] NARDUZZI L, STANSTRUP J, MATTIVI F. Comparing wild American grapes with Vitis vinifera: a metabolomics study of grape composition[J]. Journal of Agricultural and Food Chemistry, 2015,63(30): 6823-6834. DOI:10.1021/acs.jafc.5b01999.
[27] YILMAZ Y, TOLEDO R T. Major flavonoids in grape seeds and skins: antioxidant capacity of catechin, epicatechin, and gallic acid[J].Journal of Agricultural and Food Chemistry, 2004, 52(2): 255-260.DOI:10.1021/jf030117h.
[28] COSME F, RICARDO-DA-SILVA J M, LAUREANO O. Tannin profiles of Vitis vinifera L. cv. red grapes growing in Lisbon and from their monovarietal wines[J]. Food Chemistry, 2009, 112(1): 197-204.DOI:10.1016/j.foodchem.2008.05.058.
[29] MATTIVI F, VRHOVSEK U, MASUERO D, et al. Differences in the amount and structure of extractable skin and seed tannins amongst red grape varieties[J]. Australian Journal of Grape and Wine Research,2009, 15(1): 27-35. DOI:10.1111/j.1755-0238.2008.00027.x.
[30] LORRAIN B, CHIRA K, TEISSEDRE P. Phenolic composition of Merlot and Cabernet-Sauvignon grapes from Bordeaux vineyard for the 2009-vintage: comparison to 2006, 2007 and 2008 vintages[J].Food Chemistry, 2011, 126(4): 1991-1999. DOI:10.1016/j.foodchem.2010.12.062.
[31] TALCOTT S T, LEE J. Ellagic acid and flavonoid antioxidant content of muscadine wine and juice[J]. Journal of Agricultural and Food Chemistry, 2002, 50: 3186-3192. DOI:10.1021/jf011500u.
[32] URCAN D E, LUNG M, GIACOSA S, et al. Phenolic substances,flavor compounds, and textural properties of three native Romanian wine grape varieties[J]. International Journal of Food Properties, 2016,19: 76-98. DOI:10.1080/10942912.2015.1019626.

