miRNA-21调控胃癌细胞增殖及侵袭的机制
耿 威 仉慧颖 李 林 陈 岩 邱一凡
(大庆油田总医院消化内科,黑龙江 大庆 163001)
胃癌的发生发展是一个多基因、多因素参与的过程,包括原癌基因的激活、抑癌基因的失活等〔1〕。可通过与靶基因结合调控细胞的增殖、凋亡、分化、个体发育等过程,其异常表达与多种肿瘤的发生及发展相关〔2〕。其中miRNA-21在食管癌、乳腺癌、肺癌等多种实体肿瘤中呈现过表达,参与肿瘤的生长、转移、侵袭等过程,在肿瘤的发生及发展过程中有重要作用〔3,4〕。本研究通过RNA干扰(RNAi)技术沉默胃癌细胞中miRNA-21的表达,研究其对细胞增殖及侵袭的影响及机制。
1 材料与方法
1.1一般资料 人胃癌SGC-7901细胞购自中国科学院细胞库。主要试剂和仪器:胎牛血清购自杭州四季青生物工程有限公司;胰蛋白酶、RPMI1640培养基均购自美国Gibco公司;siRNA和基质金属蛋白酶(MMP-2)、MMP-9、Notch1、Hes1抗体均购自美国Santa Cruz公司;细胞裂解液购自大连宝生物工程有限公司;二喹啉甲酸(BCA)试剂盒、细胞增殖与活性检测试剂盒(CCK8)均购自碧云天生物技术研究所;Transwell小室购自美国Millipore公司;酶标仪购自Bio-Rad公司;倒置显微镜购自日本OLYMPUS;二氧化碳(CO2)细胞培养箱购自德国Heraus公司。
1.2细胞培养及转染 人胃癌SGC-7901细胞在含有10%胎牛血清的RPMI1640细胞培养液中,置于37℃、5% CO2培养箱中培养2~3 d后,用0.25%的胰蛋白酶消化后根据实验需要传代。取对数生长期的细胞用于实验研究。转染前2 d以2×104个/孔的浓度将对数生长期的SGC-7901细胞接种至6孔细胞培养板中,细胞生长密度达到90%以上时进行转染。转染分为正常对照组、转染siRNA Control的阴性对照组和转染siRNA miRNA-21基因的沉默组。整个转染过程严格按照Invitrogen 公司的脂质体LipofectamineTM2000方法进行操作。
1.3转染效果检测 取转染48 h后的细胞,RNA提取试剂盒提取细胞中的总RNA,逆转录试剂盒将总RNA反转录为cDNA,用Oligo6.0软件设计目的基因miRNA-21及内参基因U6的RT-PCR引物。送由上海生工合成。引物序列上游引物:5'-TGCGGTAGCTTATCAGACTGATG-3',下游引物:5'-CCAGTGCAGG-GTCCGAGGT-3'。按照试剂盒说明设置反应体系及参数,进行荧光定量RT-PCR检测。
1.4细胞增殖检测 以1×106个/孔浓度将转染后的各组细胞接种至96孔细胞培养板中,每组设置6个复孔,置于37℃、5% CO2、95%饱和湿度的恒温培养箱中培养。48 h后收集细胞。每孔细胞中加入CCK8试剂10 μl,37℃反应2 h,酶标仪测定A570 nm的吸光度(A570)。细胞增殖率=(转染组细胞A/对照组细胞A)×100%。
1.5细胞侵袭能力检测 Transwell侵袭小室铺Matrigel胶,取转染后的各组细胞,0.25%的胰蛋白酶消化后制成单细胞悬液,用含有100 ml/L胎牛血清的RPMI1640细胞培养基重悬细胞,以每毫升含有5×104个细胞接种于Transwell小室的上室中,Transwell小室的下室中加入500 μl含有100 ml/L胎牛血清的RPMI1640细胞培养基,置于37℃、5% CO2培养箱中培养,48 h后收集细胞。用棉签轻轻擦掉上层的Transwell胶,95%的酒精固定15 min,染色,倒置显微镜下观察,随机取10个不同的视野(×200)进行穿透细胞计数,试验重复3次,计算侵袭细胞的平均数。
1.6MMP-2、MMP-9、Notch1、Hes1蛋白表达检测 取转染48 h的各组细胞,加入细胞裂解液提取细胞中的总蛋白。取少量蛋白样品BCA法检测蛋白的浓度。配置12%的分离胶和5%的浓缩胶。取蛋白样品与上样缓冲液按照5∶1的比例充分混匀后,100℃变性5 min。取100 μg蛋白样品进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),电泳结束后转印蛋白至聚偏氟乙烯(PVDF)膜上,置于4℃的封闭液中封闭过夜,加入一抗,4℃孵育过夜,加入1∶1 000稀释的辣根过氧化物酶标记的羊抗鼠IgG作为二抗,室温置于摇床上孵育1 h,TBST洗膜5次,每次5 min,洗膜后进行显影和定影。以甘油醛-3-磷酸脱氢酶(GAPDH)作为内参,分析MMP-2、MMP-9、Notch1、Hes1蛋白表达水平。
1.7统计学方法 应用SPSS21.0软件进行单因素方差分析、t检验。
2 结 果
2.1转染siRNA后SGC-7901细胞中miRNA-21 mRNA表达 转染siRNA后正常对照组(1.000)和阴性转染组(0.991±0.010)miRNA-21 mRNA表达差异无统计学意义(P>0.05),沉默组(0.432±0.032)显著低于正常对照组(P<0.01)。
2.2沉默miRNA-21的表达降低SGC-7901细胞增殖 转染siRNA后沉默组细胞存活率(57.43%±6.98%)显著低于正常对照组(100.00%)和转染阴性组(97.18%±3.12%,P<0.01)。
2.3沉默miRNA-21的表达降低SGC-7901细胞侵袭能力 siRNA转染48 h后,沉默组细胞侵袭数〔(91.65±13.21)个〕显著低于正常对照组和转染阴性组〔(159.65±15.87)个、(158.88±15.12)个,P<0.01〕。
2.4沉默miRNA-21的表达对MMP-2、MMP-9、Notch1、Hes1蛋白表达的影响 siRNA转染48 h后,与正常对照组(0.255±0.036,0.159±0.029,0.511±0.018,0.268±0.029)及转染阴性组(0.551±0.038,0.156±0.030,0.508±0.047,0.270±0.026)比较,沉默组MMP-2、MMP-9、Notch1、Hes1蛋白表达(0.143±0.027,0.058±0.014,0.174±0.028,0.165±0.017)均显著下调(P<0.01)。见图1。
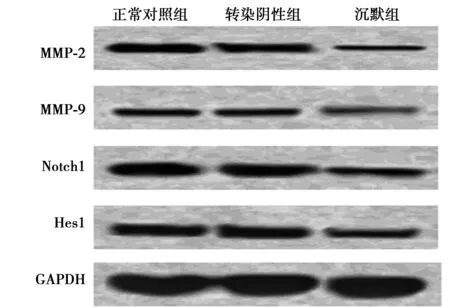
图1 Western印迹检测沉默miRNA-21表达对MMP-2、MMP-9、Notch1、Hes1蛋白表达的影响
3 讨 论
胃癌的发生是一个多因素多阶段的过程,涉及癌基因的活化、抑癌基因的失活、基因启动子的异常转录活化、细胞周期调控失常、表观遗传学等多个方面。有研究显示miRNA对多种癌细胞的增殖、凋亡、侵袭、迁移等过程有重要的调节功能〔5〕。miRNA-21对消化系统、心血管系统、呼吸系统等有调节功能,参与多种肿瘤的血管生成、增殖、迁移、抗药形成等〔6〕。研究显示,抑制肺癌、食管癌等肿瘤细胞中miRNA-21的表达,可降低癌细胞的增殖及促进细胞凋亡〔7〕。
RNAi是由双链RNA介导的能使基因在转录后发生沉默的现象,具有高度的特异性、有效性,是研究基因功能的有效方法〔8〕。本研究通过RNAi技术沉默miRNA-21的表达,结果显示细胞的增殖及侵袭能力均显著降低。肿瘤的侵袭是一个多步骤、多环节的复杂过程,受到多种因素的影响,而MMPs表达改变,尤其是MMP-2和MMP-9表达升高,可通过使基底膜中的Ⅳ型胶原蛋白酶降解,进而增强癌细胞的转移及侵袭能力〔9〕。研究显示,肺腺癌、宫颈癌等肿瘤中MMP-2和MMP-9的表达升高可使肿瘤对细胞外基质(ECM)降解的能力增加,最终导致细胞的转移和侵袭〔10〕。
Notch1信号通路是一条高度保守的信号转导途径,在多种器官和组织的早期发育过程中,其家族成员对调控细胞的发育、凋亡、分化等过程有重要作用。由受体和配体及DNA结合蛋白组成。哺乳动物有Notch1、Notch2、Notch3、Notch4 4个同源的Notch受体,Notch1是主要的受体〔11〕。大量研究显示,Notch1在各种肿瘤中有致癌作用,胃癌、胰腺癌等肿瘤中下调Notch1信号通路可降低癌细胞生长及侵袭能力〔12〕。Hes1是Notch1信号通路的一个重要靶基因,是Notch1信号通路激活的标志。本研究结果显示,胃癌细胞中沉默miRNA-21的表达可通过抑制Notch1信号通路降低细胞的增殖及侵袭能力,为胃癌的分子诊断及靶向治疗提供了一定的理论基础。
1Hess LM,Michael D,Mytelka DS,etal.Chemotherapy treatment patterns,costs,and outcomes of patients with gastric cancer in the United States:a retrospective analysis of electronic medical record(EMR) and administrative claims data〔J〕.Gastric Cancer,2016;19(2):607-15.
2Singh N,Shankar J,Srivastava A,etal.PUB127 role of microRNAs and proteostasis system in diesel exhaust particle induced lung toxicity〔J〕.J Thorac Oncol,2017;12(1):S1520-1.
3Sun L,Dong S,Dong C,etal.Predictive value of plasma miRNA-718 for esophageal squamous cell carcinoma〔J〕.Cancer Biomark,2016;16(2):265-73.
4Wu ZH,Tao ZH,Zhang J,etal.MiRNA-21 induces epithelial to mesenchymal transition and gemcitabine resistance via the PTEN/AKT pathway in breast cancer〔J〕.Tumor Biol,2016;37(6):7245-54.
5Valli AA,Santos BA,Hnatova S,etal.Most microRNAs in the single-cell alga Chlamydomonas reinhardtii are produced by Dicer-like 3-mediated cleavage of introns and untranslated regions of coding RNAs〔J〕.Genome Res,2016;26(4):519-29.
6Qu K,Lin T,Pang Q,etal.Extracellular miRNA-21 as a novel biomarker in glioma:Evidence from meta-analysis,clinical validation and experimental investigations〔J〕.Oncotarget,2016;7(23):33994-4010.
7Zhang M,Xu Q,Yan S,etal.Suppression of forkhead box Q1 by microRNA-506 represses the proliferation and epithelial-mesenchymal transition of cervical cancer cells〔J〕.Oncol Rep,2016;35(5):3106-14.
8叶丽平,马静方,仇会会.RNA 干扰 cAMP 反应元件结合蛋白对碱性成纤维细胞生长因子诱导的人卵巢癌细胞 Bcl-2 表达的影响〔J〕.中国老年学杂志,2017;37(2):280-2.
9Her Z,Kam YW,Gan VC,etal.Severity of plasma leakage is associated with high levels of interferon γ-inducible protein 10,hepatocyte growth factor,matrix metalloproteinase 2(MMP-2),and MMP-9 during dengue virus infection〔J〕.J Infect Dis,2017;215(1):42-51.
10Yu J,Xie Q,Zhou H,etal.Survivin,MMP-2,and MMP-9 expression in different types of cervical lesions and correlation analysis〔J〕.Int J Clin Exp Pathol,2016;9(5):5445-51.
11Feng S,Yang Y,Lv J,etal.Valproic acid exhibits different cell growth arrest effect in three HPV-positive/negative cervical cancer cells and possibly via inducing Notch1 cleavage and E6 downregulation〔J〕.Int J Oncol,2016;49(1):422-30.
12Konishi H,Asano N,Imatani A,etal.Notch1 directly induced CD133 expression in human diffuse type gastric cancers〔J〕.Oncotarget,2016;7(35):56598-607.

