网素蛋白1和增强绿色荧光蛋白基因共表达慢病毒载体构建和鉴定及在结直肠癌细胞SW480中表达
何 佳 邓峰美 林友胜 刘漪沦
(成都医学院生物医学系,四川 成都 610500)
网素蛋白(PLS)1是Plastin1是一种肌动蛋白成束蛋白,可与纤维状肌动蛋白结合,使纤维状肌动蛋白相互交联形成紧密的网状结构,在稳定细胞肌动蛋白骨架及调节细胞运动等方面有重要作用。PLS家族主要贡献于细胞肌动蛋白骨架的相关功能,PLS1在支撑小肠微绒毛的特异性结构中有重要作用〔1〕;小鼠体内PLS1缺失会导致小肠微绒毛发育的不完全;在耳毛细胞的形成和发育过程中起关键作用〔2〕;在肾细胞中也有特殊作用〔3〕;肿瘤细胞增殖、迁移、侵袭等都与细胞肌动蛋白骨架有密切关系,PLS1在结直肠癌细胞系中异常表达,可能与肿瘤细胞迁移有密切关系〔4〕。本研究将人全长PLS1基因克隆到慢病毒质粒pEZ-Lv201上,构建重组慢病毒表达载体pEZ-PLS1并观察其在人大肠癌细胞株SW480中表达。
1 材料和方法
1.1质粒、菌株和细胞 慢病毒表达质粒pEZ-Lv201(pEZ-SV40-eGFP-IRES-Puro)为本实验室保存。大肠杆菌DH5α感受态细胞购于北京全式金生物技术公司。人大肠癌细胞株SW480、人胚肾细胞株293T和非小细胞肺癌细胞株H1299均购于中科院上海细胞库。
1.2主要酶和试剂 慢病毒包装质粒试剂盒(复能基因);Taq酶、RT试剂盒(Takara);限制性内切酶ApaI、EcoRI、T4 DNA ligase (NEB);1 000 bp DNA ladder marker(天根公司);dNTP(Promega);Plasmid抽提Kit(Qiagen);Lipofectamine2000(Invitrogen);胰酶(上海化学试剂公司);RPMI1640、DMEM培养基、胎牛血清(Hyclone);兔抗PLS1一抗(Abcam);兔抗小鼠eGFP一抗、小鼠抗β-actin,小鼠抗GAPDH一抗(proteintech);羊抗兔IgG二抗、羊抗小鼠IgG二抗(中杉金桥);引物合成及测序由上海英骏生物技术有限公司完成。
1.3PLS1基因的克隆 依据GenBank的PLS1基因的编码区(CDS)设计相应引物,根据载体质粒pEZ-Lv201的要求在引物中引入EcoRI和ApaI酶切位点。正义:CGGGATCCTAAACTGTGAGGCATAC;反义:CCAAGCTTATAAAGACCTGAAGATAGT(划线部分为酶切位点),PLS1基因提取于人正常大肠组织,PCR扩增,反应条件:预变性94℃、3 min,变性94℃、30 s,退火55℃、30s,延伸72℃、1 min,30个循环,72℃延伸5 min。经1%琼脂糖凝胶电泳检测,与Genebank提供的条带大小897 bp相符,胶回收产物保存待用。
1.4重组慢病毒载体的构建、鉴定和纯化 慢病毒质粒pEZ-Lv201和目的片段分别经EcoRI和ApaI双酶切消化,用T4 DNA连接酶连接,形成含增强绿色荧光蛋白(EGFP)基因的克隆重组体。将连接产物转化感受态细胞DH5α,扩增培养后用EcoRI和ApaI双酶切鉴定,并测序鉴定插入DNA片段的正确性。
1.5重组慢病毒的包装和滴度测定 ①包装:重组慢病毒表达载体质粒pEZ-PLS1、慢病毒包装质粒复合体Lenti-Pac HIV mix与转染试剂DNA-EndoFectin complex混合后转染293T细胞。48 h后收集病毒上清,4℃下800 r/min离心10 min弃去细胞碎片,上清液用0.45 μm聚醚砜低蛋白质链接过滤器过滤收集病毒颗粒,浓缩后分装10 μl/EP管,-70℃保存。②滴度测定:24孔板接种H1299细胞2×105/孔,37℃、5%CO2孵箱中培养至细胞50%融合。慢病毒液分别以0.5、1.0、2.0、10.0、30.0 μl感染H1299细胞,72 h后荧光显微镜下计数EGFP阳性细胞数以计算病毒滴度(病毒滴度=EGFP阳性细胞率×细胞总数/慢病毒液体积×慢病毒液稀释倍数)(TU/ml)。为避免误差,只选择EGFP阳性细胞率为1%~30%的孔,取各组平均值计算滴度。
1.6转染大肠癌细胞株SW480及其表达情况鉴定 24孔板接种SW480细胞1×105/孔,24 h后加入预先混好的感染复数(MOI)=10的重组慢病毒完全培养液2 ml,37℃、5%CO2孵箱中孵育12 h后换正常培养基继续培养,72 h后在荧光显微镜观察细胞转染情况,并用Western印迹检测PLS1表达情况。
2 结 果
2.1重组慢病毒载体pEZ-SV40-PLS1-eGFP-IRES-Puro的构建和鉴定 PLS1基因编码区DNA片段经PCR扩增后,1%琼脂糖凝胶电泳中可见897 bp特异性条带,与理论值一致。PLS1的PCR产物纯化后与载体pEZ-lv201进行酶切,连接,转化后,得到数十个克隆,挑取3个单克隆摇菌,菌落PCR鉴定,结果显示4个克隆(克隆1,2,3)可扩增出2 100 bp的目的片段(图1)。经测序鉴定与Genbank提供的序列一致,未发生任何突变,重组载体pEZ-PLS1构建成功。
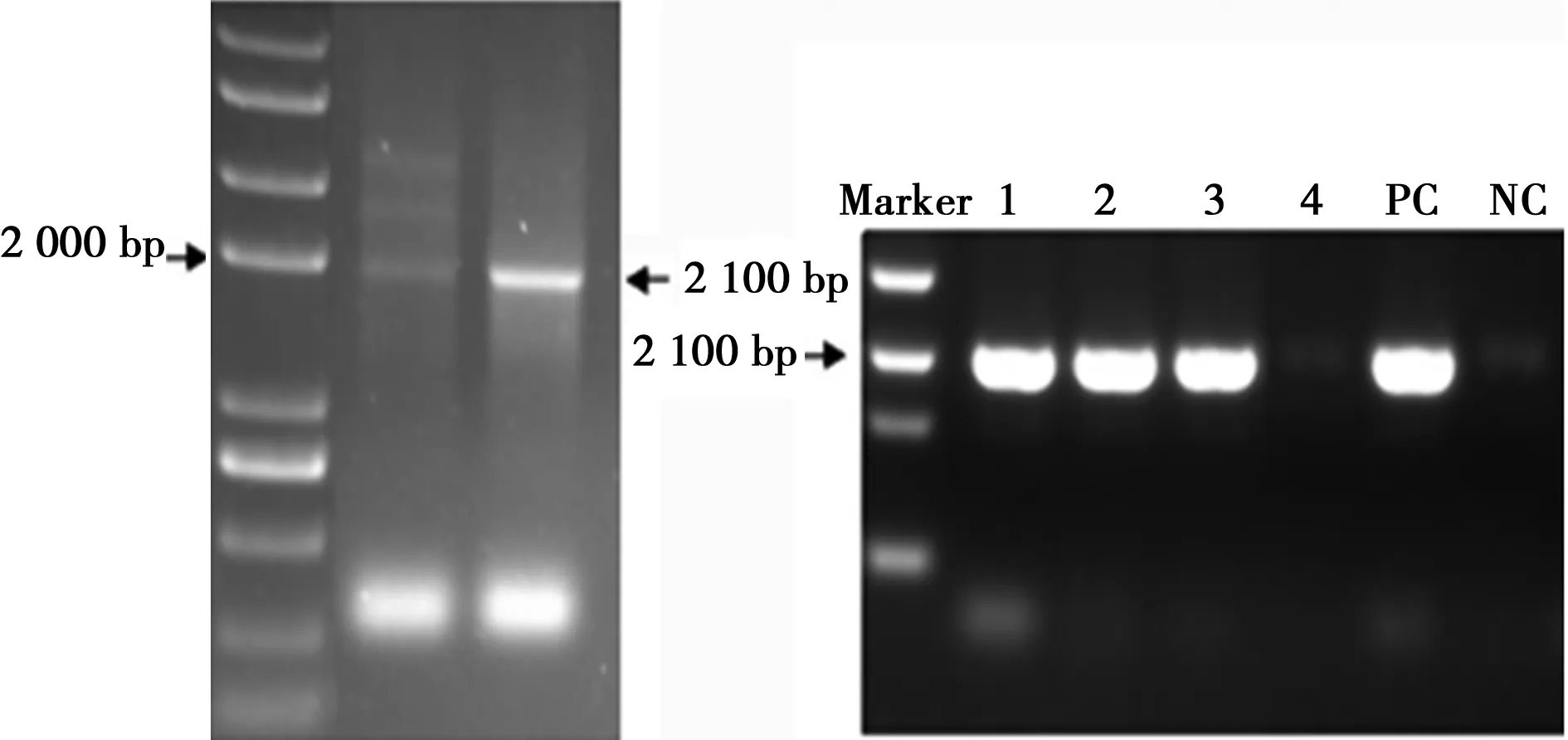
1、2、3阳性克隆,4阴性克隆,PC阳性对照,NC阴性对照图1 PLS1基因与构建的重组慢病毒载体的鉴定
2.2重组慢病毒包装与病毒滴度测定 慢病毒包装试剂盒Lenti-PacTMHIV Expression Packaging Kit包装慢病毒载体pEZ-PLS1及其对照pEZ-eGFP后荧光显微镜下观察(图2A、B)。包装后的慢病毒转染H1299细胞后(图2C、D、E),测定慢病毒滴度约为2.1×109copies/ml,空载对照慢病毒浓缩后的病毒滴度约为7.9×1010copies/ml。
2.3重组慢病毒感染SW480细胞 重组慢病毒pEZ-PLS1以MOI为10感染SW480细胞,感染72 h后荧光显微镜下观察绿色荧光,感染效率达90%以上(图3)。
2.4Western印迹检测SW480细胞中PLS1的表达 重组慢病毒感染SW480细胞,72 h后收集细胞沉淀,提取细胞总蛋白,72 kD左右有一条特异性条带,其大小和PLS1预测条带相符合,说明包装产生的高滴度pEZ-PLS1重组慢病毒感染细胞能稳定表达PLS1蛋白(图4)。

A:白光下的293T细胞;B:荧光显微镜下的293T细胞;C(1、2):0.1 μl;D(1、2):1.0 μl;E(1、2):10.0 μl图2 重组慢病毒包装与不同浓度慢病毒载体pEz-SV40-EGFP-IRES-Puro感染H1299细胞(×200)

图3 荧光显微镜下慢病毒pEZ-PLS1感染后的SW480细胞(×200)

图4 Western印迹检测病毒感染SW480细胞后PLS1的表达
3 讨 论
PLS1最早在鸡肠细胞中发现,是PLS家族的成员之一,其相对分子质量大约70 000,由629个氨基酸残基组成,基因定位于3q23,主要与actin结合〔5,6〕,分子N端无磷酸化位点和核输出信号序列〔7〕。在人小肠中I-plastin与villin、espin小剪接体、class I myosins和ezrin等肌动蛋白结合蛋白共同作用,将肌动蛋白纤丝交联成紧密的束状结构,支持着微绒毛的特殊形态和结构稳定〔3〕。肠上皮细胞形成的这种微绒毛结构间接地增加了细胞的膜表面积,从而在结构上满足了细胞需要大量吸收营养物质的特殊生理功能〔8〕。研究发现,在小鼠耳蜗毛细胞的形成过程中I-plastin在稳定毛细胞的形态结构上也有重要作用〔2〕。PLS家族中PLS2在免疫细胞中〔9〕和乳腺癌、黑色素瘤、前列腺癌、结直肠癌等多种肿瘤细胞中都有不同程度的表达上调,且与肿瘤细胞的迁移侵袭及肿瘤分期等密切相关〔10~12〕。研究发现PLS3在神经细胞中表达,主要协助纤维状肌动蛋白的成束而促进轴突生成〔13,14〕,在皮肤T细胞淋巴瘤中通过抑制细胞的凋亡来促进肿瘤发展〔15〕,在肝癌和子宫癌中PLS3的下调可增强细胞对DNA损伤的敏感性而诱发细胞程序性凋亡〔16〕。
目前已发现PLS1在肝癌、乳腺癌、胃癌、大肠癌〔17~19〕等恶性肿瘤中表达异常。大肠癌是世界上常见的高危害消化道恶性肿瘤之一,发病率和死亡率均位居前列〔20〕。细胞外基质环境的变化是大肠肿瘤发生的重要原因之一。慢病毒载体是目前一种应用较多的目的基因重组的重要工具,其具有容纳外源性目的基因片段大,体内表达稳定,免疫反应小和安全性较好等优点〔21〕。重组的慢病毒载体可以感染非分裂细胞、分裂细胞及多种组织。此外,pEZ-Lv201慢病毒载体属于“自杀”性慢病毒,不会利用宿主细胞形成新的病毒颗粒,病毒感染目的细胞后不会再感染其他细胞,已成为当前重组基因研究的最佳选择。
本研究成功构建了PLS1重组慢病毒表达载体pEZ-PLS1;通过病毒包装、收集和浓缩,得到高滴度慢病毒颗粒。感染大肠腺癌细胞系SW80后,荧光显微镜下观察到90%以上细胞发出绿色荧光,Western印迹检测SW480在实验组中表达明显高于对照。
1Grimm-Günter E-MS,Revenu C,Ramos S,etal.Plastin 1 binds to keratin and is required for terminal Web assembly in the intestinal epithelium〔J〕.Mol Biol Cell,2009;20(10):2549-62.
2Taylor R,Bullen A,Johnson SL,etal.Absence of plastin 1 causes abnormal maintenance of hair cell stereocilia and a moderate form of hearing loss in mice〔J〕.Human Molecular Genetics,2015;24(1):37-49.
3Brown JW,Mcknight CJ.Molecular Model of the Microvillar Cytoskeleton and Organization of the Brush Border〔J〕.PLoS One,2010;5(2):e9406.
4霍永旭,张彤彤,苏小娟,等.Plastin在肿瘤中的研究进展〔J〕.生命的化学,2015;(3):413-7.
5Morley SC.The actin-bundling protein L-plastin supports T-cell motility and activation〔J〕.Immunol Rev,2013;256(1):48-62.
6Lin CS,Lau A,Lue TF.Analysis and mapping of plastin phosphorylation〔J〕.DNA Cell Biol,1998;17(12):1041-6.
7Delanote V,Vandekerckhove JL,Gettemans J.Plastins:versatile modulators of actin organization in (patho)physiological cellular processes〔J〕.Acta Pharmacol Sinica,2005;26(7):769-79.
8Revenu C,Ubelmann F,Hurbain I,etal.A new role for the architecture of microvillar actin bundles in apical retention of membrane proteins〔J〕.Mol Biol Cell,2012;23(2):324-36.
9Todd EM,Deady LE,Celeste MS.Intrinsic T-and B-cell defects impair T-cell-dependent antibody responses in mice lacking the actin-bundling protein L-plastin〔J〕.Eur J Immunol,2013;43(7):1735-44.
10Eilis F,Peter MW,Dermot K,etal.The leukocyte protein L-plastin induces proliferation,invasion and loss of E-cadherin expression in colon cancer cells〔J〕.Int J Cancer,2006;118(8):2098-104.
11Riplinger SM,Wabnitz GH,Kirchgessner H,etal.Metastasis of prostate cancer and melanoma cells in a preclinical in vivo mouse model is enhanced by L-plastin expression and phosphorylation〔J〕.Mol Cancer,2014;13(1):546.
12Samstag Y,Klemke M.Ectopic expression of L-plastin in human tumor cells:diagnostic and therapeutic implications〔J〕.Adv Enzyme Regul,2007;47(1):118-26.
13Lyon AN,Pineda RH,Le Thi H,etal.Calcium binding is essential for plastin 3 function in Smn-deficient motoneurons〔J〕.Hum Mol Genet,2014;23(8):1990-2004.
14Nishio H.PLS3 expression and SMA phenotype:a commentary on correlation of PLS3 expression with disease severity in children with spinal muscular atrophy〔J〕.J Hum Genet,2014;59(1):64-5.
15Bégué E,Jean-Louis F,Bagot M,etal.Inducible expression and pathophysiologic functions of T-plastin in cutaneous T-cell lymphoma〔J〕.Blood,2012;120(1):143-54.
16Ikeda H,Sasaki Y,Kobayashi T,etal.The role of T-fimbrin in the response to DNA damage:silencing of T-fimbrin by small interfering RNA sensitizes human liver cancer cells to DNA-damaging agents〔J〕.Int J Oncol,2005;27(4):933-40.
17潘秀华,陈晓慧,李晓青,等.骨诱导因子 mRNA 表达与乳腺癌发生和转移的关系〔J〕.天津医科大学学报,2008;14(2):203-6.
18Wang Y,Ma Y,Lü B,etal.Differential expression of mimecan and thioredoxin domain-containing protein 5 in colorectal adenoma and cancer:a proteomic study〔J〕.Exp Biol Med,2007;232(9):1152-9.
19Lee JY,Eom EM,Kim DS,etal.Analysis of gene expression profiles of gastric normal and cancer tissues by SAGE〔J〕.Genomics,2003;82(1):78-85.
20Jemal A,Bray F,Center MM,etal.Global cancer statistics〔J〕.CA:Cancer J Clin,2011;61(2):69-90.
21Cockrell AS,Kafri T.Gene delivery by lentivirus vectors〔J〕.Molecular biotechnology,2007;36(3):184-204.

