鼠神经生长因子对原发性闭角型青光眼小梁切除术后视神经的保护作用及安全性
张建峰,张 恒,王立肖
青光眼是一种表现为视野缺损、视神经萎缩为主要特征的进展性退化疾病,也是引起致盲的主要疾病[1],其主要是通过损害视野及视神经致盲。目前对于视神经损害的原因尚未完全阐明,可能与神经毒素产生、低血流灌注引起缺血、缺氧、高眼压、炎性反应等有关[2-3]。目前临床注重眼压对视神经的损害,主要通过手术或药物降低眼压,其中小梁切除术是最主要的手术方式,可有效控制眼压[4]。但是研究发现尽管通过一系列措施控制眼压后,仍会发生视野的损伤,最终发展为失明[5]。故对于青光眼视神经的保护已成为临床关注的热点。鼠神经生长因子是一种神经细胞生长调节因子,具有促进神经元生长、发育、分化、再生的作用,在视神经炎、视网膜脱离、视网膜损伤等眼科疾病中逐渐应用[6-7]。本研究通过探讨鼠神经生长因子对原发性闭角型青光眼小梁切除术后视神经的保护作用及安全性,旨在为青光眼治疗提供理论依据。现报告如下。
1 材料与方法
1.1病例选择标准 纳入标准:①均经眼科辅助检查确诊为原发性闭角型青光眼,符合小梁切除术手术治疗指征;②无合并其他眼部疾病者。排除标准:①高度近视者;②存在认知、阅读及听写障碍者;③属于恶性青光眼或合并脉络膜脱离、前房出血等术后严重并发症者;④术后眼压波动较大者。
1.2临床资料 对宝鸡市人民医院眼科2015年1月—2017年6月收治的择期行小梁切除术治疗的原发性闭角型青光眼86例的临床资料进行回顾性分析,根据治疗方式分为观察组和对照组,每组43例。观察组男20例,女23例,年龄48~75(52.89±4.56)岁,均为单眼发病,其中左眼24例,右眼19例。对照组男19例,女24例,年龄48~75(52.89±4.56)岁,均为单眼发病,其中左眼25例,右眼18例。两组性别、年龄等方面比较差异无统计学意义(P>0.05),具有可比性。
1.3方法 均在术前给予药物将眼压降为正常。将0.75%布比卡因和2%利多卡因等量混合进行球周麻醉后,均由同一组副主任医师及以上级别医师操作常规行穿透性小梁切除术。观察组术后给予鼠神经生长因子(生物制药股份有限公司,国药准字S20060023)20 μg与2 ml注射用水混合液臀大肌注射,1/d。对照组给予甲钴胺片(扬子江药业集团南京海陵药业有限公司,国药准字H20052325)0.5 mg口服,3/d。两组均治疗1个月。
1.4观察指标
1.4.1视力检查:通过国际标准对数视力表对所有患者手术前后及治疗后1个月复查最佳视力进行记录,视力经LogMAR转换后进行统计。
1.4.2眼压检测:应用日本SHIN-NIPPON NCT-200非接触式眼压计对患者手术前后及治疗后1个月眼压进行检测,每天在不同时间段检测3次,取平均值。
1.4.3视野检查:通过北京科思佳科技有限责任公司生产的K508682型全自动视野计对患者手术前后及治疗后1个月平均视敏度值(MS)、平均缺损值(MD)进行检测。所有患者在瞳孔放松、暗室条件下选取中心30度的视野范围、标准模式进行检测。对于测试结果可信度<80%,假阳性率>33%,固视丢失率>20%者再次检测,选取符合标准的结果。
1.4.4电生理检查:应用国特GT2000NV视觉电生理检测仪对治疗前、治疗后1个月对P100波潜伏期和波幅等电生理参数进行检测。
1.4.5生化指标检测:分别于手术前后、治疗后1个月清晨抽取静脉血,2500 r/min,高速离心约10 min,留取上清液,放入冷藏室待测。通过放射免疫法对内皮素-1(ET-1)进行检测,一氧化氮(NO)通过硝酸还原酶法进行检测。
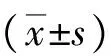
2 结果
2.1视力和眼压 两组手术前后及治疗后1个月视力和眼压比较差异无统计学意义(P>0.05)。观察组应用鼠神经生长因子治疗1个月后视力高于手术后(P<0.05);对照组应用鼠神经生长因子治疗后1个月复查视力与手术后比较差异无统计学意义(P>0.05)。两组手术后及治疗后1个月眼压与手术前比较差异均无统计学意义(P>0.05)。见表1。
2.2视野MS、MD 两组手术前后及治疗后1个月MS、MD比较差异无统计学意义(P>0.05)。两组手术后及治疗后1个月复查MS均高于手术前,治疗1个月后MS高于手术后,且观察组高于对照组(P<0.05,P<0.01)。观察组手术后及治疗后1个月复查MD均低于手术前,且治疗后1个月复查MD低于手术后,且观察组低于对照组(P<0.05,P<0.01),对照组手术后及治疗后1个月复查MD与手术前比较差异无统计学意义(P>0.05)。见表2。
2.3P100振幅及潜伏期 两组手术前P100振幅及潜伏期比较差异均无统计学意义(P>0.05)。两组手术后及治疗后1个月复查P100振幅均高于手术前,且观察组高于对照组(P<0.05,P<0.01);两组治疗后1个月复查P100振幅与手术后比较差异无统计学意义(P>0.05)。两组手术后及治疗后1个月复查P100潜伏期均低于手术前,且治疗1个月后低于手术后,观察组低于对照组(P<0.05,P<0.01)。见表3。
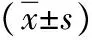
表1 两组原发性闭角型青光眼治疗前后视力和眼压比较
注:两组均给予小梁切除术,观察组术后给予鼠神经生长因子,对照组给予甲钴胺口服;与手术后比较,aP<0.05
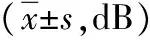
表2 两组原发性闭角型青光眼治疗前后视野比较
注:两组均给予小梁切除术,观察组术后给予鼠神经生长因子,对照组给予甲钴胺口服;与手术前比较,aP<0.05;与手术后比较,cP<0.05
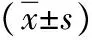
表3 两组原发性闭角型青光眼治疗前后P100振幅和潜伏期比较
注:两组均给予小梁切除术,观察组术后给予鼠神经生长因子,对照组术后给予甲钴胺口服;与治疗前比较,aP<0.05,与手术后比较,cP>0.05
2.4ET-1、NO水平 两组手术前ET-1、NO水平比较差异无统计学意义(P>0.05)。两组手术后及治疗后1个月ET-1水平均低于手术前,NO水平高于手术前,且观察组改善程度优于对照组(P<0.05,P<0.01)。见表4。
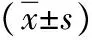
表4 两组原发性闭角型青光眼治疗前后内皮素-1和一氧化氮水平比较
注:两组均给予小梁切除术,观察组术后给予鼠神经生长因子,对照组术后给予甲钴胺口服;与手术前比较,aP<0.05
2.5不良反应发生情况 两组均未发生严重不良反应,观察组有3例注射部位出现红、痛,经热敷或一段时间内自行缓解。
3 讨论
目前临床主要公认为机械学说、血流学说是引起青光眼发病的主要机制[8],其中机械学说主张高眼压是引起青光眼发生的主要因素,当眼压升高时,可对视神经纤维造成挤压,最终引起细胞代谢受损发生死亡[9-10]。研究报道,轴浆阻滞、高眼压和特定的视野缺损存在密切关系,眼压持续升高在青光眼发生过程中有重要意义,故认为降眼压是治疗青光眼的重要步骤[11]。但是随着研究的深入,学者们发现有部分眼压高出正常者,但未发生青光眼视野缺损和视神经损害,也有少部分出现青光眼视野缺损和视神经损害的患者但是眼压属于正常范围及通过手术或药物控制眼压正常者,也会发生视神经损害或视野缺损,可表明机械学说不能包括青光眼所有发病机制[12-13]。血流学说主张视神经的血流异常是引起视神经损害的重要原因,很多研究证实,视网膜缺血可引起视网膜神经节细胞发生原位死亡,而视网膜缺血主要由于视神经乳头局部灌注不足或眼压升高导致[14]。有学者发现原发性开角型青光眼患者视神经表层血流显著少于正常眼压性青光眼患者,其红细胞黏度较高,最大频移可降低40%,可见青光眼患者伴有视神经微循环受累[15-16]。不同的致病机制可能引起视野缺损的不同,但是被证实神经节细胞的损伤是其视神经损害的共同病理基础[17]。
ET-1主要由中枢神经系统内皮细胞所分泌,在ET中约占1/4。ET-1具有收缩血管,调节脑血流的作用[18],其收缩血管强度的作用是神经肽Y、血管加压素、血管紧张素Ⅱ的10倍,常参与各种炎性反应,研究报道原发性闭角型青光眼患者中的血浆ET-1水平高于正常眼压性青光眼患者[19]。ET-1可通过收缩眼部微血管引起局部组织缺血缺氧,进而诱导视网膜神经节细胞的凋亡。NO也是内皮源性血管活性因子,对血管内皮细胞舒缩平衡具有调节作用,也是调节器官血流的重要因子。研究报道,NO可促使小梁网松弛而增加眼房水循环,从而起到降低眼内压的作用[20]。ET-1与NO平衡对于视网膜循环至关重要,一旦失衡可引起局部缺血发生视神经的损害。故目前以视网膜神经节细胞为靶点的视网膜保护,已成为治疗青光眼的突破口[21]。
鼠神经生长因子是一种重要的神经营养因子,其是由国外学者首次从小鼠颌下腺中提取而得,具有促进轴突、树突发育,神经纤维定向生长及促进血旺细胞和胶质细胞生长、神经元的分裂、分化和修复作用,还可保护神经元受继发损害[22]。可能与其是由神经、神经元支配靶组织或胶质细胞生成能促进神经元生长、再生、发育等功能特征性表达活性蛋白质相关[23]。本研究结果显示,观察组治疗后1个月复查视野MS、视觉诱发电位振幅、血清NO水平均高于对照组,视野MD、视觉诱发电位潜伏期和血浆ET-1水平低于对照组,而两组治疗各时段眼压比较差异无统计学意义,提示在眼压控制较好的青光眼患者中应用外源性的鼠神经生长因子可有效促进原发性闭角型青光眼小梁切除术后视神经功能的恢复[24]。王红艳等[25]研究结果显示,鼠神经生长因子组MS水平较对照组高,MD水平较对照组低。本研究结果与其报道一致。
综上所述,鼠神经生长因子可能存在一种长效机制,治疗后1个月仍可持续改善原发性闭角型青光眼小梁切除术后患者的电生理参数、视力、视野等,其可有效促进原发性闭角型青光眼小梁切除术后视神经功能的恢复,安全可靠。鼠神经生长因子对视神经的保护作用可能与抑制ET-1水平、升高NO水平相关。
[1] 刘艳艳,余涵.原发性急性闭角型青光眼患者持续高眼压状态下行复合式小梁切除术疗效分析[J].新乡医学院学报,2015,32(2):160-162.
[2] 吴仁毅,黄昌泉,吕洁璇,等.神经生长因子凝胶对青光眼视神经保护的初步临床评价[J].国际眼科杂志,2015,15(2):255-258.
[3] 党鸿,辛晓蓉.青光眼视神经损伤机制的研究进展[J].眼科新进展,2016,36(7):680-683.
[4] 刘励,林胤,陈本安,等.原发性闭角型青光眼小梁切除术后行白内障超声乳化联合房角分离术的疗效分析[J].东南国防医药,2017,19(1):51-53.
[5] 韩敬力,刘天荣,易湘龙.鼠神经生长因子联合高压氧治疗视神经萎缩的疗效[J].眼科新进展,2016,36(9):832-834.
[6] 沈惠芳,谢欣,杨文忠.注射用鼠神经生长因子多药联合治疗对缺血性视神经病变的作用[J].中国医院药学杂志,2015,35(15):1412-1414.
[7] 刘静雯,秦波.鼠神经生长因子对外伤性视神经病变治疗作用的Meta分析[J].国际眼科杂志,2015,15(4):633-635.
[8] Hong J, Chen J, Yang Y,etal. Optical Coherence Tomography Assessment of Angle Anatomy Changes After Trabeculectomy in Primary Angle-Closure Glaucoma[J].J Glaucoma, 2016,25(3):244-246.
[9] 刘文文,姜涛,刘桂波,等.视神经挫伤患者经鼠神经生长因子治疗前后视觉诱发电位变化[J].国际眼科杂志,2015,16(9):1612-1614.
[10] 毕宇,葛红岩,刘平.不同手术方式对原发性闭角型青光眼合并白内障的疗效分析[J].眼科新进展,2015,35(5):442-445.
[11] 高宏杰,李朋英.超声乳化白内障吸除联合小梁切除治疗闭角型青光眼合并白内障的疗效观察[J].实用医院临床杂志,2015,41(2):113-115.
[12] 冯希敏,祁颖,张凤妍,等.超声乳化人工晶状体植入联合房角分离术治疗急性原发性闭角型青光眼合并年龄相关性白内障患者的疗效分析[J].眼科新进展,2016,36(8):767-769.
[13] 金尚丽,郭海科,郭瑞,等.OZIL模式超声乳化联合小梁切除术对白内障合并急性闭角型青光眼的疗效与安全性[J].中国临床研究,2015,28(8):1059-1061.
[14] 胡佩宏,刘新华,裴重刚,等.改良的扇形巩膜瓣半隧道切口行复合小梁切除术治疗原发性闭角型青光眼的临床疗效[J].眼科新进展,2016,36(8):738-741.
[15] 王丽丽,李达,杨阳,等.原发性闭角型青光眼高眼压下复合式小梁切除术的疗效[J].国际眼科杂志,2016,16(10):1937-1939.
[16] 廖辉,伍继光.改良小梁切除术治疗原发性闭角型青光眼患者的疗效[J].国际眼科杂志,2016,16(9):1683-1686.
[17] 施国忠.小梁切除术联合可调节缝线治疗原发性闭角型青光眼的临床疗效[J].临床眼科杂志,2016,24(1):64.
[18] 吴仁毅,黄昌泉,吕洁璇,等.神经生长因子凝胶对青光眼视神经保护的初步临床评价[J].国际眼科杂志,2015,15(2):255-258.
[19] 董洁玉.鼠神经生长因子治疗前部缺血性视神经病变的临床疗效[J].神经损伤与功能重建,2015,10(4):298-299.
[20] 黄胜,卿晨,杨秋林.原发性闭角型青光眼微创小梁切除术的设计及其临床疗效研究[J].湖南中医药大学学报,2016,26(1):393-393.
[21] 谢怡,黄丽娜.闭角型青光眼合并白内障两种手术方式比较的Meta分析[J].国际眼科杂志,2015,15(9):1556-1559.
[22] 高阳,刘洁梅,张良.小梁切除联合生物羊膜移植术治疗原发性慢性闭角型青光眼效果分析[J].临床眼科杂志,2015,23(2):166-168.
[23] Poon Y C, Lai I C, Lee J J,etal. Comparison of surgical outcomes after phacotrabeculectomy in primary angle-closure glaucoma versus primary open-angle glaucoma[J].Taiwan Journal of Ophthalmology, 2015,5(1):89-91.
[24] 梁冬梅.可调节缝线在原发性闭角型青光眼小梁切除术中的应用[J].广东医学,2016,37(2):154-155.
[25] 王红艳,姜涛,刘文文,等.注射用鼠神经生长因子治疗视神经挫伤的临床疗效观察[J].山东医药,2015,59(33):42-43.

