华北油田矿区妇女HPV基因型别分布的研究
赵海英,郭立霞,王杏芹,李国强,张素萍,赵鹏飞,邱艳伟,曹 斌,武海龙,雷 丽
根据中国癌症中心统计发现,2015年我国宫颈癌每年新发98 900例,是我国威胁女性健康最常见的恶性肿瘤[1]。HPV是一种能够定植在生殖道黏膜的DNA病毒,高危型HPV持续感染是目前公认的导致宫颈上皮异型增生,甚至演变成宫颈癌的直接诱因。为了解本地区高危型HPV感染的流行病学情况,现收集2015年3月—2017年3月在华北油田矿区所有医院门诊、体检中心就诊的11 292例女性宫颈脱落细胞行本地区感染率较高的高危HPV基因分型检测的患者数据进行分析。现报告如下。
1 资料与方法
1.1一般资料 本组11 292名已婚适龄女性,年龄14~75岁,均有性生活史,根据年龄分为5组,<25岁组、25~35岁组、35~45岁组、45~55岁组、>55岁组。
1.2标本采集及试验方法 暴露宫颈后,用宫颈脱落细胞取材器(北京博晖创新光电技术股份有限公司)放置于宫颈口,沿宫颈外口顺时针转动2或3圈后取出,将采集的宫颈脱落细胞置于专用的保存液中,样本采集后立即进行检测,所得样本4℃保存时间<24 h。采用微流控全自动医用核酸分子检测仪(北京博晖创新光电技术股份有限公司)进行检测,使用配套的HPV核酸扩增分型检测试剂盒(北京博晖创新光电技术股份有限公司),通过微流控芯片技术实现HPV基因分型的检测,操作过程严格按照试剂盒说明书进行。对高危型16、18、51、52、58亚型阳性例数进行统计,其中存在上述两种或以上型别的HPV感染判定为复合感染。
1.3统计学方法 采用SPSS 22.0统计学软件进行统计学分析,计数资料以率(%)比较,采用χ2检验,α=0.05为检验水准。
2 结果
2.15种HPV亚型感染率的差异 本研究中HPV阳性2000例(17.71%)。所选择5种高危型所占构成比分别为:HPV 16型18.85%(377/2000),HPV 18型4.85%(97/2000),HPV 51型10.45%(209/2000),HPV 52型21.40%(428/2000),HPV 58型11.15%(223/2000),其他型33.30%(666/2000)。HPV 16型和HPV 52型所占构成比高于其他类型(P<0.05)。
2.25种高危型HPV总感染及混合感染的情况 2000名HPV阳性者主要以单一亚型感染为主,其中有376例为复合感染。5个年龄组对应的高危HPV总感染率分别为:<25岁组22.53%(41/182),25~35岁组15.55%(343/2206),35~45岁组18.62%(798/4286),45~55岁组16.74%(646/3860),>55岁组22.69%(172/758)。<25岁组复合感染率2.92%(11/376),25~35岁组复合感染率20.48%(77/376),35~45岁组复合感染率34.84%(131/376),45~55岁组复合感染率31.91%(120/376),>55岁组复合感染率9.84%(37/376)。<25岁组和>55岁组的总HPV感染率高于其他年龄组,但复合感染率低于其他年龄组,差异有统计学意义(P<0.05)。
2.3各年龄组5种高危型HPV的感染分布情况 不同年龄段组5种高危HPV亚型阳性率比较差异无统计学意义(P>0.05)。>25岁组各组中HPV16型与52型感染阳性率高于其他型别(P<0.05)。见表1。
3 讨论
宫颈癌一直是我国最常见妇科肿瘤[2],目前研究表明高危型HPV的持续感染对于宫颈上皮病变的发生和演变具有重要的影响。高危型HPV指包括16、18、52、58、33型等在内的18种与宫颈上皮病变发病风险增加有关的HPV亚型[3]。规范监测高危型HPV感染情况对于监测宫颈上皮内病变的发生发展过程及HPV疫苗的筛选具有重要的意义。
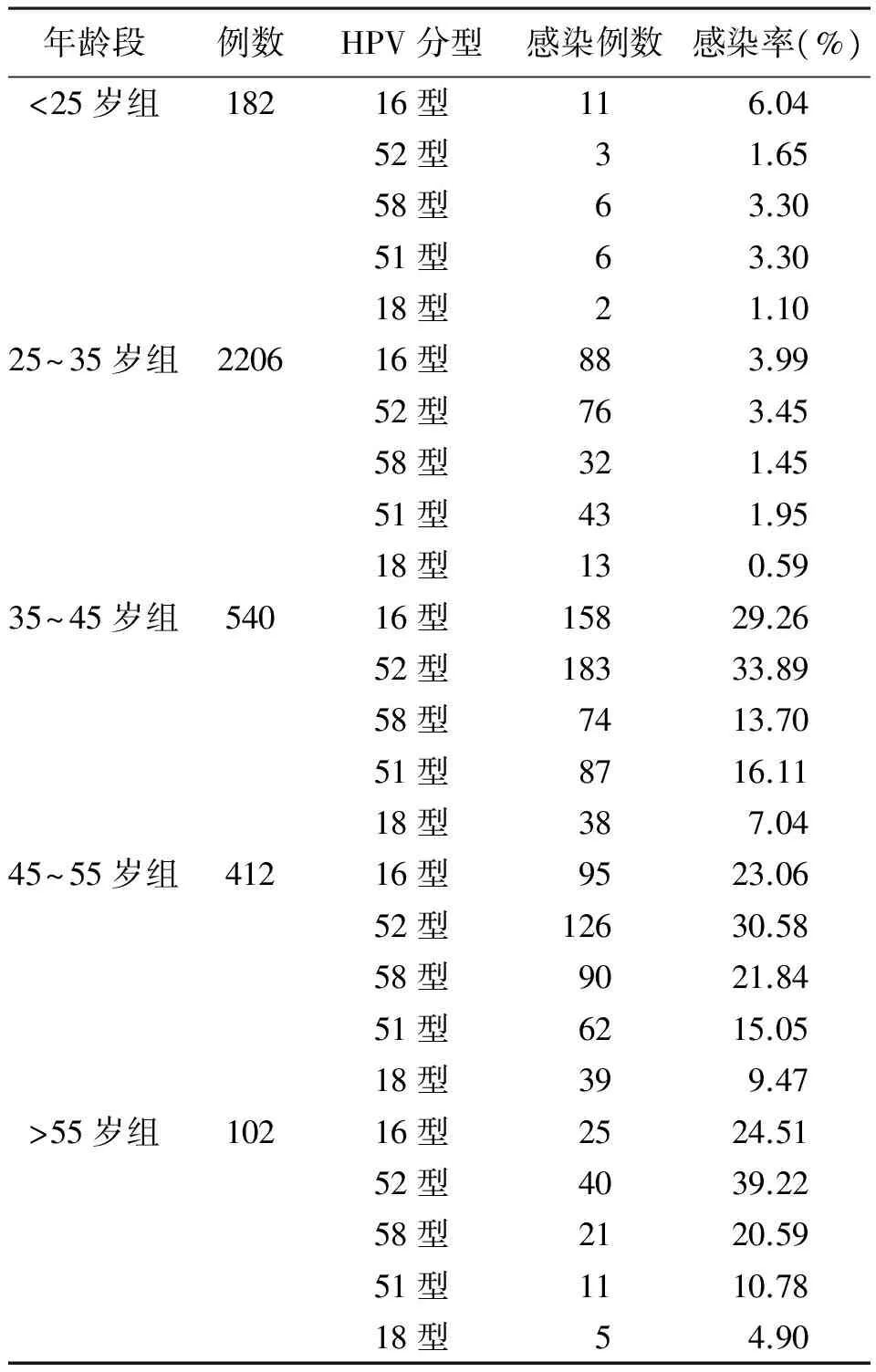
表1 不同年龄组各HPV亚型感染分布情况
宫颈癌的筛查自2009年开展至今尚无基于中国数据的子宫颈癌筛查指南[4],每年我国因宫颈癌死亡的女性在3万左右[5]。目前宫颈癌的筛查方式主要有宫颈脱落细胞学、HPV、阴道镜。有Meta分析显示,HPV检测高级别的宫颈上皮内瘤变具有更高的敏感性[6]。多数研究推荐HPV筛查作为宫颈癌筛查的必备项目,然而由于HPV型别较多,检查费用昂贵,且HPV感染存在地域与年龄差异。因此本研究对本地区高危型HPV的分布及特点进行分析,为HPV筛查提供数据。
目前学术界关于HPV筛查方式的研究较多,由于70%的宫颈癌中均可检出HPV 16及18型[7],Joura等[8]认为筛查高危型HPV16型及18型具有更高的经济-成本效益。本研究结果显示,本地区已婚适龄女性中HPV 16型与52型较其他亚型阳性率高,与文献报道的其他地区存在差异[9-10]。本研究仅对5种最常见的高危型做了分析,至于其他型别阳性是否具有地域分布差异尚需要更多研究。
HPV感染可以被机体的免疫系统清除,但少数高危的HPV亚型持续感染可造成宫颈上皮内瘤变及进一步转化[11]。有研究认为HPV感染与年龄有关,年龄>50岁是HPV感染的独立危险因素[12]。本研究结果显示,高危HPV的感染阳性率在<25岁组及>55岁组较高,与其他文献报道一致,可能与性生活频繁及免疫力低下有关,提示应重视对青少年性传播疾病的知识宣教,老年人应重视宫颈癌筛查,积极发现宫颈早期病变对于预防宫颈癌具有指导意义。本研究中各年龄组高危HPV感染阳性率比较差异无统计学意义,但35~45岁组HPV 16型与52型的感染率较其他年龄组有升高的趋势,提示本地区35~45岁妇女接受HPV筛查的女性占大多数,HPV 16型与52型在本地区的感染发生较多。
有研究表明,复合感染可增加女性宫颈癌前病变的患病风险,但尚不明确是哪一种病毒组合复合感染加速了宫颈病变的发展[13]。本研究结果显示,高危型HPV亚型的复合感染阳性率在25~55岁年龄组中较高,在青少年及老年患者中却较少出现。提示25~55岁为高危型HPV亚型复合感染的高危人群。
综上所述,HPV分布具有地域与年龄差异,重视高危型HPV感染的筛查对于宫颈癌的预防及早发现早诊断早治疗具有积极的意义,随着宫颈癌疫苗在中国的上市,研究HPV的地域分布差异对于宫颈癌疫苗的研发和应用具有重要意义。
[1] 唐珉.宫颈癌流行病学及高危因素研究进展[J].中西医结合心血管病电子杂志,2017(20):18-19.
[2] 王晓平.P16和Ki-67在宫颈鳞癌癌前病变中的表达及其诊断价值分析构架[J].中国医药科学,2017,7(14):203-205.
[3] 赵海英,郝钢华,刘琦,等.华北油田矿区妇女人乳头状瘤病毒感染现状及相关因素分析[J].中华医院感染学杂志,2017,27(11):2577-2579,2606.
[4] Apgar B S, Kittendorf A L, Bettcher C M,etal. Update on asccp consensus guidelines for abnormal cervical screening tests and cervical histology[J].Am Fam Physician, 2009,80(2):147-155.
[5] 陈万青,郑荣寿,张思维,等.2012年中国恶性肿瘤发病和死亡分析[J].中国肿瘤,2016,25(1):1-8.
[6] Cuzick J. Outcomes in Women With Cytology Showing Atypical Squamous Cells of Undetermined Significance With vs Without Human Papillomavirus Testing[J].JAMA Oncol, 2017,3(10):1327-1334.
[7] Joura E A, Ault K A, Bosch F X,etal. Attribution of 12 high-risk human papillomavirus genotypes to infection and cervical disease[J].Cancer Epidemiol Biomarkers Prev, 2014,23(10):1997-2008.
[8] Joura E A, Giuliano A R, Iversen O E,etal. A 9-valent HPV vaccine against infection and intraepithelial neoplasia in women[J].N Engl J Med, 2015,372(8):711-723.
[9] 杨赟平.重庆地区妇女及宫颈癌患者高危型HPV感染与年龄的相关性分析[D].重庆:重庆医科大学,2013.
[10] 陈鸣华,印永祥,张玉娟,等.11 231例女性宫颈HPV基因分型的回顾分析[J].中国妇幼保健,2014,29(34):5570-5573.
[11] 秦广益,陶敏芳.宫颈高危型人乳头状瘤病毒潜伏感染者病毒自然清除率的研究[J].中国临床医学,2011,18(3):307-309.
[12] Li N. Persistence of type-specific human papillomavirus infection among Daqing City women in China with normal cytology: a pilot prospective study[J].Oncotarget, 2017,8(46):81455-81461.
[13] Schmitt M, Depuydt C, Benoy I,etal. Prevalence and viral load of 51 genital human papillomavirus types and three subtypes[J].Int J Cancer, 2013,132(10):2395-2403.

