四川传统腌腊肉制品中乳酸菌的分离鉴定及其抗氧化能力研究
田圆圆,刘绒梅,耿 琦,史健阳,张国建,孙 群
(四川大学生命科学学院 生物资源与生态环境教育部重点实验室,四川 成都 610064)
0 引 言
四川传统腌腊肉制品因其独特的风味受到广大消费者的喜爱。四川传统腌腊肉制品属于自然发酵肉制品,依赖于原料肉和加工环境中的微生物群[1];因此,其中存在丰富的具有地域特色的微生物菌种资源。
腌腊肉制品中存在广泛的氧化反应,包括脂肪氧化和蛋白氧化。适度的氧化对产品风味和滋味的形成有重要贡献,但过度的脂肪氧化和蛋白质氧化会影响产品的质量,给产品带来持水性降低、质构变差、颜色变暗、风味变差等问题[2-3]。因此,减缓腌腊肉制品的氧化反应,对保证产品质量和延长货架期具有重要意义。阻断肉与肉制品中的自由基反应是减缓氧化的最有效途径之一。现如今,大部分抗氧化剂来自化学合成和天然物质的提取,但是化学合成的抗氧化剂可能会生成新的自由基造成产品氧化[4],而天然抗氧化物质又有提取纯化过程较复杂的缺点。已有研究表明,某些乳酸菌具有抗氧化的能力,乳酸菌具有生长周期短、安全和价格低廉的优势[5]。
乳酸菌是发酵肉制品中的主导微生物,对发酵肉制品的质量和安全起着至关重要的作用[6],乳酸菌在发酵肉制品中的作用得到了广泛的研究。用于发酵肉制品的乳酸菌的主要发酵特征需要满足肉类发酵剂要求,即具有蛋白酶和脂肪酶活性,不产NH3、生物胺、H2S和CO2,能够耐受6%NaCl和150mg/kg NaNO2,以及能够在10~30℃生长等[7]。已有的研究表明某些乳酸菌具有抗氧化能力,通常具有抗氧化能力的乳酸菌具有清除羟自由基和二苯苦味肼基(DPPH自由基)能力,以及还原能力和抗脂质过氧化能力。如从中国传统发酵食品中分离的Lactobacillus plantarum对羟自由基和二苯苦味肼基的清除率分别达到44.31%和53.05%[8],从哈尔滨红肠中分离的Pediococcus pentosaceus能够清除羟自由基和DPPH自由基,具有还原能力和抗脂质过氧化能力,并且能够显著降低发酵香肠的脂肪氧化和蛋白质氧化程度[4]。同样L.fermentum具有清除羟自由基和DPPH自由基的能力[9]。
本研究从采集于四川多个地区的7种农家自制传统腌腊肉制品中筛选乳酸菌,通过16S rDNA测序对筛选菌株进行鉴定,并检测筛选菌株的主要发酵特征,对主要发酵特征满足肉类发酵要求的菌株,进一步检测其清除羟自由基、DPPH自由基的能力,还原能力和抗脂质过氧化能力,以评价其抗氧化能力。从而筛选出有望应用于发酵肉制品并减缓产品氧化的潜力菌株。
1 材料与方法
1.1 材料与试剂
一共7个样品采集于四川省多个地区农户,包括四川省眉山市、都江堰市、成都市、资阳市和宜宾市。样品采集后于4℃保存,2d内进行筛菌实验。
引物27F、1492R合成于Invitrogen(上海)贸易有限公司;细菌DNA提取试剂盒,北京天根公司;亚硝酸钠、精氨酸、半胱氨酸、醋酸铅、溴甲酚紫、石蕊、中性红、乙酸钠、蛋白胨、吐温80、葡萄糖、酵母浸粉、氯化钠等生化试剂,均购自成都金蜀都化验设备有限公司。邻二氮菲、DPPH、亚油酸、抗坏血酸,购于成都云德科技有限公司。
MRS培养基按文献[4]配制:10 g蛋白胨、10 g牛肉膏、5 g酵母浸粉、20 g葡萄糖、5 g乙酸钠、2 g K2HPO4、2 g 柠 檬 酸 铵 、0.5 g MgSO4·7H2O、0.25 g MnSO4·4H2O、1 mL 吐温 80、20 g琼脂,补水至 1 L,121℃灭菌15min。
筛选菌株主要发酵特征检测培养基按照文献[10-11]配制:
蛋白酶活性检测培养基:10g脱脂奶粉,100 mL蒸馏水,4mL浓度为25g/L的石蕊,分装试管,高度为 4~5cm,113℃灭菌15min。
脂肪酶活性检测培养基:MRS固体培养基中加入15%的猪油和中性红指示剂,121℃灭菌20min。
精氨酸产NH3培养基:10g蛋白胨、20g精氨酸、5 g酵母浸粉、0.5 g葡萄糖、5 g乙酸钠、2 g K2HPO4、2 g 柠檬酸钠、0.5 g MgSO4·7H2O、0.25 g MnSO4·4H2O、1mL吐温80、20g琼脂,补水至1L,121℃灭菌15min。
产生物胺检测培养基:5 g蛋白胨,3 g酵母膏,1 g葡萄糖,1 mL浓度为1.6%的溴甲酚紫-乙醇溶液,1L蒸馏水,加热溶解,加入5gL-氨基酸或者10g DL-氨基酸,调pH至6.8。对照培养基不加氨基酸。分装小试管,上面滴加一层液体石蜡,115℃灭菌10min。
产H2S培养基(醋酸铅纸条法):10 g蛋白胨,10g牛肉膏,5g氯化钠,0.5g半胱氨酸,1L蒸馏水,调 pH至7.0~7.4,112℃灭菌 20min。
葡萄糖产CO2培养基:10g蛋白胨,5 g氯化钠,1L蒸馏水,加热溶解,待冷却后将pH调至7.4。加入1~2 mL浓度为1.6%的溴甲酚紫乙醇溶液,再加入葡萄糖使葡萄糖终浓度为20%,分装试管,将杜氏小管倒置放入试管中,121℃灭菌30min。
耐盐试验培养基:在MRS液体培养基中加入NaCl,使得NaCl的终浓度为6%。
耐亚硝酸盐试验培养基:在MRS液体培养基中加入NaNO2,使得NaNO2的终浓度为150mg/L。
1.2 主要仪器与设备
S 1000 PCR仪,Wide Mini-Sub Cell GT型水平电泳槽,PowerPac Basic型电泳仪电源,Universal Hood II型凝胶成像系统,美国Bio-rad公司;Micro 21 R型高速冷冻离心机,美国Thermo Fisher Scientific公司;AFZ-1002-U型超纯水仪,美国Aquapro公司;UV-2450紫外分光光度计,日本Shimadzu公司。
1.3 乳酸菌的分离与鉴定
在无菌条件下,称取5 g样品,剪碎,放入装有50 mL无菌生理盐水的三角瓶中,室温震荡30 min。静置数分钟,取1 mL上清液依次进行10倍梯度稀释涂布,37℃培养48h。根据培养基上的菌落形态和初步镜检观察,挑选不同的特征菌落,经多次划线分离纯化。纯化之后的菌株增殖培养之后,提取菌株DNA,并进行扩增,测序。测序结果输入到NCBI数据库中进行序列比对。
1.4 筛选菌株在不同温度下生长情况的检测
将筛选菌株接种于MRS液体培养基中,分别于5,10,15,20,25,30℃下培养 24h,测定 600nm 处OD值。
1.5 筛选菌株主要发酵特征的检测
将筛选菌株接种到相应的发酵特征检测培养基,培养检测。
1.6 筛选菌株的培养及无细胞提取液的制备
筛选菌株采用MRS液体培养基,37℃静置培养24h,所有的菌株经过3次传代。培养液离心(10000g,10min,4℃),收集菌体。0.02mol/L磷酸钠缓冲液洗涤菌体3次,菌体重悬于灭菌的0.02 mol/L磷酸钠缓冲液,菌体浓度调至107CFU/mL,得到细胞悬浮液。冰浴超声破碎细胞悬浮液,离心(10000g,10min,4℃),收集上清液,即为无细胞提取液。
1.7 筛选菌株清除羟自由基和DPPH自由基能力的测定
筛选菌株对羟自由基的清除能力的测定方法参照文献[11]。依次取1mL邻二氮菲(0.75mmol/L),2mL磷酸盐缓冲溶液(0.2 mol/L,pH 7.4)和 1 mL样品(细胞悬浮液或者无细胞提取液)混匀。再加入1mL H2O2(0.01%),37℃水浴反应 90min。 加入细胞悬浮液的一组,离心,取上清液。分别测定上清液在536nm处的吸收值。
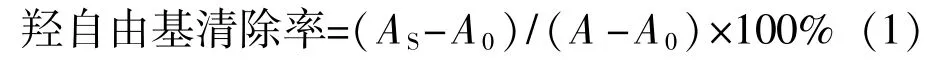
式中:AS——样品的吸收值;
A0——没加样品的对照组的吸收值;
A——没加样品和H2O2的空白吸收值。
筛选菌株对DPPH自由基清除能力的测定方法参照He[12]与Wang[9]的方法稍加改进。取1mL样品(细胞悬浮液或者无细胞提取液)和2 mL DPPH(0.2mmol/L,溶于95%乙醇),混匀。室温暗反应30min。加入细胞悬浮液的一组,离心,取上清液。分别测定上清液在517nm处的吸收值。

式中:AS——实验组的吸收值;
AB——加入95%乙醇和样品的空白吸收值;AC——加磷酸盐缓冲溶液和DPPH溶液的对照组的吸收值。
1.8 筛选菌株还原能力和抗脂质过氧化能力的测定
筛选菌株还原能力的测定参考文献[13]的方法,并略有改进。依次取0.5mL样品(细胞悬浮液或者无细胞提取液),0.5mL磷酸盐缓冲溶液(0.2 mol/L,pH 6.6)和 0.5 mL 铁氰化钾溶液(1%),混匀,50℃水浴反应20min。加入0.5mL三氯乙酸溶液(10%),离心(3 000g,5min),取 500μL 上清液和 200 μL 三氯化铁溶液混匀,静置10min。测定在700nm处的吸收值。吸收值越大,还原活性就越大。
菌株抗脂质过氧化能力的测定参照Lee等[14]的方法。取0.5 mL磷酸盐缓冲溶液 (0.02 mol/L,pH 7.4),1 mL 亚油酸乳化液,0.2 mL FeSO4溶液(0.01%),0.02 mL抗坏血酸(0.01%)和 0.4 mL样品(细胞悬浮液或者无细胞提取液)混匀,37℃反应12h。吸取1mL反应液,0.1mL三氯乙酸溶液(4%),1 mL硫代巴比妥酸溶液(0.8%)和0.1 mL 2,6-二叔丁基-4-甲基苯酚溶液(0.4%)混匀。100℃下反应30min,冷却。加入1mL正丁醇抽提,离心(1800g,10min)吸取上清液,测532nm处吸收值(AS)。 以磷酸盐缓冲液代替样品为对照(AB)。

2 结果与分析
2.1 乳酸菌的分离鉴定
从四川传统腌腊肉制品中共分离纯化出乳酸菌逾100株,通过比较菌落形态及镜检观察,共挑选40株乳酸菌进行分子鉴定,鉴定结果如表1所示。各菌株与NCBI BLAST数据库检索得到的最相似模式菌株同源性均大于或等于99%。初步鉴定出有7种不同的乳酸菌。所占比例最多的是Weissella hellenica,其次是Leuconostoc mesenteroides。分离到的乳酸菌,在已有的研究报道中,除W.confusa被报道为致病菌外[15],其余均在肉类发酵剂使用,因此舍去W.confusa,然后挑选出初步判断为不一样的8株菌株进行进一步研究。对这8株菌进行编号为L1:W.hellenica strain;L2:L.plantarum; L3:W.hellenica;L4:L.mesenteroides; L5:L.curvatus;L6:L.plantarum;L7:W.cibaria;L8:W.viridescens。
2.2 筛选菌株的主要发酵特征
用作肉类发酵剂的菌株需要满足肉类发酵剂的要求,即具有蛋白酶和脂肪酶活性,不产NH3、不产生物胺、不产H2S、不产CO2、能够耐受6%NaCl和150mg/kg NaNO2等[9]。筛选菌株的主要发酵特征见表 2,筛选菌株中 L2、L3、L4、L5、L6、L8 具有分解蛋白的能力。所有筛选菌株均不具有分解脂质、产NH3、产生物胺、产H2S和产CO2的能力。所有筛选菌株均能够耐受6%NaCl和150mg/kg NaNO2,其中L6对NaCl的耐受性最差,耐受性仅为23.22%,L7和L8对NaNO2的耐受性相对较差,NaNO2耐受性分别为72.29%和72.55%。

表1 从四川传统腌腊肉制品中分离的乳酸菌的种类及所占比例
2.3 筛选菌株在不同温度下生长情况
制备发酵肉制品原料时的温度范围为4~7℃,发酵过程的温度范围为18~24℃,干燥成熟过程的温度范围为12~15℃。用作肉类发酵剂的菌株要求能够在5~30℃存活或生长[6]。筛选菌株在不同温度的生长情况如图1所示,筛选到的菌株在5℃都几乎不生长,L1和L7适应的温度范围较窄,在5~20℃都不生长,而筛选到的其他菌株适应的温度范围较宽,在15~30℃均能生长,在30℃生长最好,其中L2和L4在低温下生长能力较强,这与肉类发酵剂的要求相符。因此舍去L1和L7,对其余筛选菌株进一步研究。

图1 筛选菌株在不同温度下生长情况

表2 筛选菌株的主要发酵特征1)-2)
2.4 筛选菌株清除羟自由基和DPPH自由基能力
检测对DPPH自由基和羟自由基的清除能力是评价抗氧化能力的常用有效方法。为了初步判断具有抗氧化能力的物质在胞内还是胞外,同时检测了细胞悬浮液和无细胞提取液的清除能力。由图2可以看出,所有筛选菌株的无细胞提取液和细胞悬浮液均具有清除DPPH自由基和羟自由基的能力,L6的细胞悬浮液清除能力最强,清除率分别至24.16%和52.48%。所有筛选菌株的细胞悬浮液对DPPH自由基的清除能力均强于其无细胞提取液的清除能力。L2、L3、L8的无细胞提取液和细胞悬浮液对羟自由基的清除率均高于20%。虽然用于实验的菌体浓度(107cells/mL)比文献[16]的菌体浓度(1010cells/mL)低,但对自由基的清除率却高于其实验结果。已有研究表明,细胞悬浮液具有的抗氧化能力与菌体表面的蛋白和多糖有关[6],无细胞提取液具有的抗氧化能力与细胞内的抗氧化酶有关,例如谷胱甘肽过氧化物酶,过氧化氢酶,超氧化物歧化酶等[17]。

图2 筛选菌株DPPH自由基和羟自由基清除能力
2.5 筛选菌株还原能力和抗脂质过氧化能力
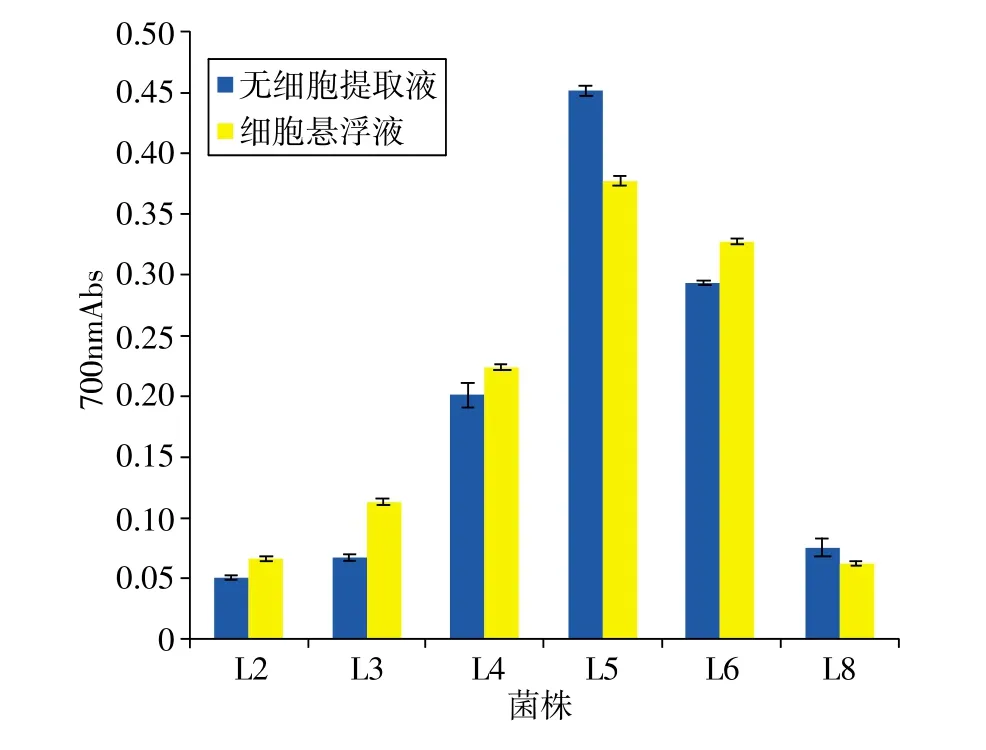
图3 筛选菌株还原能力

图4 筛选菌株抑制脂质过氧化能力
对还原能力和抗脂质过氧化能力的检测同样是评价抗氧化能力的常用指标之一。已有研究报道中将在700nm处的吸收值达到0.040视为具有较高的还原能力[4],图3表明筛选的菌株均具有较高还原能力,尤其是L5和L6。细胞悬浮液具有还原能力与细胞表面的多糖和蛋白有关,而无细胞提取液具有还原能力与细胞内的抗氧化物质有关,如NADH、NADPH、谷胱甘肽、尿酸等[18]。图4表明,除L6的无细胞提取液和L8的细胞悬浮液不具有抗脂质过氧化能力,其余筛选菌株的无细胞提取液和细胞悬浮液菌体均具有抗脂质过氧化能力,抗脂质过氧化率均高于20%,L5抗脂质过氧化率最高,至63.36%。筛选菌株具有抗脂质过氧化能力可能是因为它们能够清除超氧阴离子[19]。
3 结束语
本研究从四川传统腌腊肉制品中筛选出8株乳酸菌,综合来看,筛选菌株中L4,即L.mesenteroides,不仅主要发酵特征满足肉类发酵剂的要求,对NaCl和NaNO2耐受性较强,适应的温度范围宽,在低温下生长能力较强,还具有较强的抗氧化能力。结合L4在筛选菌株中所占比例较大这一实验结果,猜测L4对四川传统腌腊肉制品的品质具有重要贡献。因此从四川农家自制传统腌腊肉制品筛选出的具有抗氧化能力的L.mesenteroides值得进一步研究,有望开发成具有抗氧化能力的肉类发酵剂,用于发酵肉制品生产,减缓产品氧化、保证产品质量和延长产品货架期。
[1]JANSSENS M,MYTER N,DE V L,et al.Community dynamics ofcoagulase-negative staphylococciduring spontaneous artisan-type meat fermentations differ between smoking and moulding treatments[J].International Journal of Food Microbiology,2013,166(1):168-175.
[2]FALOWO A B,FAYEMI P O,MUCHENJE V.Natural antioxidants against lipid-protein oxidative deterioration in meat and meat products:A review[J].Food Research International,2014,64(22):171-181.
[3]UTRERA M,ARMENTEROS M,VENTANAS S,et al.Pre-freezing raw hams affects quality traits in cooked hams:Potential influence of protein oxidation[J].Meat Science,2012,92(4):596-603.
[4]CHEN Q,KONG B,SUN Q,et al.Antioxidant potential of a unique LAB culture isolated from Harbin dry sausage:In vitro and in a sausage model[J].Meat Science,2015,110:180-188.
[5]张天博,宁喜斌.乳酸菌对自由基清除能力的研究[J].中国乳品工业,2007,35(4):10-12.
[6]LIU S,HAN Y,ZHOU Z.Lactic acid bacteria in traditional fermented Chinese foods[J].Food Research International,2011,44(3):643-651.
[7]AMMOR M S,MAYO B.Selection criteria for lactic acid bacteria to be used as functional starter cultures in dry sausage production: An update[J].Meat Science,2007,76(1):138.
[8]LI S,ZHAO Y,ZHANG L,et al.Antioxidant activity ofLactobacillus plantarumstrains isolated from traditional Chinese fermented foods[J].Food Chemistry,2012,135(3):1914-1919.
[9]WANG A N,YI X W,YU H F,et al.Free radical scavenging activity ofLactobacillus fermentumin vitro and its antioxidative effect on growing-finishing pigs.[J].Journal of Applied Microbiology,2009,107(4):1140-1148.
[10]陈红征,杨洁.发酵马肉中乳酸菌的分离筛选与鉴定[J].食品科技,2010(1):30-33.
[11]帅瑾.传统自然发酵四川香肠中乳酸菌的分离、鉴定及其应用[D].雅安:四川农业大学,2013.
[12]HE Z,WANG X,LI G,et al.Antioxidant activity of prebiotic ginseng polysaccharides combined with potential probioticLactobacillus plantarumC88[J].International Journal of Food Science&Technology,2015,50(7):1673-1682.
[13]王曦,罗霞,许晓燕,等.不同乳酸菌菌株抗氧化能力的比较研究[J].食品科学,2010,31(9):197-201.
[14]LEE J,HWANG K T,CHUNG M Y,et al.Resistance ofLactobacillus caseiKCTC 3260 to reactive oxygen species (ROS): role for a metal ion chelating effect[J].Journal of Food Science,2010,70(8):388-391.
[15]VELA A I,PORRERO C,GOYACHE J,et al.Weissella confusainfection in primate (Cercopithecus mona)[J].E-merging Infectious Diseases,2003,9(10):1307-1309.
[16]王燚.抗氧化肉品发酵剂的筛选及其在羊肉香肠中的应用[D].雅安:四川农业大学,2008.
[17]ZHANG Y,LI Y.Engineering the antioxidative properties of lactic acid bacteria for improving its robustness[J].Current Opinion in Biotechnology,2013,24(2):142.
[18]LIN M Y,YEN C L.Antioxidative ability of lactic acid bacteria[J].Journal of Agricultural&Food Chemistry,1999,47(4):1460.
[19]AHOTUPA M,SAXELIN M,KORPELA R.Antioxidative properties ofLactobacillusGG[J].Nutrition Today,1996,31(6):51.

