海洋真菌产酶能力的研究
乔 慧,韩廷玉,张庆芳*
(1.大连大学 生命科学与技术学院,辽宁 大连 116622;2.辽宁省海洋微生物工程技术研究中心,辽宁 大连 116622)
浩瀚的海洋是地球上生命的摇篮,海洋特有的环境造就了海洋微生物种类的多样性、独特性以及其代谢产物的多样性。海洋微生物种类多达100万种以上,而目前所研究和鉴定的海洋微生物还不到总量的5%[1],已发现的活性物质只占总数的1%[2]。且目前获得的产酶菌株普遍存在着产酶成本高、酶活性不稳定等问题,因此寻找更高效、具有市场竞争力的菌种资源是当务之急。从一些特殊和极端环境中(如海洋、极地、盐湖、温泉、火山口附近等)筛选出的产酶活性菌株,一般都具有独特的酶学性质,如耐高温、耐寒、耐高盐、耐强酸强碱等特性,可扩大所需酶的应用范围。其中海洋环境作为新型生物活性物质的源泉[3],海洋真菌作为主要的产酶微生物[4],由于对其特殊生长环境(高压、无光照、低温、低营养及局部高温等极限环境)的适应,形成了独特的遗传特性和代谢类型,因此可产生不同于陆源真菌的生物活性物质[5-7]。了解海洋真菌产酶情况对了解其生物性质和生产次级代谢物的机理有重要意义,也可利用海洋真菌造福人类、保护环境,所以VRIJMOED教授(1982年)首次报道南海海域木生海洋真菌的种类、分布、季节动态变化对木生海洋真菌的影响后[8-10],我国陆续开展了对海洋真菌的研究。目前,我国对海洋微生物的研究多是对南海海域生物种类调查及海洋天然物的研究,而且多集中在海洋细菌上,仅涉及少量的海洋真菌[11-19],限制了对海洋真菌资源的利用。
本研究从渤海海洋环境中进行真菌的分离和筛选,并对其产酶能力进行初步研究,旨在发掘具有产酶活性的海洋真菌资源,考察渤海海洋微生物真菌资源的产酶潜能,以期为渤海海洋中真菌的进一步开发利用提供一定的理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
海水、海藻:采集自大连丽娇湾和金石滩,于灭菌的试管(锥形瓶)内4℃冷藏备用。
1.1.2 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)分离培养基[20]:取去皮马铃薯200 g,切成小块或片状,加适量陈海水煮沸30min,滤去马铃薯块,将滤液补足至1000mL,加葡萄糖20 g,琼脂20 g,溶解后分装,pH自然。
淀粉酶筛选培养基[21]:将可溶性淀粉代替PDA分离培养基中的葡萄糖,其他成分同PDA分离培养基,pH自然。
纤维素酶筛选培养基[22-23]:10 g羧甲基纤维素钠,4 g(NH4)2SO4,2 g KH2PO4,0.5 g MgSO4·7H2O,0.5 g NaCl,1 g蛋白胨,20 g琼脂,1 000 mL陈海水,pH 5.5。
蛋白酶筛选培养基[24]:4.0g干酪素,20g琼脂,用0.1mol/L,pH 7.0的磷酸盐缓冲液配制成1 000 mL培养基。
脂肪酶筛选培养基[25-26]:3.0 g NaNO3,1.0 g K2HPO4,0.5gKCl,0.5gMgSO4·7H2O,0.01gFeSO4·7H2O,20g琼脂,24 g香油,0.016 g中性红,1 000 mL陈海水,pH值自然。
植酸酶筛选培养基[27]:3 g植酸钙,30 g葡萄糖,5 g NH4NO3,0.5gKCl,0.03gMgSO4·7H2O,0.03gFeSO4·7H2O,20 g琼脂,1 000 mL陈海水,pH 5.5。
以上培养基均在0.1 MP、121℃灭菌20 min。
1.1.3 试剂
多增氧:溶氧决定产量,多开增氧机增氧,曝气、调水的效果好。使用罗茨风机加纳米管或纳米盘增氧,功率可达10瓦/立方水体,产量也可达10斤/立方水体。
羧甲基纤维素钠、(NH4)2SO4、MgSO4·7H2O、NaCl、FeSO4·7H2O(均为分析纯)、蛋白胨、琼脂(均为生物试剂):生工生物(上海)股份工程有限公司;干酪素、NaNO3、K2HPO4、植酸钙(均为分析纯):大连凯美化工工程配套有限公司。
1.2 仪器与设备
HD-1360型超净工作台:北京东联哈尔仪器制造有限公司;HZP-250全温振荡培养箱、DK-S26电热恒温水浴锅:上海精宏实验设备有限公司;LTI-700低温恒温培养箱:上海爱朗仪器有限公司;DHG-9070电热恒温鼓风干燥箱:上海一恒科技有限公司;UV-2102C紫外可见分光光度计:龙尼柯仪器有限公司;LDZX-40BI立式压力蒸汽灭菌器:上海审安医疗器械厂;CX21FS1显微镜:日本奥林巴斯株式会社。
1.3 方法
1.3.1 海洋真菌的分离、纯化及保藏
称取1.0g样品,在无菌条件下加入装有9 m L无菌水的小三角瓶中,摇匀,25℃预培养3 d,备用。分别取100 μL预培养的悬浮液涂布于PDA分离培养基上,于25℃恒温倒置培养4~7 d,对平板上生长且形态不同的菌落进行编号并记录。将分离得到的真菌菌株用点种法接种到新的PDA分离培养基中,25℃培养4 d后,划线接种进行纯化,以得到纯种的单菌落。
将形成单菌落的菌种划线接种到PDA斜面上,编号,25℃培养4~6 d,待菌长满斜面时转移到4℃冰箱中保藏。
1.3.2 特定产酶真菌的筛选
采用筛选培养基法对分离得到的海洋真菌进行产酶能力的筛选,将纯化后的单菌落点接至5种酶筛选培养基上,每个菌落在平板上点接3个重复,25℃恒温培养4~7 d,通过特征反应判断真菌是否产生此种酶,本研究中主要判断各种真菌是否产淀粉酶、纤维素酶、蛋白酶、脂肪酶和植酸酶。
(1)将接种的淀粉酶筛选培养基于25℃培养4 d后,用卢戈氏碘液染色,以菌落周围是否出现水解透明圈及其大小为评价指标,筛选产淀粉酶真菌。
(2)将接种的纤维素酶筛选培养基于25℃培养6 d后,用2 mg/mL刚果红染液染色2 h,弃去染液,用1 mol/L NaCl溶液脱色1 h,以菌落周围是否出现水解透明圈及其大小为评价指标,筛选产纤维素酶真菌。
(3)将接种的蛋白酶筛选培养基于25℃培养3 d,以菌落周围是否出现水解透明圈及其大小为指标,筛选产蛋白酶真菌。
(4)将接种的脂肪酶筛选培养基于25℃培养3 d,以菌落周围是否出现水解透明圈及其大小为评价指标,筛选产脂肪酶真菌。
(5)将接种的植酸酶筛选培养基于25℃培养3 d,以菌落周围是否出现水解透明圈及其大小为评价指标,筛选产植酸酶真菌。
记录产酶菌株编号,测定菌落直径(r)(cm)和透明圈直径(R)(cm),以透明圈直径与菌落直径的比值(R/r)表示酶活大小,R/r值越大,表明酶活越强。
1.3.3 产酶真菌的鉴定
将筛选出产酶真菌接种到PDA平板上,25℃培养,观察平板中菌株从开始生长到长出大量孢子这个过程中的菌落生长状况、菌落颜色、形态、大小,以及菌落在PDA平板正反面的颜色差别、菌落边缘和表面的质地、纹饰、渗出物、气味、菌丝的粗细高矮、生长密度、孢子颜色等[28,18]。并通过对菌株菌落特征的观察,参考有关真菌鉴定文献[30],同时结合《真菌鉴定手册》[29]对分离菌株进行鉴定,判断其种属。
2 结果与分析
2.1 海洋真菌的分离及纯化
利用PDA分离培养基自渤海局部海域的海水、海藻样品中经过多次分离、纯化,并根据菌落形态和显微形态的观察排除重复的菌株,共筛选分离出32株海洋真菌。
2.2 产酶海洋真菌的筛选、鉴定
将以上32株海洋真菌菌株接种在5种产酶筛选培养基上产酶菌株种属分类统计结果见图1。
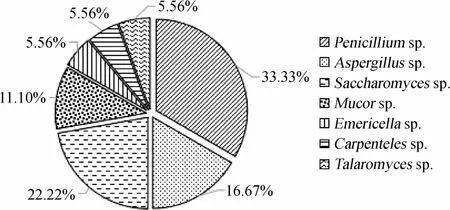
图1 产酶海洋真菌属种分类单元统计结果Fig.1 Statistical results of genus and species taxon of enzyme-producing marine fungi
由图1可知,这些产酶菌株分布于4个属,其中6株菌归为青霉属(Penicilliumsp.),占总筛选产酶菌株数的33.33%;6株菌归为曲霉属(Aspergillussp.)及其亚属,其中包括泡波曲霉属(Emericellasp.)、坚壁曲霉属(Carpentelessp.)、黄丝曲霉属(Talaromycessp.)各有1株,占总筛选产酶菌株数的33.35%;4株菌归为酵母属(Saccharomycessp.),占总筛选产酶菌株数的22.22%;2株菌归为毛霉属(Mucorsp.),占总筛选产酶菌株数的11.10%;未产酶的真菌菌株有14株,可能是菌株不产以上5种酶,或者是菌株本身不具有产酶活性,也可能是菌株长期保藏传代而失去活性。
2.3 产酶活性大小的研究
对照真菌鉴定手册[29]和《常见及常用真菌》[30],按菌落形态、大小、颜色变化及菌丝的显微结构等对32株海洋真菌菌株进行逐一比对,产酶菌株的筛选结果及其分类学地位见表1。
由表1可知,从32株海洋真菌菌株中共筛选出产酶菌株18株,其中有1株菌同时产4种酶,3株菌同时产3种酶,8株菌同时产2种酶。将18株产酶菌株分别点接于淀粉酶筛选培养基,筛选出6株产淀粉酶菌株,占产酶菌株的33.33%;其中优势菌群为酵母属(Saccharomycessp.),含海洋真菌4株,占产淀粉酶真菌的66.67%。比较菌株的R/r值,结果显示除菌株7外,其余5株菌的R/r均>1.50,产淀粉酶能力较高,其中菌株31产淀粉酶能力最高,R/r为1.83。
将18株菌株分别点接于纤维素酶筛选培养基,筛选出10株产纤维素酶菌株,占产酶菌株的55.56%,其中优势菌群为曲霉属(Aspergillussp.),含海洋真菌6株,占产纤维素酶真菌的60%,其次为酵母属(Saccharomycessp.)和青霉属(Penicilliumsp.),各占产纤维素酶真菌的20%。比较菌株的R/r值,结果显示,菌株2、9、16、25、27的R/r均≥1.50,而菌株9、27的R/r值甚至超过3.00,其中又以菌株27的产纤维素酶能力最高,R/r值为3.12。

表1 产酶海洋真菌的筛选及其分类学地位Table 1 Screening and taxonomic status of enzyme-producing marine fungi
将18株产酶菌株点接于蛋白酶筛选培养基,筛选出5株产蛋白酶菌株,占产酶菌株的27.78%,其中优势菌群为酵母属(Saccharomycessp.)和青霉属(Penicilliumsp.),各占产蛋白酶真菌的40%。比较菌株的R/r值,结果显示菌株9、29、30产酶能力较高,R/r值在1.50以上,其中又以菌株9产蛋白酶能力最强,R/r值为2.80。
将18株产酶菌株点接于脂肪酶筛选培养基,筛选出3株产脂肪酶菌株,占产酶菌株的16.67%,其中优势菌群为曲霉属(Aspergillussp.),含海洋真菌2株,占产脂肪酶真菌的67.67%。比较菌株的R/r值,结果显示菌株29,产脂肪酶能力最强,R/r值为1.75。
将18株产酶菌株点接于植酸酶筛选培养基,筛选出11株产植酸酶菌株,占产酶菌株的61.11%,其中优势菌群为曲霉(亚)属(Aspergillussp.),含海洋真菌5株,占产植酸酶真菌的45.45%,其次为青霉属(Penicilliumsp.),含海洋真菌3株,占产植酸酶菌株的27.27%。比较菌株的R/r值,结果显示11株产植酸酶菌株的产酶能力均较高,R/r值均在1.5以上,其中有9株菌株的R/r值在2.0以上,菌株26的产酶能力最强,R/r值为3.47。
3 结论
本研究从三个地区海水、海藻中分离得到32株海洋真菌,产酶菌株18株,分布于4个属。其中优势属为曲霉属(Aspergillussp.)和青霉属(Penicilliumsp.),各6株,占总筛选产酶菌株数的33.33%,其次为酵母属(Saccharomyces sp.),占总筛选产酶菌株数的22.22%。在6株产淀粉酶菌株中,菌株31(属于Penicilliumsp.)产淀粉酶能力最高;10株产纤维素酶菌株中,菌株27(属于Aspergillussp.)产纤维素酶能力最高;5株产蛋白酶菌株中,菌株9(属于Saccharomyces sp.)产蛋白酶能力最强;3株产脂肪酶菌株中,菌株29(属于Penicilliumsp.)产脂肪酶能力最强;11株产植酸酶菌株中,菌株26(属于Aspergillussp.)的产酶能力最强。本研究还发现有1株同时产4种酶,3株同时产3种酶,8株同时产2种酶,结果表明,同一属的不同种,其产酶特性存在很大的差别,体现了海洋真菌的产酶多样性。本研究为后续渤海海域产酶真菌资源的开发和应用研究奠定理论基础。
[1]张力元.海洋来源产蛋白酶的菌株筛选及其产酶条件的优化研究[D].保定:河北农业大学,2014.
[2]陈丽维,敖敬群,陈新华.一株抗植物致病真菌的深海霉菌的鉴定和活性成分理化性质分析[J].应用海洋学学报,2013,32(3):390-395.
[3]和振花.北极海水中可培养寡营养细菌多样性研究[D].武汉:华中师范大学,2011.
[4]MAN X,CHAO Q,OBBARD J P.Biodiesel production usingAspergillus nigeras a whole-cell biocatalyst in a packed-bed reactor[J].Global Change Biol Bioenerg,2011,3(4):293-298.
[5]李 慧,车 茜,李德海,等.南极海洋丝状真菌多样性及其次级代谢产物的研究进展[J].中国海洋药物,2016,35(1):74-81.
[6]邹水洋,刘传生,朱 丹.康宁木霉固态发酵生产纤维素酶与木聚糖酶的研究[J].东莞理工学院学报,2011,18(5):55-59.
[7]崔海洋,程仕伟,黄田红,等.产纤维素酶的解淀粉芽孢杆菌分离鉴定及酶学性质研究[J].食品科学技术学报,2014,32(3):43-47.
[8]ISLAS A,EYHERABIDE M,ECHEVERRIA H E,et al.Mycotoxic capacityand efficiencyofconsortiumswith mycorrhizal fungi native to soils of the province of Buenos Aires with contrast management[J].Arg J Microbiol,2014,46(2):133-143.
[9]CAI H,FAN H,ZHAO L,et al.Effects of surface charge on interfacial interactions related to membrane fouling in a submerged membrane bioreactor based on thermodynamic analysis[J].J Colloid Interface Sci,2016,465(5):33-41.
[10]SAJITH S,SREEDEVI S,PRIJI P,et al.Production and partial purification of cellulase from a novel fungus,Aspergillus flavusBS1[J].Ann Microbiol,2014,64(2):763-771.
[11]KAWAGUCHI Y,SUGINO T,TABATA M,et al.Fluorescence imaging of microbe-containing particles shot from a two-stage light-gas gun into an aerogel[J].Origins Life Evol Biosph,2014,44(1):43-60.
[12]刘 涛,李占林,王 宇,等.海洋真菌Fusariumsp.次级代谢产物的研究[J].天然产物研究与开发,2012,24(8):1047-1050.
[13]孙英英.两株南海红树林内生真菌次级代谢产物的研究[D].广州:广东药科大学,2016.
[14]ZHANG L K,KANG M Y,HUANG Y C,et al.Fungal communities from the calcareous deep-sea sediments in the Southwest India Ridge revealed by illumina sequencing technology[J].World J Microbiol Biotech,2016,32(5):78-88.
[15]ZHANG X Y,HE F,WANG G H,et al.Diversity and antibacterial activity of culturable actinobacteria isolated from five species of the South China Sea gorgonian corals[J].World J Microbiol Biotechnol,2013,29(6):1107-1116.
[16]ZHANG X Y,ZHANG Y,XU X Y,et al.Diverse deep-sea fungi from the South China Sea and their antimicrobial activity[J].Curr Microbiol,2013,67(5):525-530.
[17]PARK S H,KIM J Y,Kim Y J,et al.Phylogenetic diversity of bacterial community inhabited in callyspongia elegans[J].Korean J Microbiol,2014,50(2):152-157.
[18]QIN X Y,YANG K L,LI J,et al.Phylogenetic diversity and antibacterial activity of culturable fungi derived from the zoanthidPalythoa haddoni,in the South China Sea[J].Mar Biotechnol,2015,17(1):99-109.
[19]LEE O O,WANG Y,YANG J,et al.Pyrosequencing reveals highly diverse and species-specific microbial communities in sponges from the Red Sea[J].Isme J,2011,5(4):650-664.
[20]SINGH A K,MUKHOPADHYAY M.Overview of fungal lipase:a review[J].Appl Biochem Biotechnol,2012,166(2):486-520.
[21]贾瑞博,胡荣康,周文斌,等.米曲霉(Aspergillus oryzaeFAFU)淀粉酶的分离纯化及其酶学性质研究[J].食品与发酵工业,2016,42(11):71-76.
[22]曲均革,姚晓敏,朱 鹏,等.产纤维素酶海洋细菌的筛选鉴定和产酶条件优化[J].上海海洋大学学报,2012,21(6):1053-1057.
[23]严 芬,李源涛,李丽莎,等.一株产高温纤维素酶真菌的筛选、鉴定及酶学性质研究[J].福州大学学报,2013,41(3):397-402.
[24]罗晓妙,高玉强.高产胞外蛋白酶毛霉的筛选及酶学性质研究[J].西昌学院学报:自然科学版,2014,28(4):17-21.
[25]段盈伊,赵淑琴,韩生义,等.产脂肪酶菌株的筛选、鉴定以及酶学性质的研究[J].甘肃农大学报,2017,52(2):146-151.
[26]徐启峻,滕宏飞,黄 程,等.一株柱状假丝酵母产脂肪酶条件的优化研究[J].中国油脂,2015,40(5):70-75.
[27]刘建民.产植酸酶菌株的筛选、诱变及产酶性质的初步研究[D].烟台:烟台大学,2012.
[28]王洪媛,范丙全.三株高效秸秆纤维素降解真菌的筛选及其降解效果[J].微生物学报,2010,50(7):870-875.
[29]陈 瑜.临床常见细菌、真菌鉴定手册[M].北京:人民卫生出版社,2009:10-26.
[30]中国科学院微生物研究所《常见与常用真菌》编写组.常见与常用真菌[M].北京:科学出版社,1973:77-91.
——甘露早油
——无籽贡柑

