针刺治疗慢性心肌缺血小型猪模型系列方法的可行性探讨
张金铃,田 毅,荣培晶*,方继良,王 瑜,石 力,贾术永,何 勋, 雷洪涛,孟 宏
(1.中国中医科学院针灸研究所,北京 100700; 2.北京协和医学院,中国医学科学院阜外医院,北京 100037; 3.中国中医科学院广安门医院,北京 100053; 4.中国中医科学院医学实验中心,北京 100700; 5.北京工商大学理学院化妆品系,北京 100048)
“内关”是临床上首选常用于治疗心绞痛、心肌炎、心律不齐等心脏疾病的穴位,大量临床和小型动物的实验研究也证实了针刺“内关”疗效的作用机理[1],但针灸“内关”应用于治疗大型实验动物心肌缺血的研究未见报道。大型实验动物猪的心脏冠状动脉解剖结构及血流动力学生理病理特点与人类相近,其慢性心肌缺血模型更符合缺血性心肌病的临床病理生理过程[2],故本研究拟采用心血管系统与人类更为接近的巴马小型猪作为实验动物[3]。通过手术放置Ameroid缩窄环于左前降支建立小型猪慢性心肌缺血模型,并采用埋针进行治疗[4],探讨该系列方法的可行性。
1 材料和方法
1.1 实验动物
采用普通级巴马小型猪12只,雌雄不限,体重18~30 kg,7~8月龄。巴马小型猪造模后随机分为治疗组针刺内关穴(PC6)和对照组针刺足三里穴(ST36),每组6只。动物由北京通和生态比较医学研究所动物实验中心提供 [SCXK (京) 2015-004],自由饮水,分笼饲养,每天视动物摄食情况补充标准实验猪饲料,术前适应性喂养7 d,术后饲养7周 [SYXK (京) 2014-0014]。动物实验符合伦理要求,实验程序通过了中国医学科学院阜外医院实验动物委员会伦理委员会批准(批号:2013-1-25-973)。
1.2 主要试剂与仪器
戊巴比妥钠盐:Genview分装,批次号:37H10520;华佗牌针灸针:直径0.25 mm,苏州医疗用品厂有限公司出品;G3H型多参数动物监护仪:深圳市杰纳瑞医疗仪器有限公司;AM811型麻醉机:北京易世恒电子技术有限责任公司。
1.3 实验方法
1.3.1 小型猪心肌慢性缺血模型制备[5-7]改良方法
小猪术前24 h禁食水,采用戊巴比妥钠进行诱导麻醉,选取耳缘静脉建立液体通道,吸入异氟烷维持麻醉。小型猪麻醉后,插入气管内导管,呼吸机辅助呼吸,连接心电监护仪备用。手术区备皮并常规消毒铺巾。于左侧第3肋间前外侧作长约8 cm的横切口入胸并注意止血。在左冠状动脉左前降支第一对角支分叉处以下约1 cm处放置Ameroid缩窄环。于左心耳水平处剪开心包并悬吊,于左心耳肺动脉之间寻找左前降支(left anterior descending branch,LAD)主干,小心分离动脉表面的心外膜及脂肪组织,尤其应注意不要损伤小的深穿支以防出血。游离长度约为1.5 cm,小心地将直角镊挑起游离出的LAD主干两端,同时,用血管钳夹持Ameroid环,使侧口对准冠状动脉,将LAD迅速套入环中。缩窄环植入完毕后,调整环的位置,使其位于左心耳与肺动脉之间的沟内,同时缺口朝向心包方向,以防缝合心包后压迫损伤心肌或使缩窄环脱出。观察有无出血及缩窄环位置有无阻碍血流。确认无误后关闭心包,膨肺后关胸。待自主呼吸恢复后,拔除气管插管,送回动物房。术后连续肌注青霉素3 d预防感染,定期观察切口情况及动物的一般状态。
1.3.2 干预方法
心脏慢性缺血造模后4周进行内关和足三里埋针并电针。埋针前提前取出7号埋线针的内芯,截取1.5 cm并用砂纸将两端打磨光滑,将处理好的内芯浸泡在75%的酒精中消毒待用。埋针时用镊子夹取一段处理好的内芯,从9号针突孔置在穿刺针套管的前端,从套管尾孔插入一根内芯。右手持针柄,左手夹住套管中下段,将7号针芯快速刺入皮下肌层,退出9号针。消毒后纱布包好针孔,防止出血。电针于检测前预处理,将小型猪麻醉后置于操作台面监控下行针,毫针匀速进针足三里或内关,接通韩式电针仪。
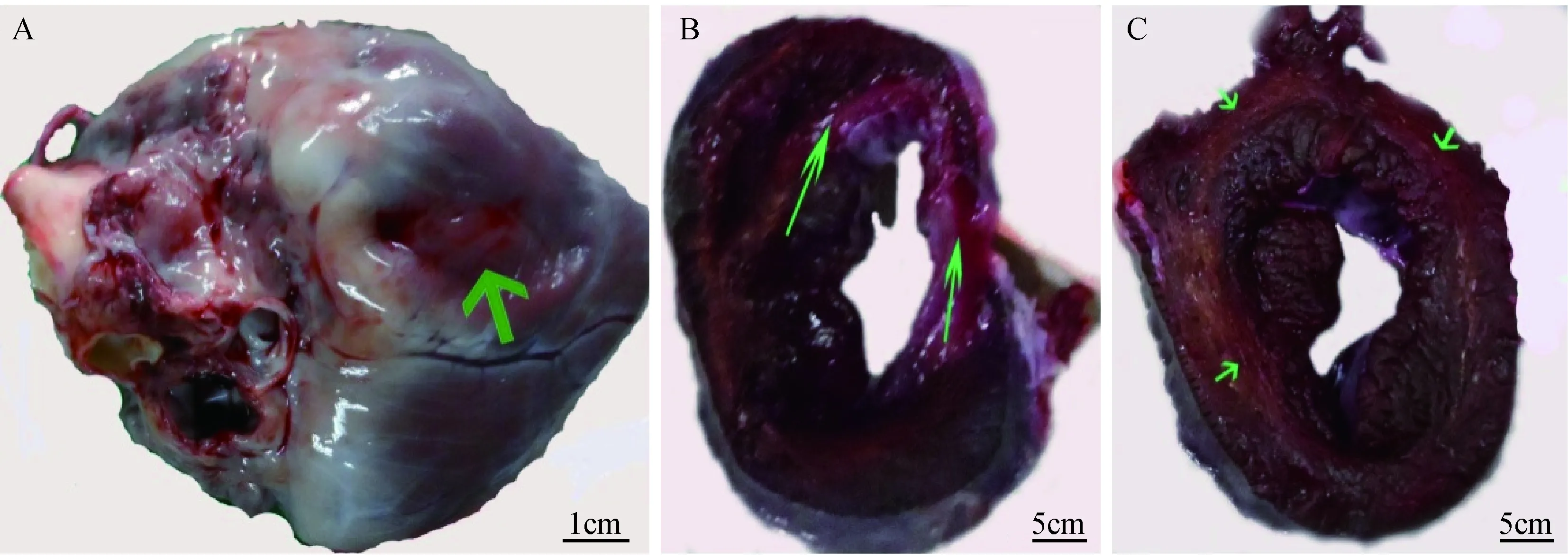
注:A:术后心脏;B:足三里组;C:内关组。箭头指示缺血区域。图1 术后心脏大体病理观察及缺血模型术后各组的心脏切片形态改变(TTC染色)Note. A: Heart after operation. B: “Zusanli” (ST36) group.C: “Neiguan” (PC6) group. Arrows indicate the ischemic area.Fig.1 Gross appearance of heart and morphological changes of cardiac sections in each group after modeling of chronic myocardial ischemia. TTC staining
1.3.3 观察及指标检测
(1)肉眼大体观察:取出心脏后大体病理观察有无缺血的室壁瘤形成,针刺足三里和内关组心脏形态颜色区别观察,拍照。
(2)TTC大体病理染色观察:方法改良后为预先配制质量分数为1%的TTC磷酸盐缓冲液于染色缸中,放入恒温水浴箱恒温约30 min使达到37℃。取出心脏后快速以垂直心脏长轴的角度,染色切片从左心尖开始,切片到缩窄环部位,每片厚度1 cm,共计切7片,放入染色缸中染色20 min后依次取出拍照,第一片染色拍照一张,第二至七片各染色拍照两面两张,故每只心脏共计染色拍照13张,观察各切片心肌颜色。
(3)超微结构观察:取材心脏后随机选取内关组和足三里组各3例进行超微电镜取材,每只心脏取缺血区和非缺血区各取一块组织。电镜方法参照文献[8],取材心肌组织黄豆大小,即刻顺肌纤维方向切成约1 mm组织块,4%戊二醛和1%四氧化锇双重固定,脱水、包埋、超薄切片70 nm,采用日立H7650透射电镜观察心肌细胞超微结构。
2 结果
2.1 小型猪心脏肉眼观察大体病理改变
摘除心脏后大体观察结果如图1A所示,慢性心肌缺血手术后,心脏左室靠近室间隔部位可看到明显的圆形皱褶微红区,心脏右侧和右心室前侧暗红色,可触摸到心室壁薄变。
2.2 针刺后慢性心肌缺血小型猪心脏TTC病理染色结果
针刺内关穴后,染色切片前10张基本是暗红色,还没有出现明显的缺血红色区。针刺内关穴后的第11~12张染色片出现淡红色缺血环区。针刺后足三里组从第3张染色片以后的各个切片均可见淡红色化的缺血区。选取足三里组和内关组典型图发现,第11张染色片(1B和1C)显示缺血出现的鲜红色中有些许发白区域,提示本实验条件下手术后出现了缺血区域,心肌慢性缺血模型成功;循心包经针刺内关穴可以减少缺血心肌数量,对缺血心肌的保护效应强于足三里穴的效应。
2.3 电镜透射扫描心肌细胞超微结构改变结果
如图2A所示,正常猪心肌细胞电镜图可见线粒体嵴排列整齐、密集,线粒体膜完整,空泡化线粒体少见,肌丝排列整齐致密。针刺足三里心肌细胞(如图2B所示)线粒体出现空泡化,嵴消失,有些线粒体缺失,结构不清,心肌纤维化明显。针刺内关组缺血区心肌细胞电镜图(图2C)显示,散在的线粒体内部嵴消失,部分线粒体缺如,肌丝结构不清,纤维化明显,和足三里组比较无明显差异。
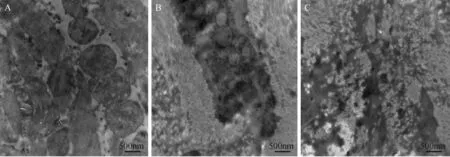
注:A:正常心肌;B:足三里组缺血区心肌;C:内关组缺血区心肌。图2 缺血造模术后各组心肌细胞的超微结构比较(× 30 000)Note. A: Normal myocardium. B: “Zusanli’ (ST36) group. C: “Neiguan” (PC6) group.Fig.2 Comparison of ultrastructure of the cardiomyocytes in each group after operation for modeling of chronic myocardial ischemia
3 讨论
缺血性心肌病是目前人类死亡率越来越高的疾病,据统计缺血性心脏病、中风和慢性阻塞性肺疾病占全球约32%的死亡原因,而缺血性心脏病位居第一[9-10]。研究表明,电针心包经“内关”-“间使”可通过改善交感、迷走活动的平衡实现降低血清心肌酶及内皮素的水平来减轻缺血性心肌损伤[11],但都是采用小型实验动物大鼠、小鼠,本研究的慢性心肌缺血模型是冠状动脉渐进性阻塞逐渐发展到心肌缺血状态而引起病变,这种大型实验动物的慢性模型更符合临床疾病生理病理过程。实验猪的心脏冠状动脉解剖结构及侧枝循环与人类相似,心肌有相对较多的冠状动脉侧枝循环,造模后存活率高,猪的慢性心肌缺血模型可为研究针刺预防和治疗心肌缺血、冠状动脉侧枝循环生成等提供条件[12-16]。本研究埋针并电针的疗法应用于与人类更为相近的大型实验动物心肌缺血模型猪的设计尚属首创。
大体病理在临床上通常是诊断的金标准,本研究心脏的大体病理染色采用氯化三苯基四氮唑(TTC),是一种脂溶性光敏感复合物,常用作染色剂检测哺乳动物组织的缺血梗塞,正常组织表现为暗红色,它与组织中脱氢酶反应后,缺血组织表现鲜红色或淡红色,但梗死组织中脱氢酶活性下降不能与其反应,故不被染色呈苍白色[17]。本研究针刺“内关”后TTC病理染色结果显示,第11张染色片始有缺血红色区可见。针刺“足三里”穴第3张染色片就隐约可见淡红色的缺血区。手术后均出现TTC染色病理切片鲜红色缺血区,说明此种手术放置缩窄环造模慢性心肌缺血方法成功,同时比较此两例显示治疗组针刺“内关”穴对缺血的抑制效应强于对照组针刺“足三里”穴。
线粒体具有为细胞提供能量、参与细胞分化、细胞信息传递等一系列细胞代谢离子通道的功能,它的损伤是很多疾病产生的根源,故线粒体的保护机制的研究显现出越发重要的作用。线粒体肿胀、形态改变是线粒体损伤的重要特征[18],透射电镜可以直观地观察到线粒体嵴断裂消失减少、线粒体肿胀等损伤状况。本实验透射电镜观察线粒体损伤程度发现慢性心肌缺血造模手术后针刺“足三里”和“内关”穴心肌细胞均出现线粒体空泡化,嵴消失,有些线粒体缺失,看不到肌丝,结构不清,纤维化明显。说明手术后导致了心肌细胞线粒体的损伤模型成功,针刺心包经穴位“内关”没有表现出比“足三里”更好的抑制线粒体超微结构变异的效应。
本研究结果可见针刺“内关”可以减少慢性心肌缺血的面积,提示针刺心包经“内关”穴可以通过减少心肌细胞缺血损伤数量的途径来起到保护心肌的效应,而不能抑制已经造成缺血损伤细胞的线粒体变异的程度。
小型猪的生理特性与人类最为接近,且对缺血性损伤敏感。以往慢性缺血模型多采用冠脉结扎、药物、球囊等方式,病程较急,死亡率高。故本实验探索采用巴马小型猪冠状动脉前降支放置缩窄环的方法,虽然需要操作人员的精湛技术,但成模率能达到大约80%,缺血梗死面积基本可控,模型动物存活时间长,利于实施慢性针灸效应和不同方式强度电针效应观察,重要的是这种可用于针灸疗效研究的模型与人类慢性心肌缺血疾病的发生发展的病理生理过程相似度高。
本研究说明手术放置Ameroid缩窄环于左前降支建立小型猪慢性心肌缺血模型,并采用埋针进行治疗的系列创新方法是可行的,实现了将传统医学的精华埋针并电针治疗方法应用于大型实验动物模型研究的跨越。
[1] 王双昆, 卢晨, 王友京. 不同频率电针“内关”穴对心肌缺血再灌注大鼠血管活性物质的影响 [J]. 针刺研究, 2015, 40(5): 378-382.
[2] 卢志强, 张艳军, 崔广智, 等. 心肌缺血模型的制作方法研究进展 [J]. 中国药理学通报, 2012, 28(8): 1053-1057.
[3] Suzuki Y, Yeung AC, Ikeno F. The representative porcine model for human cardiovascular disease [J]. J Biomed Biotechnol, 2011, 2011:195483.
[4] 张今朝, 朱秀玲, 赵青, 等. 内关穴埋针治疗小型猪慢性心肌缺血的心脏CT注射优化方法 [J]. 中华中医药杂志, 2016, 31(10): 4288-4290.
[5] 科雨彤, 田丛娜, 魏红星, 等. 门控心肌灌注和心肌代谢显像动态评价小型猪室壁瘤形成后左心室功能和重构变化的实验研究 [J]. 中国循环杂志, 2015, 30(6): 580-584.
[6] 科雨彤, 田毅, 田丛娜, 等. 门控心肌灌注和心肌代谢显像评价新方法制作小型猪室壁瘤模型的可行性 [J]. 医学研究杂志, 2015, 44(5): 28-32.
[7] 张波, 陈保富, 马德华, 等. 经胸腔镜建立巴马小型猪慢性心肌缺血模型 [J]. 医学研究杂志, 2014, 43(7): 104-107.
[8] 张维清, 吴秀英. 环磷腺苷葡甲胺对新生缺氧缺血性脑病猪心肌CREB含量的影响 [J]. 解剖科学进展, 2016, 22(1): 23-25.
[9] 王洁, 胡玲, 许静, 等. 电针不同穴组对心肌缺血大鼠海马脑源性神经营养因子、酪氨酸激酶B表达的影响 [J]. 针刺研究, 2016, 41(1): 40-44.
[10] GBD 2013 Mortality and Causes of Death Collaborators. Global, regional, and national age-sex specific all-cause and cause-specific mortality for 240 causes of death, 1990-2013: a systematic analysis for the Global Burden of Disease Study 2013 [J]. Lancet, 2015, 385(9963): 117-171.
[11] 陈伟, 陈淑萍, 李成文, 等. 大鼠疑核-迷走神经介导针刺“内关”-“间使”改善心肌缺血机制的研究 [J]. 针刺研究, 2016, 41(3): 189-196.
[12] 于震, 刘建勋. 慢性心肌缺血动物模型制备方法 [J]. 中国药理学通报, 2005, 21(3): 273-276.
[13] 潘永明, 陈亮, 徐孝平, 等. 痰瘀互结证慢性心肌缺血小型猪模型的建立 [J]. 中国比较医学杂志, 2015, 25(9): 1-7.
[14] 谭伟江, 王静, 李想, 等. 蕨麻小型猪心梗模型的建立及梗死边缘区基因表达谱分析 [J]. 中国实验动物学报, 2016, 24(6): 558-566.
[15] 庞琳琳, 张会永, 杨关林. 巴马小型猪在医学研究中的应用进展 [J]. 中国实验动物学报, 2014, 22(1): 94-98.
[16] 兰琴, 王竹林, 曹浩, 等. 改良左旋支结扎法微创小型猪急性心肌梗死模型建立与评估 [J]. 中国实验动物学报, 2017, 25(4): 414-419.
[17] 杨涛涛, 肖颖, 奚赛飞, 等. 大鼠心肌梗死模型构建和评价方法的改良 [J]. 中国比较医学杂志, 2014, 24(2): 46-51, 4.
[18] 吴敏, 朱杰, 贾明明, 等. 钙离子与氧自由基诱导损伤猪心肌细胞线粒体超微结构观察 [J]. 动物医学进展, 2014, 35(5): 62-67.

