稻粒黑粉病、稻曲病、恶苗病病原真菌的MALDI—TOF—MS鉴定规范化条件研究
周莉质+宗凯+李云飞+姚剑+檀根甲


摘要:采用基质辅助激光解析电离飞行时间质谱(matrix-assisted laser desorption/ionization time of flight mass spectrometry,简称MALDI-TOF-MS)技术对水稻作物的3种主要病原真菌进行分析,以获得稳定的指纹图谱。从菌物预处理方法、基质、点样方法等3个方面进行比较,对影响MALDI-TOF-MS分析结果的主要因素进行优化。结果表明,菌物预处理方法对检测结果的影响最大,热处理法在细胞壁较厚的真菌样品处理中可以获得较完整的生物信息;构建稻粒黑粉病病菌(Tilletia horrida)、稻曲病病菌(Ustilaginoidea virens)、恶苗病病菌(Fusarium moniliforme)的MALDI-TOF-MS鉴定规范化方法,扩充MALDI-TOF-MS指纹图谱数据库,可简便、快速、准确地对细胞壁加厚的真菌样品进行鉴定。
关键词:MALDI-TOF-MS;稻粒黑粉病;稻曲病;恶苗病;鉴定;指纹图谱
中图分类号: S435.111.4文献标志码: A文章编号:1002-1302(2017)23-0093-07
水稻真菌病害大多是由病原菌的分生孢子、厚垣孢子以种子、土壤带菌或空气水流传播的方式流行[1]。近年来由于新型超级稻的推广,稻粒黑粉病、稻曲病、恶苗病的真菌病害逐渐上升为水稻的主要病害。基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption/ionization time of flight mass spectrometry,简称MALDI-TOF-MS)技术可借助基质对非挥发性和热不稳定性等生物大分子进行解吸电离,脉冲激发后离子云电离粒子真空向上通过飞行管探测器,产生1个频谱图被认为是该微生物的指纹图谱[2]。
植物病原真菌各生长阶段营养体差异较大,表达的蛋白种类和表达量有一定变化,与细菌相比,真菌孢子细胞壁含多糖和固醇类物质,在MALDI-TOF-MS鉴定中没有单一的方法被作为常规处理方法使用,其结果常出现因培养条件不同而导致鉴定结果不准确的情况[3-5]。基于DNA序列的鉴定方法受PCR引物探针特异性、测序成本和时间等因素的制约。本研究对稻粒黑粉病病菌(Tilletia horrida)、稻曲病病毒(Ustilaginoidea virens)和恶苗病病菌(Fusarium moniliforme)的MALDI-TOF-MS鉴定从预处理方法、适用基质、点样方法等3个方面进行优化[1,6],对病原真菌建立标准规范化的 MALDI-TOF-MS鉴定方法并进行稳定性重复分析,为植物病原真菌的MALDI-TOF-MS鉴定方法提供参考。
1材料与方法
1.1试验材料
试验所用菌种分离自水稻带菌种子中,由安徽出入境检验检疫局植物检疫实验室保存。
PDA培养基:200 g马铃薯、20 g葡萄糖、18 g琼脂,加入1 000 mL蒸馏水中加热搅拌溶解,灭菌后待冷却至55~60 ℃倒平板。
察氏培养基:3.00 g硝酸钠、1.00 g磷酸氢二钾、0.50 g硫酸镁、0.50 g氯化钾、0.01 g硫酸亚铁、30.00 g蔗糖、18.00 g 琼脂,加入 1 000 mL 蒸馏水中加热搅拌溶解,灭菌后待冷却至55~60 ℃ 倒平板。
基质辅助激光解吸电离飞行时间质谱分析系统,购自日本岛津公司。
1.2试验方法
1.2.1MALDI-TOF-MS参数线性操作模式,延迟提取,分析离子带正电荷,基质抑制偏转模式,加速电压为20 kV,提取电压为18.6 kV,脉冲离子提取时间为3 500 ns,质荷比范围为1 500~20 000,激光點击数为每张图谱80~100次,激光频率60.0 Hz。使用大肠杆菌ATCC 8739作为外标校准物质。
1.2.2病原真菌的培养稻曲病病菌的培养:将纯化保存的菌株接种于PDA平板中,28 ℃活化培养7 d。
恶苗病病菌的培养:将纯化保存的菌株接种于察氏培养基平板中,28 ℃活化培养7 d。
稻粒黑粉病病菌厚垣孢子的获得:病粒在75%乙醇中浸泡5 min后夹出,在滤纸上晾干,再用无菌水漂洗病粒2次,夹出病粒用滤纸吸干水分,用刀切开病粒将厚垣孢子抖入装有无菌水的培养皿中,用擦镜纸过滤得到稻粒黑粉病菌的厚垣孢子。
1.2.3样品的预处理方法选择用接种针各挑取20 mg(湿质量)稻曲病病菌、恶苗病病菌菌体和稻粒黑粉病病菌厚垣孢子,采用75%乙醇法、热处理法、液氮研磨法、载玻片挤压法、氧化锆珠匀浆法等5种方法分别对3种真菌进行破壁预处理。
75%乙醇法:向20 mg菌体(厚垣孢子)中加入300 μL无菌水摇匀,再加入900 μL预冷的无水乙醇涡旋混匀,超声处理 3 min 后12 000 r/min离心2 min,弃去上清液,沉淀物于室温晾5 min[6]。
热处理法:向20 mg菌体(厚垣孢子)中加入300 μL无菌水摇匀,沸水水浴加热30 min,取出冷却后加入1 mL无水乙醇,摇匀静置3 min后12 000 r/min离心2 min。弃去上清液,沉淀物于室温晾5 min。
液氮研磨法:将菌体(厚垣孢子)用液氮研磨后,加入 300 μL 无菌水并移入1.5 mL离心管内,加入900 μL预冷的无水乙醇涡旋混匀,静置3 min后12 000 r/min离心2 min,弃去上清液,沉淀物于室温晾5 min。
载玻片挤压法:将菌体(厚垣孢子)用2片载玻片用力挤压,在显微镜下观察到孢子破裂即可。用300 μL无菌水将挤压的菌体洗入1.5 mL离心管中,加入900 μL预冷的无水乙醇涡旋混匀,静置3 min后12 000 r/min离心2 min,弃去上清液,沉淀物于室温晾5 min。endprint
氧化锆珠匀浆法:向20 mg菌体(厚垣孢子)中加入 300 μL 无菌水摇匀,加入100 mg氧化锆珠(直径0.5 mm),研磨棒匀浆5 min,加入900 μL预冷的无水乙醇涡旋混匀,静置3 min后12 000 r/min离心2 min,弃去上清液,沉淀物于室温晾5 min[7]。
向5种方法提取的沉淀物中加入30 μL 70%甲酸,将沉淀打散混匀,再加入30 μL乙腈,8 000 r/min离心1 min,取上清液进行MALDI-TOF-MS分析。
1.2.4基质的选择采用“1.2.3”节中选出的最佳样品预处理方法分别对病原真菌进行预处理,基质溶剂为水、乙醇、乙腈(体积比为1 ∶1 ∶1)的混合溶液,分别以α-氰基-4-羟基肉桂酸(CHCA)、2,5-二羟基苯甲酸(DHB)、芥子酸(SA)为基质进行MALDI-TOF-MS分析。
1.2.5点样方法的选择采用“1.2.3”节中最佳的样品预处理方法对病原真菌进行预处理,选用“1.2.4”节中最佳的基质。试样的点样方法直接影响基质对生物信息物质的离子化程度,对有效基质的溶剂和点样包被方法进行筛选可有效提高MALDI-TOF-MS检测结果的有效性[6]。点样方法有以下3种。
覆盖干燥法:将1 μL真菌提取物点加到飞行质谱(matrix-assisted laser desorption/ionization,简称MALDI)靶板上,室温条件下晾干,再点加1 μL基质溶液覆盖于样品点上,室温条件下晾干用于MALDI-TOF-MS分析。
夹心点样法:将1 μL基质溶液点加在MALDI靶板上,室温晾干形成种子层,然后在种子层上覆盖1 μL样品,室温晾干,再点加1 μL基质溶液覆盖于样品点上,室温条件下晾干用于MALDI-TOF-MS分析。
混合干燥法:将样品上清液与基质溶液等体积混合,取 1 μL 混合液点加在MALDI靶板上,室温条件下晾干用于MALDI-TOF-MS分析。
1.2.6重复性试验为确定稻粒黑粉病、稻曲病、恶苗病病原真菌的MALDI-TOF-MS鉴定条件的稳定性,对这3种病原真菌的鉴定进行重复性试验。采用“1.2.3”节中最佳样品预处理方法对病原真菌进行预处理,选用“1.2.4”节中最佳基质和“1.2.5”节中最适的点样方法进行重复性试验。同一样品的重复性试验:每个样品重复点样10次,进行MALDI-TOF-MS分析。批间样品的重复性试验:对病原真菌进行3次重复培养、预处理提取、点样等工作。
2结果与分析
2.1样品预处理方法的确定
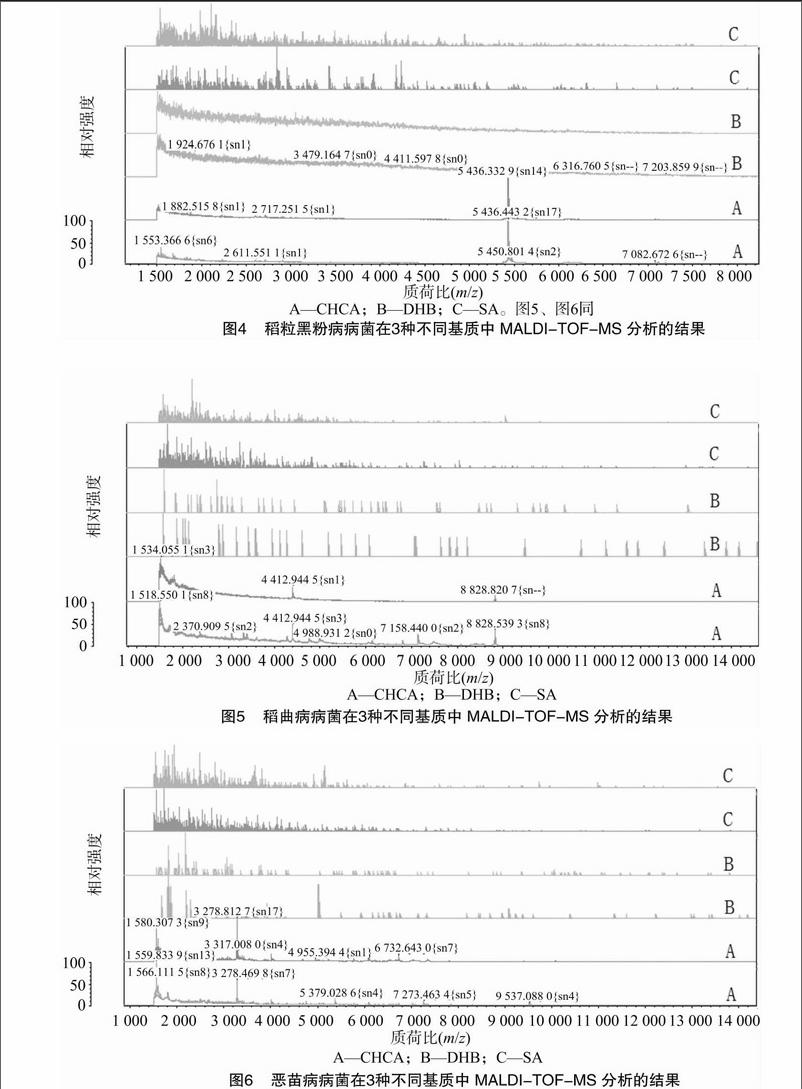
稻粒黑粉病、稻曲病、恶苗病病原真菌的预处理提取物以CHCA为基质的MALDI-TOF-MS分析结果分别如图1、图2、图3所示。75%乙醇法对真菌类细胞壁过厚的样品不适用,稻粒黑粉病病菌和恶苗病病菌未得到特征峰谱图或强度过低,稻曲病病菌在质荷比小于4 000的小分子肽段部分背景噪音过高;液氮研磨法和氧化锆珠匀浆法对真菌细胞破碎程度过高,使蛋白特征峰过低;载玻片挤压法造成细胞破碎不完全,特征蛋白没有完全释放;热处理法操作简便,所得蛋白提取物的离子峰背景噪音最低,特征峰数量最多,离子激发强度适中且峰谱明显。因此,选用热处理法作为样品预处理的最适方法。
2.2最适基质的确定
基质CHCA多用于多肽及小分子样品的分析,DHB多用于糖类及小分子样品的分析,SA多用于大于10 000 u的蛋白及大分子样品的分析。由图4至图6可知,3种植物病原真菌胞内提取物中DHB包被的糖类小分子成分无法激发出特征成分;SA背景噪音较高,并无特征峰谱。基质筛选试验表明,稻粒黑粉病病菌、稻曲病病菌、恶苗病病菌的细胞悬液提取物中特征成分主要为在质荷比小于10 000位置出现的多肽和小分子,以CHCA为基质获得的图谱较稳定,为最佳基质。
2.3点样方法的确定
由图7至图9可知,稻粒黑粉病病菌混合干燥法只得到质荷比 3 847、 6 829、 7 497等3个特征峰且2次平行点样重
复性较差,夾心点样法在质荷比2 615、3 814位置出现非特异性峰且背景噪音较高;稻曲病病菌混合干燥法在质荷比4 000之前背景噪音过高无法辨识特征峰,夹心点样法只能激发到质荷比4 414、8 823 等2个最强的峰值,其他强度不高的小峰不明显;恶苗病病菌混合干燥法出峰凌乱无规律,夹心点样法几乎未检测到特征物质且背景噪音较高。点样方法试验结果表明,覆盖干燥法中基质对特征蛋白的离子化程度较高,特征蛋白峰谱较清晰,并能有效降低MALDI-TOF-MS背景的干扰。
2.4标准试验方法重复性试验
由图10至图12可知,同一样品重复10次所得的特征峰谱一致,说明本试验所选的样品预处理方法、基质、点样方法稳定可行。3种病原真菌分别进行3次重复培养和预处理提取、点样等工作的MALDI-TOF-MS分析结果分别如图 13至图15所示,该方法从病原真菌的纯培养条件到 MALDI-TOF-MS鉴定的各个步骤所得的特征蛋白的指纹图谱一致、特征峰谱一致,说明病原真菌的鉴定结果可靠,重复性较好,特征峰谱数量多且丰度高。采用MALDI-TOF-MS自带专业分析软件 Biotyper 分别对稻粒黑粉病、 稻曲病、
恶苗病病原真菌图谱进行分析,得到病原真菌标准指纹图谱的特征峰信息如表1所示,在MALDI-TOF-MS鉴定方法相同并选用同种电离基质时,3种病原真菌在质荷比对应的位置应有的特征峰均出现。
3结论与讨论
在没有提取、分离和扩增的情况下,蛋白质作为最具特征性的物质可用于微生物的鉴定,而植物病原真菌的MALDI-TOF-MS鉴定准确性主要影响因素为预处理方法的差异[8-9]。预处理使用的75%乙醇法常用于破裂细菌细胞膜[10],但该方法对真菌的厚垣孢子类细胞壁加厚的样品并不能达到破裂效果。Adams等将病原菌经过75%乙醇破裂后再进行匀浆和超声处理[3],该方法在本试验中并未得到相似的结果,超声处理后细胞内蛋白小分子结构松散,不利于与基质结合。MALDI-TOF-MS技术在植物病原菌的鉴定和研究应用中要依靠病原菌指纹图谱数据库,建立足够种类的已知病原菌指纹图谱库才能实现最有效、最真实的鉴定结果[8],且应对病原菌进行归类,建立不同的预处理方法和标准基质以得到最稳定的结果,提高指纹图谱数据库比对的准确性。endprint
本试验对3种水稻病原真菌进行细胞内含物粗提取,沸水水浴30 min细胞壁破裂较完全,所得细胞内含物主要为胞内小分子粗蛋白,蛋白与基质CHCA所得MALDI-TOF-MS图谱背景较低,特征峰数量多且丰度高,经过多次重复试验,培养条件相同的情况下所得的蛋白指纹图谱重复性良好,该方法可用于细胞壁加厚类真菌样品的蛋白提取和MALDI-TOF-MS分析。
参考文献:
[1]Anne-Cécile N,Carole C,Stéphane R,et al. Assessment of various parameters to improve MALDI-TOF MS reference spectra libraries constructed for the routine identification of filamentous fungi[J]. BMC Microbiology,2013,13(1):76.
[2]Croxatto A,Prodhom G,Greub G. Applications of MALDI-TOF mass spectrometry in clinical diagnostic microbiology[J]. FEMS Microbiology Reviews,2012,36(2):380-407.
[3]Adams L L,Salee P,Dionne K,et al. A novel protein extraction method for identification of mycobacteria using MALDI-TOF MS[J]. Journal of Microbiological Methods,2015,119:1-3.
[4]Horká M,Kubesová A,Salplachta J,et al. Capillary and gel electromigration techniques and MALDI-TOF MS—suitable tools for identification of filamentous fungi[J]. Analytica Chimica Acta,2012,716(4):155-162.
[5]Chalupová J,Raus M,Sedlárˇová M,et al. Identification of fungal microorganisms by MALDI-TOF mass spectrometry[J]. Biotechnology Advances,2014,32(1):230-241.
[6]李鳳琴,吴多加,武淑真,等. 基质辅助激光解吸电离飞行时间质谱检测与鉴定食品真菌的研究[J]. 中国食品卫生杂志,2007,19(5):385-393.
[7]Brun S,Madrid H,van den Ende B G,et al. Multilocus phylogeny and MALDI-TOF analysis of the plant pathogenic species Alternaria dauci and relatives[J]. Fungal Biology,2013,117(1):32-40.
[8]冯建军,龙海,刘新娇,等. MALDI-TOF质谱技术鉴定植物病原体研究进展[J]. 植物检疫,2014(6):13-18.
[9]Bader O. MALDI-TOF-MS-based species identification and typing approaches in medical mycology[J]. Proteomics,2013,13(5):788-799.
[10]Branquinho R,Sousa C,Lopes J,et al. Differentiation of Bacillus pumilus and Bacillus safensis using MALDI-TOF-MS[J]. PLoS One,2014,9(10):e110127.江苏农业科学2017年第45卷第23期刘晓娜, 杜以梅, 杜予州. 扬州地区烟粉虱生物型检测及发生动态[J]. 江苏农业科学,2017,45(23):100-102.endprint

