人参根际防病促生放线菌的筛选及其活性
王呈玉+张浩+崔俊涛+焉莉+王玉军+王继红+王艳红

摘要:为开发防病促生生物菌肥种质资源,采用对峙培养法从人参根际土壤中分离具有拮抗植物病原真菌活性的放线菌,鉴别培养基筛选,结合分光光度计法,定性定量測定其产吲哚乙酸(IAA)、溶磷和产铁载体等促生活性,并对该放线菌进行生理生化和分子鉴定。结果表明,获得1株具有较强植物病原真菌拮抗活性的放线菌菌株,与淡紫灰链霉菌(Streptomyces lavendulae)的亲缘关系最近,将其命名为淡紫灰链霉菌菌株DC-A;同时该菌具有较强的产IAA、溶磷和产铁载体促生活性,可以为后续防病促生菌剂的研制提供新的材料。
关键词:植物根际促生菌;吲哚乙酸;溶磷作用;铁载体;分子鉴定;拮抗活性
中图分类号: S435.675文献标志码: A文章编号:1002-1302(2017)23-0103-04
植物根际促生菌是土壤中的重要组成部分,它们直接或间接地促进植物的生长,参与土壤各种营养元素的生物地球化学循环和可持续的农作物生产[1,3]。植物根际促生菌通过在植物根际土壤中协助植物获取营养元素、动员土壤中难溶性的营养物质、分泌植物生长调节剂和抗病活性物质等次生代谢产物促进植物生长和抑制植物病害的发生[1,3-13]。因此,筛选各种植物根际促生菌,并对其防病促生活性进行研究,可以为PGPR菌剂的开发和应用提供优质的菌种材料,从源头上减少农业生产对化学肥料和农药的依赖,创造可持续发展的农业生产环境。
从人参根际土壤中分离得到1株具有较强生物防治功能的放线菌淡紫灰链霉菌菌株DC-A(Streptomyces lavendulae strain DC-A),该菌还具有产吲哚乙酸(indoleacetic acid,简称IAA)、溶解无机磷和产生铁载体的促生活性,可为开发人参专用型PGPR菌剂提供优良的菌种,从而解决人参种植过程中由于农药的施用导致的人参品质下降问题。
1材料与方法
1.1土壤样本的来源
采集吉林省集安市和抚松市人参主产区人参根际土壤,放入自封袋中,置于4 ℃冰箱中保存。
1.2供试病原菌来源
人参立枯丝核病菌(Rhizoctonia solani Kuhn)、人参菌核病菌(Sclerotinia libertiana Fuck.)、人参枯萎病菌(F. oxysporum)、人参根腐病菌(Fusarium solani)、人参黑斑病菌(Alternaria panax)、禾谷镰孢菌(F. graminearum)、玉米大斑病菌(Exserohilum turcicum)、黄瓜枯萎病菌(F. oxysporium f.sp.cucumerinum)、串珠镰孢菌(F. moniliforme)、玉米弯孢叶斑病菌(Curvularia lunata)、番茄灰霉病菌(Botrytis cirerea)、烟草赤星病菌(Alternaria alternata)、辣椒炭疽病菌(Colletotrichum capsici)、白菜软腐病菌(Erwinia carotovora var.carotovora)、十字花科蔬菜黑腐病菌(Xanthomonas campestris var.campestris)、茄科青枯病菌(Ralstonia solanacearum)。以上菌株均由吉林农业大学农学院植物病理实验室提供。
1.3人参根际土壤具有拮抗活性的放线菌的筛选
称取10 g人参根际土壤,采用稀释平皿分离法,在放线菌分离培养基(可溶性淀粉20.00 g,KNO3 1.00 g,NaCl 0.50 g,MgSO4·7H2O 0.50 g,K2HPO4·3H2O 0.50 g,FeSO4·7H2O 0.01 g,琼脂18.00 g,蒸馏水1 L,pH值7.5~8.0。)表面分离土壤中的放线菌;经纯化后的放线菌菌株,于-20 ℃(用甘油保存)和4 ℃冰箱中保存。
以16种引起植物病害的病原真菌为指示菌,采用对峙培养法,筛选具有拮抗活性的放线菌。在PDA培养基表面一端接种指示菌,另一端接种人参根际放线菌,每组试验重复3次,培养至病原菌长满整个培养皿时结束,以抑菌带宽度确定放线菌的拮抗活性。以不接放线菌的平板作对照。
1.4人参根际放线菌促生活性检测
1.4.1产IAA活性的定性和定量测定采用Salkowski比色法对具有拮抗活性的人参根际放线菌进行产IAA活性测定。将放线菌分别接种于含L-色氨酸终浓度为0.5、1.0 g/L 的高氏1号液体培养基中,28 ℃摇床培养,14 d后吸取5 mL发酵液10 000 r/min离心10 min,吸取4 mL上清加入等体积的Salkowski显色剂,充分混匀,室温避光显色 30 min,出现粉色为阳性,说明具有产IAA活性[14]。快速将反应液在530 nm处测定吸光度(D530 nm)。以不添加色氨酸的培养基为对照,以标准品IAA对应的光密度作标准曲线,计算IAA的产量(mg/L)。
1.4.2溶磷活性的测定将具有拮抗活性的人参根际放线菌接种于液体高氏1号培养基,进行扩大培养7 d,8 000 r/min 离心5 min收集菌体,用去离子水重悬菌体沉淀后 8 000 r/min 离心5 min,每次操作重复3次,将菌体表面的高氏1号培养基成分洗净,无菌操作称取0.3 g菌体(湿质量)接种于100 mL PKO液体培养基中,28 ℃摇床培养14 d,采用钼锑抗比色法测定不同培养时间发酵液有效磷含量,对具有拮抗活性的人参根际放线菌进行溶磷活性测定[15]。以不接菌的培养基为对照。
1.4.3产铁载体活性的定性分析将具有拮抗活性的人参根际放线菌接种于CAS培养基表面,28 ℃培养14 d,观察菌落周围是否有透明圈[16]。
1.5人参根际促生放线菌的鉴定endprint
1.5.1人参根际促生放线菌的培养特征和生理生化特性鉴定采用插片法观察人参根际促生放线菌菌丝体形态,并参照范丽霞等的方法[17],采用国际链霉菌计划培养基(ISP),將溶磷放线菌菌株分别接种到酵母膏麦芽膏琼脂培养基(ISP2)、燕麦粉琼脂培养基(ISP3)、无机盐淀粉琼脂培养基(ISP4)、甘油天门冬酰胺琼脂培养基(ISP5)、蛋白胨酵母膏铁盐琼脂培养基(ISP6)、酪氨酸琼脂培养基(ISP7)、察氏培养基上,28 ℃培养20 d,观察并记录菌株在7种不同培养基上的培养特征。
参照徐丽华等的方法[18]进行人参根际促生放线菌的生理生化特征鉴定。
1.5.2人参根际促生放线菌的分子鉴定将具有防病促生活性的人参根际放线菌接种于高氏1号液体培养基中,28 ℃摇床培养7 d,离心收集菌体后抽真空冷冻干燥48 h。冷冻干燥后的菌体,提取基因组DNA。参照Hamdali等的方法[19]进行16S rDNA扩增。扩增产物送生工生物工程(上海)股份有限公司测序,用Clustal W将测序结果与GenBank中相关的16S rRNA序列进行比对,通过MEGA 6.0软件对菌株进行系统发育分析,采用邻接法构建系统进化树,用Bootstrap法(1 000 次重复)检验。
2结果与分析
2.1人参根际放线菌抑菌谱的测定
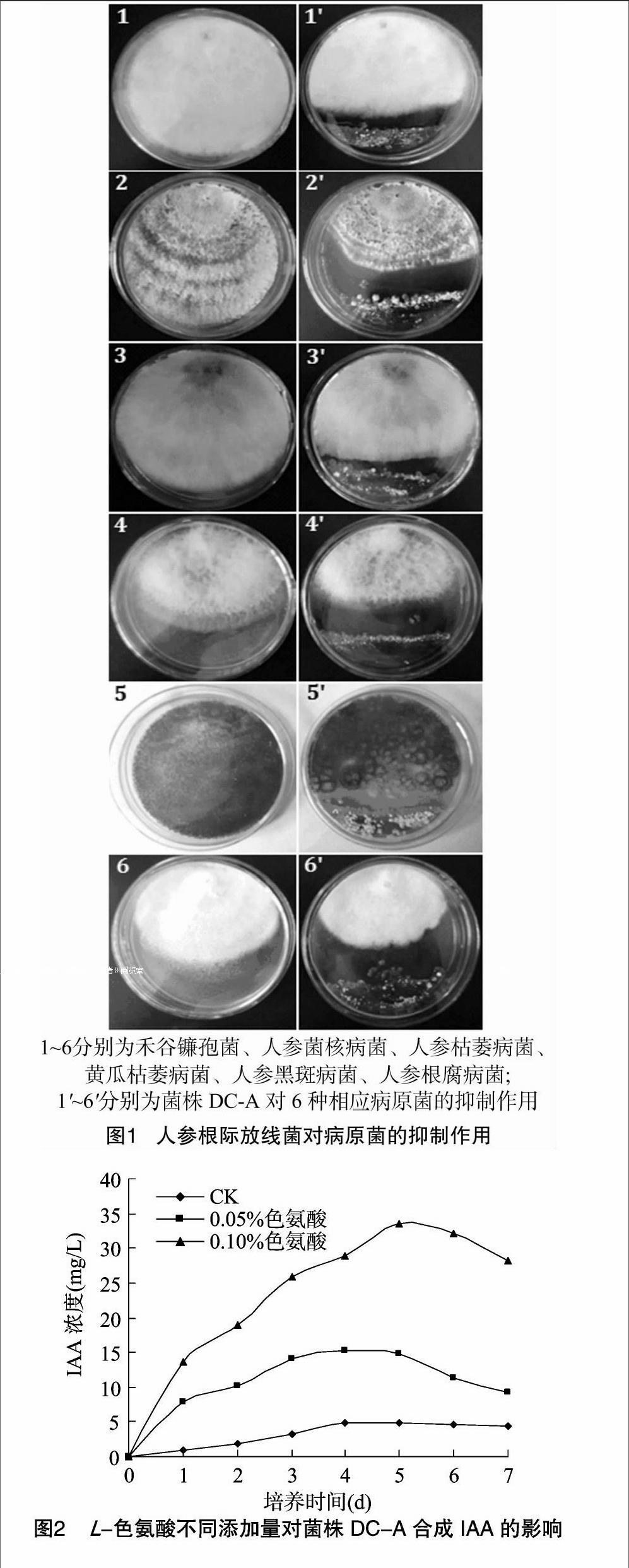
对分离到的人参根际放线菌进行培养皿内拮抗试验,获得1株对病原真菌具有较强拮抗活性的放线菌菌株,命名为DC-A。由图1可以看出,菌株DC-A对禾谷镰孢菌、人参菌核病菌、人参枯萎病菌、黄瓜枯萎病菌、人参黑斑病菌和人参根腐病菌具有较强的抑菌效果,其抑菌带宽度分别为 10.1、19.6、7.5、5.8、8.2、4.2 mm。
2.2人参根际放线菌促生活性检测
2.2.1菌株DC-A产IAA活性的定性和定量测定结果由图2可知,人参根际放线菌DC-A具有合成IAA的能力。IAA含量随L-色氨酸(L-trp)添加浓度的增大而增大,不添加色氨酸时,菌株DC-A的IAA合成量最高达4.96 mg/L;色氨酸添加浓度为0.05%、0.10%时,菌株DC-A合成IAA的量明显高于对照组,最高合成量分别为15.36、33.59 mg/L。
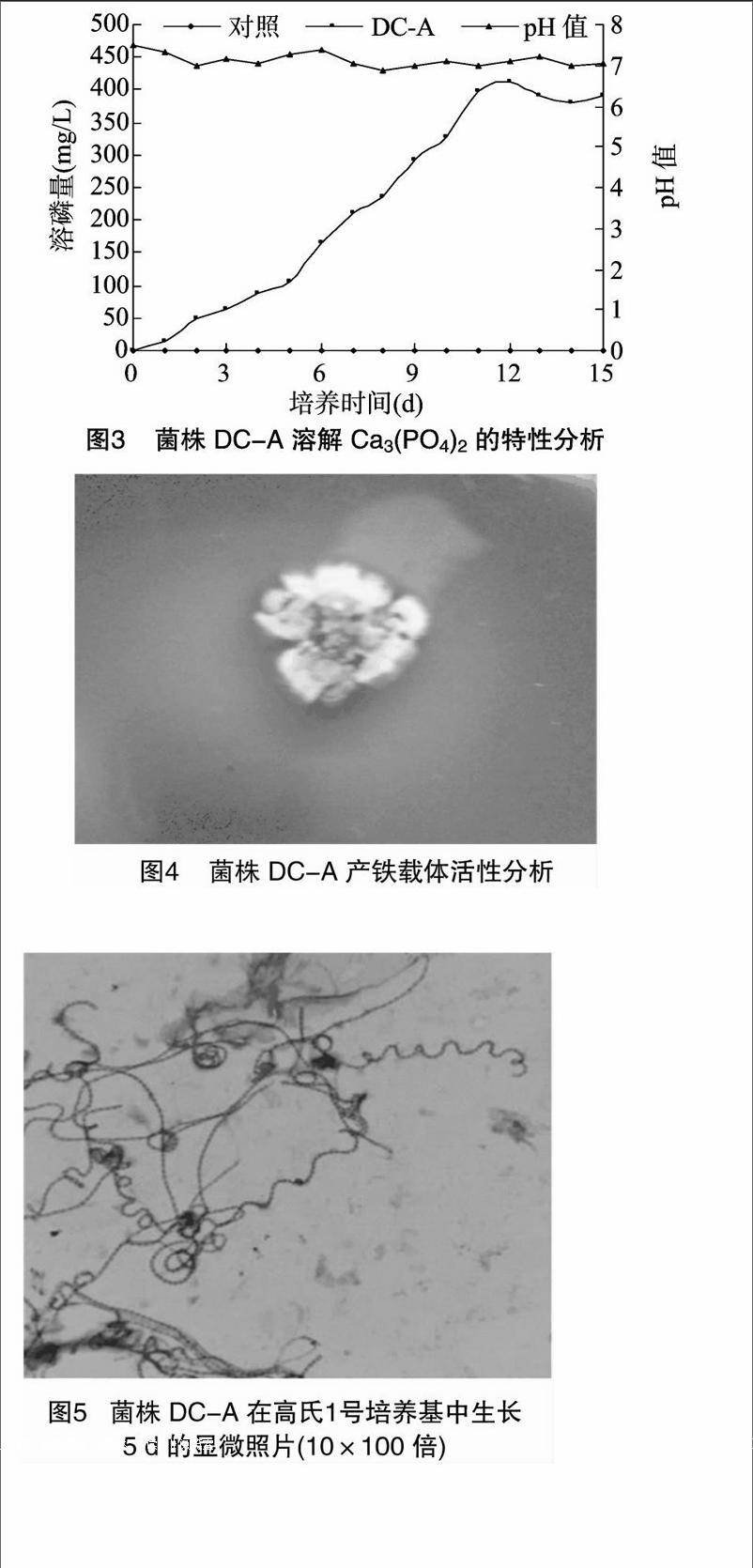
2.2.2菌株DC-A溶无机磷活性测定由图3可知,人参根际放线菌菌株DC-A在以Ca3(PO4)2为唯一磷源的PKO液体培养基中,具有明显的溶磷特性,15 d内菌株的溶磷量呈现先升高后下降的趋势,在12 d前溶磷量呈明显增加趋势,在12 d达到最高溶磷量410.95 mg/L。相应发酵液的pH值并没有同溶磷量表现出对应的趋势,而是在pH值为7.0上下波动。由此可以看出,人参根际放线菌菌株DC-A在以Ca3(PO4)2为唯一磷源的PKO液体培养基中出现的明显溶磷特性与发酵液pH值变化不相关,菌株DC-A的溶磷机制还有待进一步研究。
2.2.3菌株DC-A产铁载体活性鉴定由图4可知,将人参根际放线菌DC-A接种于CAS固体平板培养14 d后,在其菌落周围出现明显的橙红色颜色圈,说明人参根际放线菌DC-A具有合成铁载体的活性。
2.3人参根际促生菌株DC-A的鉴定
2.3.1菌株的形态特征菌株DC-A在固体高氏1号培养基上生长良好,气丝绒状,浅灰色至灰色。基丝粉紫色、红紫色和紫色,可溶色素同基丝色。气生菌丝发达,孢子丝螺旋形,可达10圈,呈现典型的链霉菌形态特征,结果如图5所示。
2.3.2菌株的培养特征高氏合成1号琼脂:气丝灰色,绒状,基丝粉紫色。酵母膏麦芽膏琼脂培养基(ISP2):气丝丰茂,灰粉色带薰衣草色彩,基丝丰茂,无色至弱褐色,可溶色素栎褐色。燕麦粉琼脂培养基(ISP3):气丝灰粉色带薰衣草色彩,基丝无色,无可溶色素。无机盐淀粉琼脂(ISP4):气丝丰茂,黄灰色,基丝无色,可溶色素黄色。甘油天门冬酰胺琼脂培养基(ISP5):气丝弱,褐灰色至银灰色,基丝好,无色,无可溶色素。蛋白胨酵母膏铁盐琼脂培养基(ISP6):气丝不发达,灰粉色带薰衣草色,基丝好,无色,可溶色素弱褐色。酪氨酸琼脂(ISP7):气丝丰茂,红灰色带薰衣草色彩,基丝好,弱褐色至芥褐色,可溶色素无至弱褐色。察氏培养基:气丝弱,灰色,基丝好,无可溶色素。结果如图6所示。
2.3.3菌株的生理生化特性生理生化试验表明,菌株 DC-A 能使明胶液化、牛奶凝固并胨化、淀粉水解、硝酸盐还原、纤维素水解、在蛋白胨酵母精铁琼脂和营养琼脂内产生褐色素,但不产生硫化氢(H2S)、黑色素。碳源利用结果显示,菌株利用D-葡萄糖、L-阿拉伯糖、蔗糖以及麦芽糖、醋酸钠、柠檬酸钠、琥珀酸钠;对D-果糖和D-木糖利用较差;不利用棉子糖、肌醇、D-甘露醇、L-鼠李糖以及L-乳糖。
2.3.4菌株的16S rDNA鉴定参照Hamdali等的方法[19],以菌株DC-A总DNA为模板,对DC-A菌株的16S rDNA进行PCR扩增,得到长度为1 418 bp的扩增产物。将测序结果在GenBank中利用Blast软件进行同源性序列比对,构建系统发育树,如图7所示。菌株DC-A与已报道的淡紫灰链霉菌亲缘关系最近,同源性达99%,与Blast结果一致。因此,菌株DC-A在分类学地位上初步确定为淡紫灰链霉菌菌株DC-A。
3结论与讨论
综上所述,从人参根际土壤中分离得到1株具有抗多种植物真菌病害功能的放线菌淡紫灰链霉菌菌株DC-A。该菌兼具产IAA、铁载体和溶解无机磷的功能。淡紫灰链霉菌菌株DC-A为人参根际专用防病促生菌剂的开发提供了优
质的资源。
致谢:研究中所用植物病原真菌均来自吉林农业大学植物病理实验室,特此表示感谢。
参考文献:
[1]Pankhurst C E,Lynch J M. The role of soil microbiology in sustainable intensive agriculture[J]. Advances in Plant Pathology,1995,11:229-247.endprint
[2]Singh J S,Pandey V C,Singh D P. Efficient soil microorganisms:a new dimension for sustainable agriculture and environmental development[J]. Agriculture,Ecosystems & Environment,2011,140(3):339-353.
[3]Ahemad M,Kibret M. Mechanisms and applications of plant growth promoting rhizobacteria:current perspective[J]. Journal of King Saud University-Science,2014,26(1):1-20.
[4]Behera B C,Singdevsachan S K,Mishra R R,et al. Diversity,mechanism and biotechnology of phosphate solubilising microorganism in mangrove—a review[J]. Biocatalysis and Agricultural Biotechnology,2014,3(2):97-110.
[5]Hamdali H,Hafidi M,Virolle M J,et al. Growth promotion and protection against damping-off of wheat by two rock phosphate solubilizing actinomycetes in a P-deficient soil under greenhouse conditions[J]. Applied Soil Ecology,2008,40(3):510-517.
[6]Acevedo E,Galindo-Castaneda T,Prada F,et al. Phosphate-solubilizing microorganisms associated with the rhizosphere of oil palm (Elaeis guineensis Jacq.) in Colombia[J]. Applied Soil Ecology,2014,80:26-33.
[7]王春红,武志海,孙合美,等. 大豆根际无机磷细菌Klebsiella sp. Wj6的分离鉴定与溶磷特性分析[J]. 南京农业大学学报,2015,38(4):560-567.
[8]Chandler D,Davidson G,Grant W P,et al. Microbial biopesticides for integrated crop management:an assessment of environmental and regulatory sustainability[J]. Trends in Food Science & Technology,2008,19(5):275-283.
[9]鄧振山,党军龙,张海州,等. 植物根际促生菌的筛选及其对玉米的促生效应[J]. 微生物学通报,2012,39(7):980-988.
[10]Kesaulya H,Zakaria B,Syaiful S A. Isolation and physiological characterization of PGPR from potato plant rhizosphere in medium land of Buru Island[J]. Procedia Food Science,2015,3:190-199.
[11]Park K H,Lee C Y,Son H J. Mechanism of insoluble phosphate solubilization by Pseudomonas fluorescens RAF15 isolated from ginseng rhizosphere and its plant growth‐promoting activities[J]. Letters in Applied Microbiology,2009,49(2):222-228.
[12]Grobelak A,Napora A,Kacprzak M. Using plant growth-promoting rhizobacteria (PGPR) to improve plant growth[J]. Ecological Engineering,2015,84:22-28.
[13]张东艳,刘晔,吴越,等. 花生根际产IAA菌的筛选鉴定及其效应研究[J]. 中国油料作物学报,2016,38(1):104-110.
[14]吴翔,甘炳成,黄忠乾,等. 一株产IAA菌株的筛选、鉴定及培养条件优化[J]. 四川农业大学学报,2014,32(4):432-435,461.
[15]Alam S,Khalil S,Ayub N,et al. In vitro solubilization of inorganic phosphate by phosphate solubilizing microorganisms (PSM) from maize rhizosphere[J]. Int J Agric Biol,2002,4(4):454-458.
[16]Milagres A M F,Machuca A,Napoleao D. Detection of siderophore production from several fungi and bacteria by a modification of chrome azurol S (CAS) agar plate assay[J]. Journal of Microbiological Methods,1999,37(1):1-6.
[17]范丽霞,李红兵,宗兆峰,等. 抗菌蛋白磷酸盐结合蛋白前体的分离及其产生菌的鉴定[J]. 农药学学报,2012,14(5):489-496.
[18]徐丽华,李文均,刘志恒,等. 放线菌系统学——原理、方法及实践[M]. 北京:科学出版社,2007:40-45.
[19]Hamdali H,Bouizgarne B,Hafidi M,et al. Screening for rock phosphate solubilizing Actinomycetes from Moroccan phosphate mines[J]. Applied Soil Ecology,2008,38(1):12-19.江苏农业科学2017年第45卷第23期徐强,张子默,卢俊成,等. 黄瓜若干品质性状的选择指数构建与应用[J]. 江苏农业科学,2017,45(23):107-111.endprint

