1株高产铁载体菌株的筛选鉴定以及化感作用的验证
曹宏丽,郝尚华,楚梦晓,邱爽,罗梦香,王明道
(河南农业大学农业农村部农业微生物酶工程重点实验室,河南 郑州 450002)
铁(Fe)是植物生长必需的矿物营养元素,在植物的呼吸作用、光合作用以及氮代谢中起着重要的作用。在中国,土壤中的全铁含量较高,但大多以难溶的氧化铁形式存在,有效态铁含量较低,仅为总量的千分之一甚至万分之一[1-2]。施肥会影响土壤中营养含量的变化,特别是中性及弱碱性土壤,该类土壤含有大量的锰、铜、锌等微量元素,严重缺钾或施用大量厩肥、磷肥都会导致该类土壤中严重缺铁[3]。由于植物只能吸收利用土壤中有效态铁,因此,为了满足植物生长发育需求,提高土壤中有效态铁的含量就十分重要。当植物遭受缺铁胁迫时,根系被诱导向根际环境分泌大量有机小分子化合物来提高铁的有效性[4]。这种根系分泌物能够改变根际土壤的理化性质,提高矿物养分的生物有效性,还可以作为微生物碳源、氮源和营养物质促进植物生长。此外,根系分泌物还可以选择性改变根际微生物群落结构和数量[5]。金崇伟[6]将红三叶草在缺铁土壤以及人为添加植物根系分泌物土壤进行培养后发现,2种土壤中微生物群落都发生变化,其中,产铁载体(siderophores)能力强的微生物数量剧增。铁载体是大多数细菌和真菌在铁胁迫状态下,通过体内合成和分泌的能与Fe3+特异性紧密螯合成螯合物的小分子化合物。铁载体通过提高铁的生物有效性来满足自身生长需求[7]。铁载体按照螯合基团类型可分为儿茶酚型、α-羟基羧酸型(又称柠檬酸型)和异羟肟酸型[8]。目前,国内外对分泌铁载体的植物根际促生菌以及植物内生菌等研究较多[9-10]。然而,细菌在生长代谢和快速繁殖过程中,为了获得铁元素而分泌出的各种类型铁载体,对于植物而言就成为了强有力的毒力因子。细菌会与植物竞争性摄取有限的铁资源,干预植物的铁吸收,甚至利用植物中的铁,严重影响植物的正常生长[11]。王国庆等[12]研究发现,地黄含有大量的铁元素,在干地黄中铁含量高达2.4 mg·kg-1,而种植地黄的碱性土壤中有效铁含量小于2.3 mg·kg-1。有限的铁元素会导致细菌大量分泌铁载体,从而对植物造成生物化感作用[13]。生物化感会对地黄造成连作障碍,导致土地在种植地黄1 a之后,要等8~10 a才可以再次种植[14],并且重茬地黄味苦形瘦,不宜入药,严重阻碍道地产区经济发展和地黄产业的可持续发展[15-16]。
因此,本研究从饱受连作障碍影响的地黄入手,从种植过地黄的3种土壤中分离出1株高产铁载体菌株,对其进行形态学观察以及生理生化鉴定,鉴定为恶臭假单胞菌(Pseudomonasputida) S2,并在此基础上优化该菌的产铁载体发酵条件。由于怀地黄是异花授粉植物,其种子不能留种,在实际生产中多以块根营养繁殖[17],而拟南芥植株较小、生长周期短且形态特征分明,更适合判断铁载体对植物根的影响,因此,本研究选用拟南芥作为生物测定的植物材料,通过分析S2菌株所产铁载体对拟南芥主根的生物化感作用,以期为解决植物连作障碍提供新的思路。
1 材料与方法
1.1 材料
1.1.1 取材方法 采用“5点取样法”,在河南南阳新野县地黄种植大田(种植地黄期间未种植其他作物),分别取地黄头茬土(T)、重茬土(C)和三茬土(S),共3个土样。
1.1.2 生物检测材料 以河南农业大学农业部农业微生物酶工程重点实验室保存的拟南芥DR5:GUS 种子为生物测定材料。
1.1.3 仪器与试剂 DHP-9082d型电热恒温培养箱(上海申贤恒温设备厂);IS-RDV1型立式恒温摇床(美国精骐有限公司);MEGAFUGE 8R型高速冷冻离心机(Thermo scientific公司);ARKTIK Thermal Cycler PCR仪(Thermo scientific公司)。AXIO光学显微镜(欧波有限公司);DNA提取试剂盒(北京天根生化科技有限公司);MS粉(Murashige&Skoog Basal Medium with Vitamins,Phyto Technology Laboratories)。薄层色谱硅胶板(GF254)、柱层析硅胶(75~150 μm)、XAD-2大孔吸附树脂购自青岛海洋化工有限公司;明胶、十六烷基三甲基溴化铵(HDTMA)、铬天青购于天津市致远化学试剂有限公司;琼脂粉购于北京索莱宝科技有限公司;无水哌嗪购于上海麦克林生化科技有限公司;其余试剂采购于天津市科密欧化学试剂有限公司,分析纯。
1.1.4 培养基 CAS检测液:(1)母液:10 mmol·L-1十六烷基三甲基溴化铵(HDTMA),1 mmol·L-1FeCl3加83 μL HCl 混匀,2 mmol·L-1铬天青;(2)1.5 mL FeCl3混合液与7.5 mL铬天青、6.0 mL HDTMA、4.307 g无水哌嗪溶于30 mL去离子水,加6.25 mL HCl后定容至100 mL。
CAS培养基:蔗糖 2 g,酸水解酪蛋白(SOLARBIO)3 g,磷酸缓冲液(0.1 mol·L-1,pH6.8)5 mL,CaCl2(1 mmol·L-1)1 mL,CAS 检测液250 mL,琼脂粉40 g,去离子水补足1 L;121 ℃灭菌30 min。LB培养基:胰蛋白胨10 g,酵母提取物5 g,NaCl 10 g,pH值7.0,去离子水补足1 L。固体培养基另加琼脂粉20 g。
培养基A(KMB培养基):丙三醇15 mL,无铁酪蛋白氨基酸5 g,KH2PO42.5 g,MgSO4·7H2O 2.5 g,去离子水定容到1 L。固体培养基另加琼脂粉18 g。培养基B(富铁KMB培养基):在培养基A(1 L)基础上加入FeSO4·7H2O共0.027 8 g。MS培养基:MS粉2.2 g,蔗糖10 g,调pH值至5.78~5.82,添加琼脂粉10 g,去离子水1 L,高压蒸汽灭菌121 ℃、30 min。
1.2 土壤中产铁载体菌株的分离以及高产铁载体菌株的筛选
将3种土样(T、C、S)各10 g分别加入含90 mL无菌水和玻璃混匀珠的250 mL三角瓶中,震荡15 min制成菌悬液;采用涂布分离法,于无菌条件下,取3个稀释度(10-1、10-2、10-3)溶液各100 μL通过无铁涂布棒涂布在CAS平板上;在28 ℃恒温培养箱中倒置培养24 h;待有菌落出现,观察菌落数,挑取菌落周围产生明显的橙(棕)黄色铁螯合圈的菌落,挑选此菌落反复划线分离,获得纯菌株,转接在LB斜面培养基上,4 ℃保存备用。用无铁接种环将产铁载体菌株从LB斜面培养基接种至培养基A(5mL)中,在恒温震荡箱中28 ℃、200 r·min-1震荡培养24 h进行活化。
1.3 菌株产铁载体能力的测定以及生物化感作用测定
1.3.1 菌株产铁载体能力的测定 菌株产铁载体能力以其产铁载体含量计。将活化的菌种取0.5 mL转接到培养基A和培养基B(50 mL)中扩培36 h,取12株初筛菌株对应的培养基A和培养基B菌液用在4 ℃、10 000 r·min-1条件下离心10 min,保留上清液。V(培养基上清液)∶V(CAS检测液)=1∶1混合反应10 min后,在OD630下,以去离子水为对照,按照下列公式计算铁载体含量:
Su=(Ar-A)/Ar×100%
(1)
式中:Su为铁载体含量;Ar为所测培养基B上清液的OD值;A为所测培养基A上清液的OD值。
1.3.2 铁载体生物化感作用测定 菌株用培养基A和培养基B培养后,在4 ℃、10 000 r·min-1条件下离心10 min得5 mL对应上清液,分别加入100 mL MS培养基中,空白对照(CK)不加上清液,将适量的拟南芥种子用体积分数2.5%次氯酸钠浸泡消毒10 min后用无菌水冲洗3遍,以1次数1颗种子为宜。在凝固的MS培养基1/3处点拟南芥种子,种子在1条水平线上并保持合适的距离,点好的拟南芥种子在4 ℃条件下春化2 d,之后取平板垂直插放于平板架,使横排种子平行于地面,在22 ℃光照培养箱中培养9 d后测拟南芥主根根长度。
1.4 高产铁载体菌株的鉴定
1.4.1 菌株的形态学鉴定及生理生化鉴定 参照文献[18]通过细菌的革兰氏染色法对筛选到的高产铁载体菌株进行形态学鉴定。
1.4.2 菌株的分子生物学鉴定 将待鉴定菌株用LB液体培养基培养24 h后,于4 ℃、5 000 r·min-1离心10 min后回收菌体,提取菌株基因组。DNA的提取与纯化参照MARMUR法[19]及氯仿-苯酚混合法[20],用细菌通用引物27F和1492R进行PCR扩增,委托江苏金唯智生物科技有限公司进行DNA测序,将获得的序列在GenBank核酸数据库(https://www.ncbi.nlm.nih.gov/)进行BLAST比对分析。
1.4.3 菌株的生理生化鉴定 参照HOLT等[21]的方法进行菌株生理生化鉴定。
1.5 高产铁载体菌株产铁载体条件的优化
1.5.1 高产铁载体菌株生长曲线测定以及培养时间确定 高产铁载体菌株于28 ℃、200 r·min-1条件下在50 mL培养基A中培养12 h,之后取1 mL菌液转接到100 mL培养基A中(设置3个重复),0~16 h每隔2 h取1次样,待菌株生长稳定后在24、36、48 h各取1次样,在OD600条件下进行测定。对应生长曲线的铁载体含量按1.3.1的方法进行测定,并结合生长曲线确定菌株的培养时间。
1.5.2 高产铁载体菌株产铁载体单因素试验 取活化的高产铁载体菌株0.5 mL转接到培养基A和培养基B中,考察温度(24、26、28、30、32、34、36、38 ℃)、转速(120、140、160、180、200、220 r·min-1)、pH值(6.0、7.0、8.0、9.0、10.0)对其产铁载体能力的影响。
1.5.3 高产铁载体菌株产铁载体正交试验 在单因素试验的基础上,选取温度(26、28、30℃)(A)、转速(160、180、200 r·min-1)(B)、pH值(8.0、9.0、10.0)(C)为因素,设计成3因素3水平菌株S2产铁载体的正交试验,因素水平如表1所示。

表1 高产铁载体菌株产铁载体正交试验设计Table 1 Design of orthogonal experiment of high-yielding siderophore strain siderophore-producing
1.6 铁载体的分离纯化以及生物化感测定
1.6.1 大孔吸附树脂分离铁载体结果 取高产铁载体菌株的转化产物,4 ℃下10 000 r·min-1离心10 min。用XAD-2大孔吸附树脂动态吸附上清液,之后经过质量分数25%,50%,75%和100%甲醇溶液梯度洗脱树脂,洗脱液用薄层色谱法(thin-layer chromatography,TLC)[22]进行检测,展开条件为V(无水乙醇)∶V(NaOH(1 mol·L-1))∶V(水)=1∶0.5∶8.5。
1.6.2 硅胶柱层析分离铁载体结果 取经XAD-2初步纯化后的铁载体样品进一步硅胶纯化。采用干法上样[23]称硅胶1 g与3 mL 待纯化样品搅拌均匀,60 ℃干燥后装入层析柱样品层,厚度为0.5 cm。按照无水乙醇、V(无水乙醇)∶V(水)=2∶8、V(无水乙醇)∶V(NaOH(1 mol·L-1))∶V(水)=1∶0.5∶8.5、V(无水乙醇)∶V(NaOH(1 mol·L-1))∶V(水)=0.5∶0.5∶9共4个极性梯度进行层析,每10 mL为1管,通过TLC法检测纯化效果。
1.6.3 纯化铁载体生物化感作用验证 取纯化后的铁载体2 mL与空白土浸液混合配制MS培养基进行拟南芥的生物测定,以空白土和纯化铁载体为对照,以抑制拟南芥主根根长度为检测铁载体抑制作用的依据,具体参考1.3.2方法。
1.7 数据处理
在Design-Export软件上进行作图及统计分析,显著性分析采用Duncan法进行。
2 结果与分析
2.1 产铁载体菌株的分离以及高产铁载体菌株的筛选
以CAS平板上菌落周围产生橙(棕)黄色铁螯合圈为筛选产铁载体菌株的依据,从T、C、S这3种土壤中粗筛分离到20株产铁载体菌株;分离纯化后,通过对菌株外观形态的观察,每种土样各4株,分别命名为T1、T2、T3、T4、C1、C2、C3、C4、S1、S2、S3以及S4。
2.2 纯化菌株产铁载体能力的测定
2.2.1 初筛菌株产铁载体能力的测定 对初步筛选出的12株产铁载体细菌进行产铁载体能力的定量检测,结果见图1。从这12株产铁载体细菌中筛选到7株Su值在50%以上的产铁载体能力较强的菌株,按照产铁载体能力从大到小排序,分别为C4、S1、S2、S3、T2、C2以及T3。
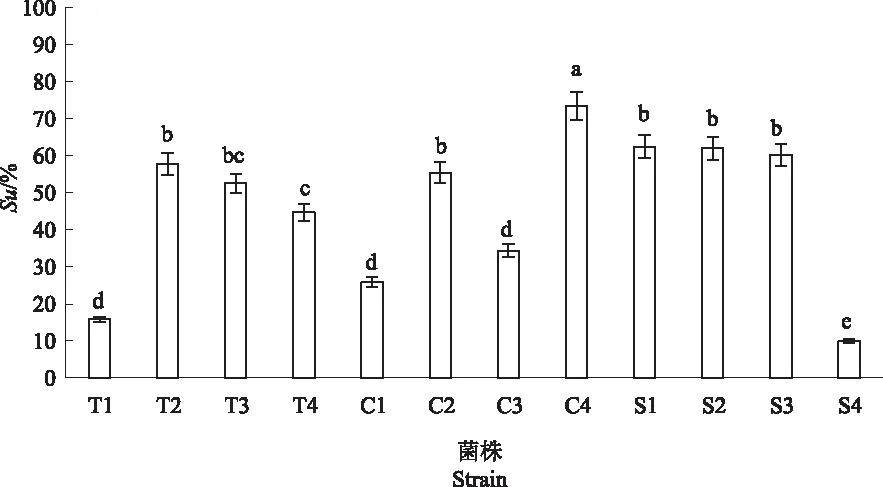
注:不同小写字母表示差异显著,P<0.05。下同。Note:Different lowercase letters indicate significant differences,P<0.05.The same as below.
2.2.2 初筛菌所产铁载体的生物化感测定 对筛选出的7株高产铁载体细菌的上清液进行生物化感作用的检测,结果见图2。菌株S2的含铁载体培养基A上清液相对于不含铁载体的培养基B上清液对拟南芥主根生长长度有显著抑制效果,其他菌株不明显,说明菌株S2的铁载体培养液上清对拟南芥的主根生长产生了生物化感作用。接下来以菌株S2为目标,对其进行菌株鉴定。
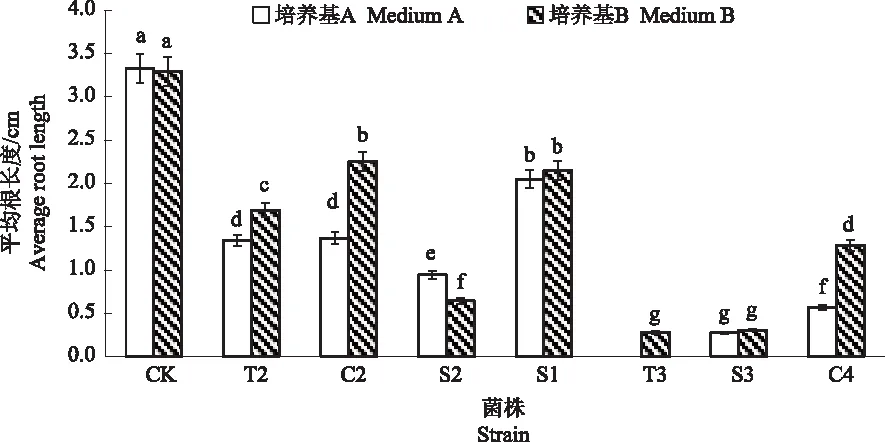
图2 高产菌株铁载体的化感作用检测结果Fig.2 The allelopathy detection results of siderophores of high yield strains
2.3 高产铁载体菌株的鉴定
2.3.1 菌株的形态学鉴定 菌株S2镜检以及平板观察结果如图3所示。菌株S2呈短杆形红色,是革兰氏阴性细菌;在CAS平板上有较大且明显的橙(棕)黄色铁载体螯合圈,说明菌株S2产铁载体能力很强;在培养基A平板上,菌株S2分泌出带有荧光的黄绿色素,该黄绿色素为青脓素(pyoverdine)。假单胞菌产生的青脓素可以用培养基A鉴定,推测菌株S2属于假单胞菌属。

注:A:菌株S2株革兰氏染色镜检结果(100×10);B:菌株S2CAS平板培养;C:菌株S2培养基A平板培养。Note:A:Microscopic staining results of S2 strain by Gram’s(100×10);B:S2 strain CAS plate culture;C:S2 strain medium A plate culture.
2.3.2 菌株的分子生物学鉴定 对菌株S2的全基因组DNA及其PCR产物的葡聚糖凝胶电泳检测,将菌株S2的PCR产物送去江苏金唯智生物科技有限公司测序。用NCBI-BLAST软件,对该菌株序列进行同源检索发现,如表2所示,菌株S2为假单胞菌属(Pseudomonas)。

表2 高产铁载体菌株S2的分子鉴定结果Table 2 Molecular identification of siderophore-producing S2 strain
2.3.3 菌株的生理生化实鉴定 假单胞菌属中的荧光假单胞菌、铜绿假单胞菌和恶臭假单胞菌3种假单胞菌都可以分泌青脓素,根据《常见细菌系统鉴定手册》[24]中铜绿假单胞菌能还原硝酸盐且在42 ℃生长、荧光假单胞菌能在4 ℃生长和液化明胶的特性,对菌株S2进行还原硝酸盐试验以及明胶液化试验,结果见图4所示。菌株S2还原硝酸盐试验为阴性,未产生氮气,不能在42 ℃生长,且明胶液化试验结果中也为阴性,不能在4 ℃生长。结合形态学、生理生化试验以及分子生物学结果,确定并命名该菌株为恶臭假单胞菌(Pseudomonasputida)S2。
2.4 菌株S2发酵条件的优化
2.4.1 菌株生长曲线测定以及培养时间确定 菌株S2在液体培养基A中生长曲线及对应铁载体含量测定结果如图5所示。由于菌株S2在12 h处于的稳定的对数生长期,因此选取12 h、OD600=1.31的菌液作为种子;随着培养时间的增加,在36~48 h时Su值稳定且此时铁载体量较高,故选择48 h作为菌株S2产铁载体的最适培养时间。
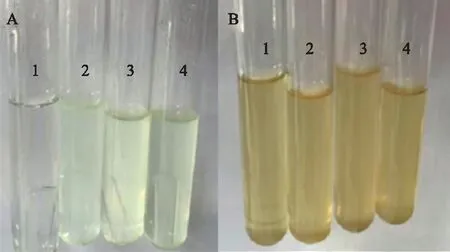
注:A:1,硝酸盐空白培养基;2~4,还原硝酸盐试验结果;B:1,明胶空白培养基;2~4,菌株S2明胶液化试验结果。Note:A:1,nitrate blank medium;2-4,test results of nitrate reduction by S2 strain;B:1,gelatin blank medium;2-4,test results of gelatin liquefaction by S2 strain.
2.4.2 菌株S2铁载体产量单因素试验 从图6可以看出,温度对菌株S2产铁载体能力影响相对较大。温度在28 ℃时,Su值最大为76.15%;当温度达到38 ℃时,Su值低至16.32%,因此,高温会影响菌株S2产铁载体能力。从图7可以看出,转速对菌株S2产铁载体能力影响相对较大。转速在180 r·min-1时Su值最大,为60.73%,而转速达到220 r·min-1时,Su值最小,为1.64%,因此,保持较低速有利于菌株S2产铁载体。从图8可以看出,培养基pH值为碱性时,Su值均在50%以上,pH值为9.0时Su值为71.56%,pH值为10.0时Su值为76.08%,因此,当pH值在8.0~10.0之间时,有利于菌株S2产铁载体。

图5 菌株S2产铁载体能力的检测结果及生长曲线Fig.5 The detection results to produe siderophores of the iron ability of S2 strain
2.4.3 S2产铁载体能力正交试验 在单因素试验的基础上,通过正交试验确定S2菌产铁载体的最佳条件,试验结果如表3所示。菌株S2产铁载体的最佳条件是A2B1C3,即最佳条件为温度为26 ℃、转速为180 r·min-1、pH 值为 10.0,此时Su值最大为64.37%,S2菌株产载体能力最强。通过极差R可知,影响菌株产铁载体量的主要因素是pH值,其次是温度,然后是转速。
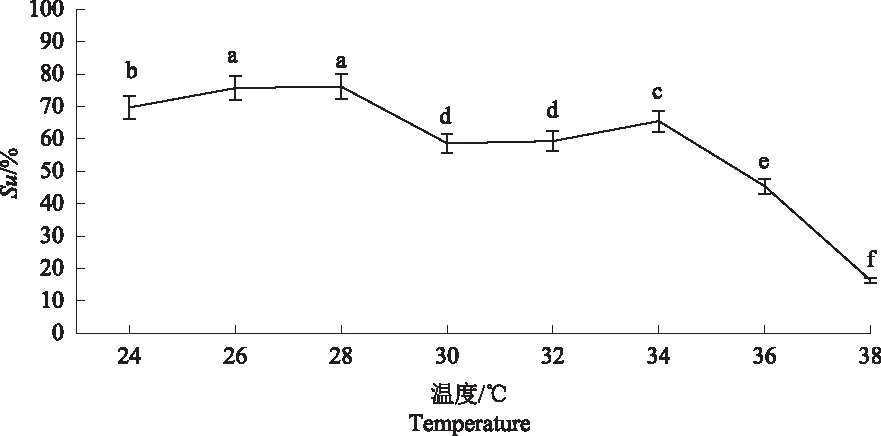
图6 不同温度下菌株S2产铁载体能力的检测结果Fig.6 The detection results of S2 strain to produce siderophores ability at different temperatures
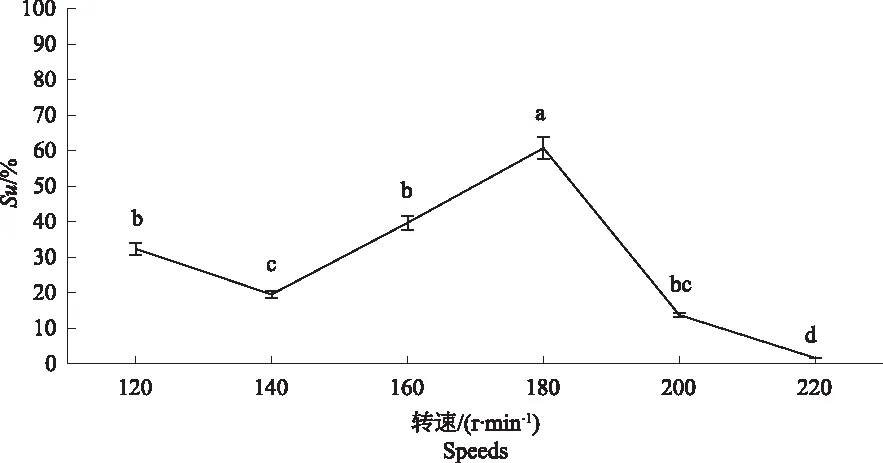
图7 不同转速下菌株S2产铁载体能力的检测结果Fig.7 The detection results of S2 strain to produce siderophores ability at different speeds
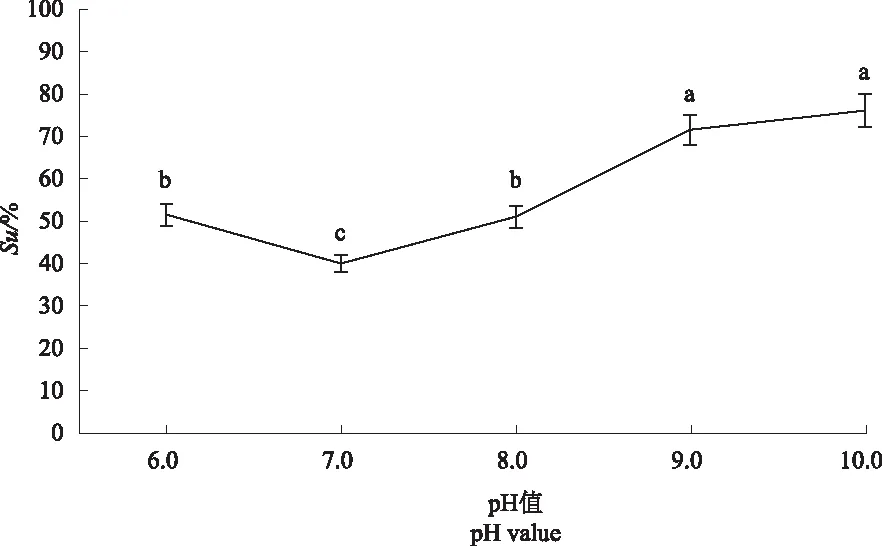
图8 不同pH值下菌株S2产铁载体能力的检测结果Fig.8 The detection results of S2 strain to produce siderophores ability at different pH values
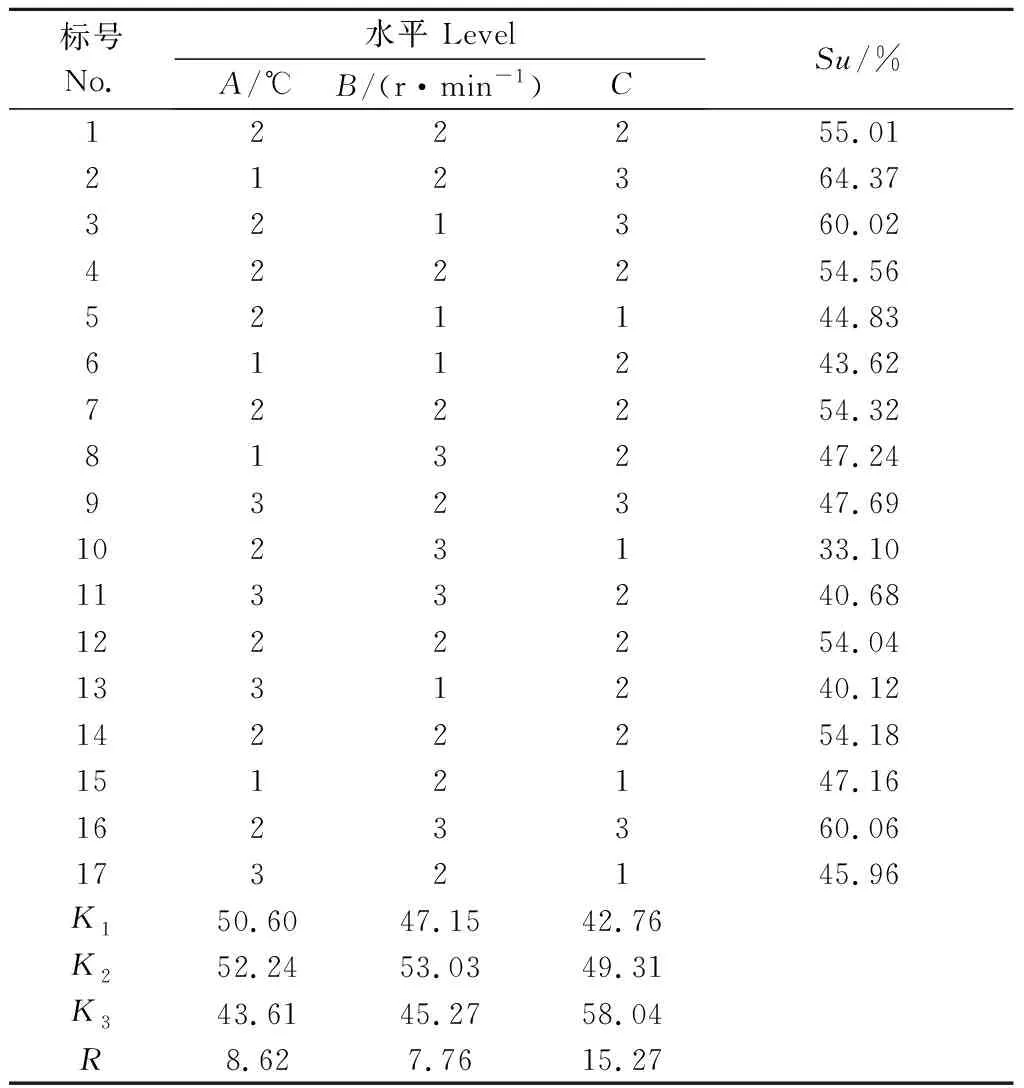
表3 铁载体含量正交试验结果Table 3 Orthogonal test design and results of siderophore content
2.5 铁载体的分离纯化与生物化感测定
2.5.1 大孔吸附树脂分离铁载体结果 由图9可知,经XAD-2大孔吸附树脂吸附后,菌株S2铁载体混合溶液中已检测不到铁载体,说明铁载体完全被吸附。经过不同梯度甲醇溶液的洗脱,使难以展开的混合铁载体分离开,但仍然存在拖尾,说明单一使用大孔吸附树脂吸附分离纯化铁载体效果不佳。铁载体主要在体积分数25%甲醇洗脱相中,继续用硅胶纯化该洗脱相中的铁载体。

注:1:菌株S2铁载体溶液;2:树脂吸附后的菌株S2铁载体溶液;3:体积分数25%甲醇洗脱相;4:体积分数50%甲醇洗脱相;5:体积分数75%甲醇洗脱相;6:体积分数100%甲醇洗脱相。Note:1:S2 strain iron carrier solution;2:S2 strain iron carrier solution after resin adsorption;3:25% methanol elution phase;4:50% methanol elution phase;5:75% methanol elution phase; 6:100% methanol elution phase.
2.5.2 硅胶柱层析分离铁载体结果 将硅胶用4个极性梯度进行纯化后,经过TLC检测,结果表明,在V(无水乙醇)∶V(水)=2∶8的极性中存在铁载体,将该梯度洗脱液的9个管进行TLC检测,结果如图10所示,可以明显看到含有2种发出荧光的铁载体,大极性载体集中在第4~9管,小极性载体集中在2管。将4~9管合为d管,处理后再次检测,结果如图11所示,在b管和d管(4~9合管)中,2种极性的铁载体已完全分离开。

图10 硅胶纯化菌株S2所产铁载体的TLC检测结果Fig.10 The TLC detection results of S2 strain siderophoves purified on silica gel

注:a~c:铁载体硅胶纯化分离的1~3管;d:铁载体硅胶纯化分离的合管(4~9管)。Note:a-c:siderophore silica gel purification and separation of 1-3 tubes;d:combined tube for purification and separation of siderophore silica gel (4-9 tubes).
2.5.3 纯化铁载体生物化感作用验证 对纯化后的小极性铁载体和大极性铁载体进行拟南芥生物检测,验证菌株S2纯化铁载体对拟南芥主根生长的化感作用,结果如图12所示。拟南芥主根受单一纯化的铁载体影响主根根长度为1.80 cm,受空白土浸液影响主根根长度为1.55 cm,而当纯化铁载体与空白土浸液混合后,大极性铁载体对拟南芥主根生长产生了极显著抑制,拟南芥主根根长度变为0.76 cm,说明大极性铁载体对拟南芥主根生长具有明显生物化感作用。

图12 菌株S2纯化铁载体的化感作用验证Fig.12 The allelopathy validation results of the of S2 strain purified siderophores
3 结论和讨论
本研究在种植过地黄的3种土壤中分离得到1株高产铁载体菌株,经过形态学观察、16S rDNA同源性分析以及生理生化测试,鉴定菌株S2为恶臭假单胞菌(Pseudomonasputida)。通过正交试验优化了菌株产铁载体的条件,在26 ℃、180 r·min-1、pH值为10.0条件下,培养时间48 h时,其产铁载体含量最大为64.37%。WENDENBAUM等[25]。恶臭假单胞菌是高产铁载体的优势菌株,这与本研究结果一致。此外,恶臭假单胞菌可以通过分泌铁载体与植物竞争铁营养;如果在病原细菌生长环境中施加强螯合剂EDTA,与细菌竞争Fe3+,可以有效抑制恶臭假单胞菌的生长[25]。恶臭假单胞菌可以分泌2种铁载体:一种是酚盐铁载体(pyochelin),与铁的结合系数较低;另一种是荧光铁载体(pyoverdine),呈黄绿色,能在365 nm紫外光下发出荧光[26]。本研究分离得到的恶臭假单胞菌S2,可以分泌2种铁载体,一种是小极性铁载体,一种是大极性铁载体,而这2种铁载体均可以在365 nm下观察到,因此本研究分离的铁载体均为荧光铁载体。
目前,关于铁载体的研究大多集中在其生物合成的机制以及抑制病原菌的研究上,对于铁载体的生物化感作用的研究较少。谢小军[27]研究发现,儿茶酚型铁载体对小麦和水稻胚根有非常显著抑制作用。李曼[28]通过对处于对数生长期的藻细胞添加不同浓度的铁载体发现,铁载体浓度对藻细胞的抑制程度呈线性关系,浓度越大,抑制作用越强烈。本研究通过TLC对分离纯化后的铁载体展开观察,在紫外灯照射下检测分离纯化效果,并将纯化后的铁载体进行生物化感检测,结果表明,纯化后的铁载体、空白土浸液对拟南芥主根的作用无差别,但是纯化铁载体与空白土浸液的混合溶液对拟南芥有明显抑制效果,根长度由1.80 cm减小到0.76 cm。化感作用是造成地黄连作障碍的重要原因之一,关于这方面的研究大多集中在地黄分解产生的萜类、醇、醛、酚类、有机酸等有机化合物上[29-31],关于微生物分泌产生化感物质从而对地黄造成生物化感作用的研究较少。本研究分离得到恶臭假单胞菌S2,其分泌的铁载体证实可以与土壤共同作用于植物,对植物的生长造成毒害作用,推测这是造成地黄连作障碍的原因。

