云南松茸多糖提取方案优化及其测定*
魏晓梅,吴丽芳,柏旭,陶丽丽
(曲靖师范学院生物资源与食品工程学院,云南高原生物资源保护与利用研究中心,云南曲靖655011)
松茸(Tricholoma matsutake)又称松口蘑、松蕈。属担子菌门(Basidiomycota)担子菌纲(Basidiomycetes)伞菌目(Agaricales)口蘑科(Tricholomataceae)口蘑属(Tricholoma)[1],是较为自然的类群[2],也是我国二级濒危保护物种[3]。松茸是树木菌根菌,子实体一般单生,少数2个~4个丛生[4],为名贵的野生食用菌之一,其富含粗蛋白、粗脂肪、粗纤维和多种维生素[5-6],味道鲜美,且子实体提取物(多糖类物质)可提高身体免疫力[7],具有抗癌抗肿瘤,治疗糖尿病、心血管疾病,促进肠胃消化保护肝脏等功效[8]。有研究表明,松茸多糖能够抑制一些组织的癌细胞生长,引起S期阻滞,上调p53 mRNA表达水平[9]。因此,松茸多糖的提取率对进一步研究及开发松茸相关产品具有重大意义。长期以来,虽然有许多研究者花费大量精力致力于研究松茸人工栽培[10-11],并取得了大量成果[12-13],但由于松茸属于活体共生菌[3],到目前为止,驯化栽培松茸子实体主要还是以半人工栽培(仿生态栽培)为主[14]。在国外一些国家,已有深受欢迎的具有增强免疫功效的常用保健食品松茸多糖胶囊和口服液[15]。
鉴于多糖的利用价值,有很多研究者采用不同的原理和方法提取不同材料中的多糖,水提醇沉法被广泛应用于食用菌多糖的提取[16]。刘祖同、罗信昌归纳了食用菌子实体多糖水提醇沉法提取工艺步骤[1 7],但不同的食用菌材料多糖提取的工艺不尽相同,且提取的效率也有很大差别[18-19]。本研究以楚雄州大姚县和香格里拉云南松和栎树共生的山林中采集的松茸为原材料,结合前人研究的基础进一步利用正交试验设计中因素和水平的结合探索最佳松茸多糖提取方案,并通过同样的提取方法对比分析不同采集地松茸粗多糖含量的差异,为松茸相关产品的进一步开发提供参考依据。
1 材料与方法
1.1 材料、试剂与仪器
松茸子实体于2016年分别采自楚雄州大姚县和香格里拉市云南松与栎树共生的山林中。
正丁醇,天津市风船化学试剂科技有限公司生产,分析纯;丙酮,天津市化学试剂三厂生产,分析纯;三氯甲烷,南阳市科龙化工试剂厂生产,分析纯;无水乙醇,天津市风船化学试剂科技有限公司生产,分析纯。
高速组织捣碎机,上海标本模型厂制造,DS-1;电子天平CP114,奥豪斯仪器(上海)有限公司制造,精确度等级Ⅰ;离心机,大地自动化仪器厂制造,80-1离心机;数显鼓风干燥箱,上海博讯实业有限公司医疗设备厂制造,GZX-9070 MBE;DKS26电热恒温水浴锅,上海精宏实验设备有限公司制造。
1.2 方法
根据前人的研究结果,选择对提取结果可能较大影响的四因素三水平设计正交试验,见表1。松茸新鲜子实体切片,烘干捣碎过筛备用。4 000 r min-1离心10 min,重复并合并上清液,沉淀再次按照正交表分别加入10倍、15倍、20倍蒸馏水,再次重复2次后合并上清液,Sevag(氯仿∶正丁醇=4∶1)法除蛋白质。重复3次后旋转蒸发浓缩至原体积的1/3,待浓缩液冷却后往浓缩液中分别加入无水乙醇,使浓缩液中乙醇浓度达到预先设计的量,4℃低温静置24 h醇沉,4 000 r min-1离心10 min,分离乙醇与沉淀;醇沉结束后往水层中加入乙醇,使乙醇的量达到75%进行沉淀,去除水层并用丙酮进行洗涤除水。将用丙酮进行除水后的沉淀物放到50℃的鼓风干燥箱内进行干燥(约5 h),待恒重后称量即为粗多糖提取量。
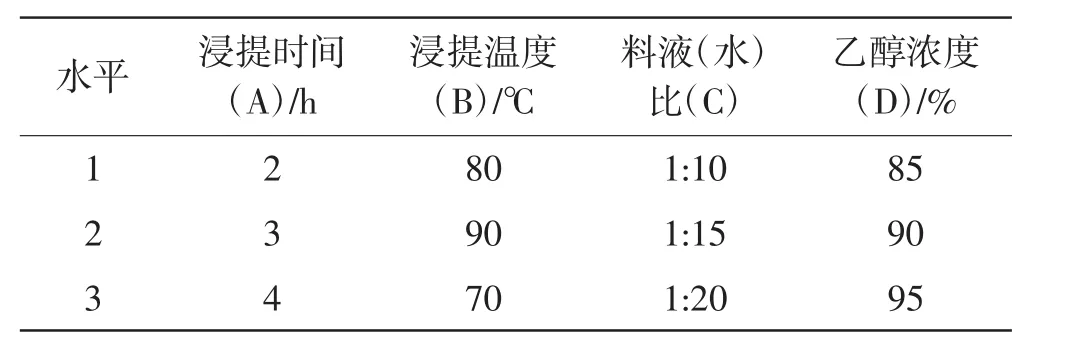
表1 四因素三水平正交设计水平表Tab.1 Orthogonal design in scale with four factors and three levels
2 结果与分析
2.1 浸提过程分析
楚雄松茸、香格里拉松茸浸提液情况分别见图1~图3,浸提液除蛋白过程见图4。

图1 楚雄松茸第一次浸提液Fig.1 The first extracts of Tricholoma matsutake from Chuxiong

图2 香格里拉松茸第一次浸提液Fig.2 The first extracts of Tricholoma matsutake from Xianggelila

图3 楚雄松茸第二次浸提液Fig.3 The second extracts of Tricholoma matsutake from Chuxiong

图4 浸提液除蛋白Fig.4 Deproteinization from the leaching liquid
研究过程中发现,不同生境松茸的浸提液颜色有明显差异(图1、图2),说明2种松茸的色素含量不同。不同的浸提次数所得到的松茸浸提液颜色是不同的(图1、图3),浸提次数越多,浸提液颜色越淡。
Sevag法除蛋白操作时,试管溶液分成3层,其中上层为多糖溶液,下层为有机溶剂,中间为蛋白质(图4),松茸子实体中蛋白质含量较高,这与前人的研究结果一致。
2.2 正交试验提取松茸多糖结果分析
2.2.1 楚雄松茸正交试验提取多糖结果分析
楚雄松茸多糖提取结果见表2。
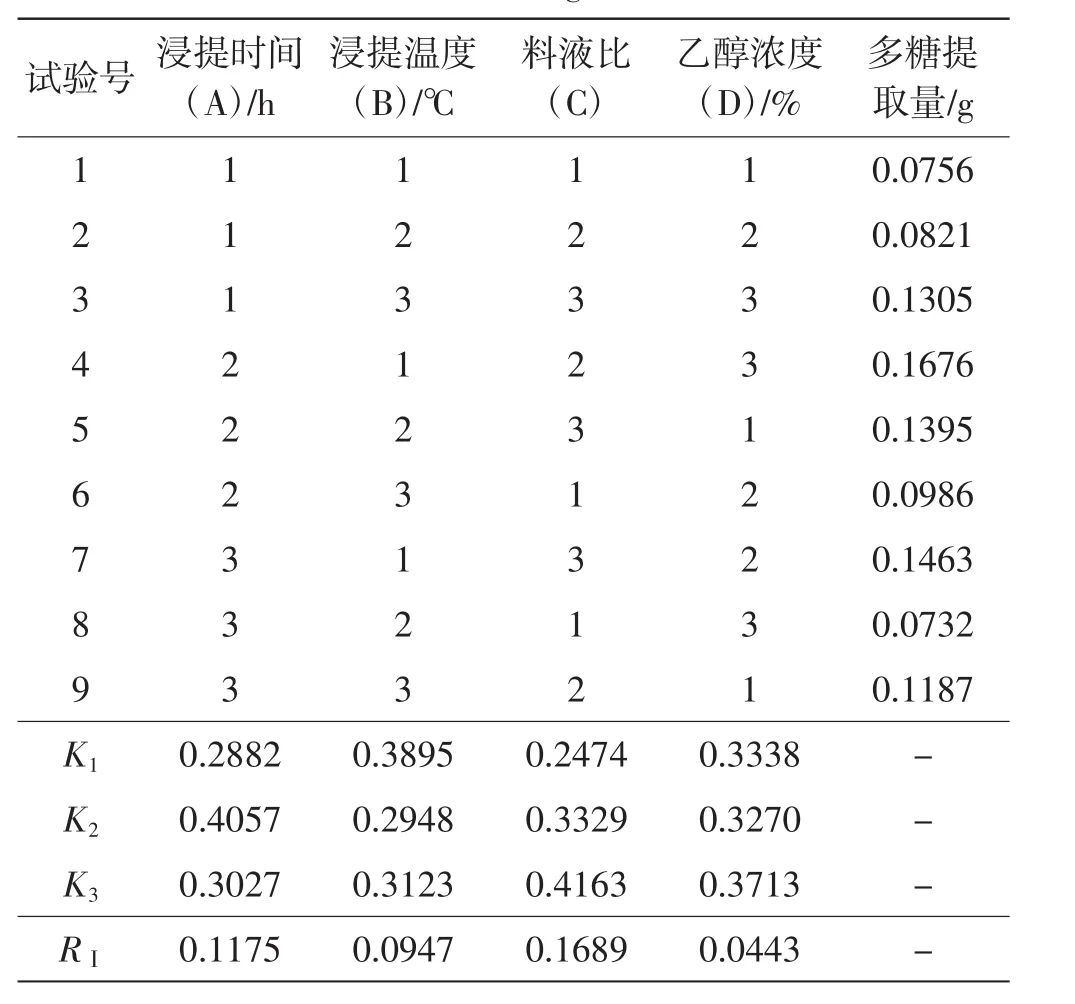
表2 楚雄松茸正交试验结果Tab.2 Orthogonal test results of Tricholoma matsutake from Chuxiong
表2分析发现,不同条件下多糖提取量有明显的差异,试验组合为A2B1C2D3时,每1克松茸其多糖提取量为0.1676 g;试验组合为A3B2C1D3时,每1克松茸其多糖提取量为0.0732 g。K1、K2和K3为各因素在相同水平下多糖提取量的和;RⅠ为K1、K2和K3值的极差。分析RⅠ发现,在因素C(料液比)条件下RⅠ为0.1689,高于其他因素的RⅠ,说明此因素即料液比对试验的影响最大,且随着料液比的降低,松茸多糖提取量有较大的升高。因素A(浸提时间)RⅠ为0.1175,从K值可以看出浸提时间为3 h时,松茸多糖提取量是最高,因此最佳的浸提时间为3 h。因素B(浸提温度)RⅠ为0.0947,对多糖提取量有一定的影响,从K值可以看出浸提温度为80℃时,松茸多糖提取量最高。虽然因素D(乙醇浓度)RⅠ为0.0730,相对是最小的,但是从K值可以看出乙醇浓度对K值的大小也存在一定的影响。据此分析各因素对试验结果的影响程度为C>A>B>D,即料液比>浸提时间>浸提温度>乙醇浓度。
2.2.2 香格里拉松茸正交试验提取多糖结果分析
香格里拉松茸多糖提取结果见表3。

表3 香格里拉松茸正交试验结果Tab.3 Orthogonal test results of Tricholoma matsutake from Xianggelila
表3分析发现,不同条件下多糖提取量有着明显的差异。试验组合为A3B2C1D3时,多糖提取量最少,每1克松茸可得到多糖0.0592 g;试验组合为A2B1C2D3时多糖提取量最高,每1克松茸可得到多糖0.1197 g。对比RⅡ值发现,各因素对试验结果的影响程度为B>C>D>A。由表3可知因素B(浸提温度)RⅡ为0.0933,对试验结果的影响最大,其次是因素C(料液比),其RⅡ为0.0708,从K值可以看出料液比1:20时,松茸多糖提取量最高;因素D(乙醇浓度)RⅡ为0.0591,从K值可以看出乙醇浓度90%。虽然因素D(浸提时间)RⅡ为0.0417,对试验结果影响最小,但是从K值可以看出,乙醇浓度对K值的大小有一定的影响。
通过同样的组合提取不同生源地的松茸子实体多糖,在A2B1C2D3条件下,两地的野生松茸多糖提取量均最高,但楚雄野生松茸的多糖提取量大于香格里拉野生松茸的多糖提取量;在A3B2C1D3条件下,两地的野生松茸多糖提取量均最低,但楚雄松茸的多糖提取量仍大于香格里拉松茸,其他组试验也出现同样的现象,因此,可推断,不同生境条件下生长的松茸存在差异,在本研究中则表现为子实体中多糖含量的差异。楚雄松茸的多糖含量高于香格里拉松茸的多糖含量,且A2B1C2D3,即80℃浸提3 h,料液比1:15,95%乙醇沉淀,为最佳的松茸子实体多糖提取条件。
从浸提时间来看,楚雄松茸的K2>K1>K3,香格里拉松茸的K12>K11>K13,二者相同,所以对于两地松茸来说太短或太长的浸提时间均不利于多糖的提取。
对于浸提温度,楚雄松茸的K1>K3>K2,香格里拉松茸的K11>K13>K12,二者相同,所以对于两地松茸来说太高或太低的浸提温度均不利于多糖的提取。
比较料液比发现,楚雄松茸的K3>K2>K1,香格里拉松茸的K12>K13>K11,所以对于楚雄松茸来说料液比比值越小,多糖提取量越高。但是对于香格里拉松茸来说,太大或者太小的料液比都不利于多糖的提取。
醇沉时不同的乙醇浓度对结果也有影响,楚雄松茸的K3>K1>K2,香格里拉松茸的K12>K13>K11,由此看出楚雄松茸醇沉时对乙醇浓度不敏感。但是对于香格里拉松茸来说,太高或者太低的乙醇浓度均不利于多糖的提取。
在楚雄松茸多糖提取结果中,各因素对试验结果的影响程度为C>A>B>D;而在香格里拉松茸多糖提取结果中,各因素对试验结果的影响程度为B>C>D>A。料液比这个因素对于楚雄松茸的多糖提取量影响最大,但影响香格里拉松茸多糖提取量最大的因素是浸提时间。
3 讨论
综上所述,楚雄松茸与香格里拉松茸的最佳提取方案可以相同,但提取的多糖量有差异,本研究中选取的4个因素对两地的松茸子实体多糖的提取量的影响基本保持一致。原因可能是松茸的所处生境存在差异。在不同生境条件下,松茸生长过程中代谢产物的量存在差异。虽然两地“年温差较小,日温差较大”,但从日照强度来看,楚雄的日照强度、平均海拔均低于香格里拉;而且楚雄的年平均气温高于香格里拉;再者,楚雄受亚热带季风气候影响,而香格里拉则属于山地寒温带季风气候,因此楚雄的雨季比香格里拉提前1个月。由于生理环境的差异,造成了两地松茸多糖含量的差异,同时多糖种类方面也存在差异。
[1]张梦苑,陈炼红.野生松茸加工与发展现状[J].食品工业,2015,36(8):220-222.
[2]刘培贵,袁明生,王向华,等.松茸群生物资源及其合理利用与有效保护[J].自然资源学报,1999,4(3):245-252.
[3]周选围.松茸资源研究概况[J].食用菌学报,2002,9(1):50-56.
[4]郭爱莲.珍贵食用菌松茸的研究概况[J].西北轻工业学院学报,1996,14(3):111-115.
[5]王波.松口蘑与青冈蕈的生态和营养价值比较[J].食用菌学报,1995,2(1):32-35.
[6]王永明.蕈中珍品-松茸[J].植物杂志,1999(6):10.
[7]高菊珍,张红宇,乐开礼.松茸的免疫增强作用和抗应激作用研究[J].中药药理与临床,1997,13(1):38-39.
[8]张燕,赖于民.松茸氨基酸含量分析及营养价值评价[J].食品研究与开发,2016,37(3):14-18.
[9]张治业.松茸多糖对不同肿瘤细胞系的体外抗肿瘤作用[J].山东医药,2011,51(13):70-71.
[10]王云,谢支锡.松口蘑初探[J].食用菌,1982,4(1):7-8.
[11]傅伟杰,许广波,陈艳秋,等.松口蘑的半人工及人工栽培[J].中国食用菌,1999,18(6):10-11.
[12]Ohta A.A new medium for mycelia growth of mycorrhizal fungi[J].Tran.Mycol.Soc.Japan,1990,31(3):323-334.
[13]沙涛,丁骅孙.松茸菌丝分离的初步研究[J].中国食用菌,2000,19(5):8-10.
[14]谭伟.松口蘑栽培理论及方法[J].食用菌学报,1994,1(1):53-63.
[15]孙培龙.姬松茸多糖的分离纯化、结构鉴定及其抗肿瘤活性研究[D].杭州:浙江大学,2007.
[16]王雪冰,赵天瑞,樊建.食用菌多糖提取技术研究概况[J].中国食用菌,2010,29(2):3-6.
[17]刘祖同,罗信昌.食用蕈菌生物技术及应用[M].北京:清华大学出版社,2002.
[18]陈湘.黄蘑多糖提取及除蛋白方法的实验研究[J].平顶山工学院学报,2007,16(2):11-13.
[19]宁慧青.不同食用菌多糖含量的比较研究[J].山西化工,2007,27(3):44-45.

