多糖、粗蛋白含量高的灰树花菌株筛选*
李蓉,张金钰,陈丽,姚庭永,叶长文,吴应淼
(1.浙江省庆元县食用菌科学技术研究中心,浙江省丽水食用菌技术创新服务平台,浙江省食用菌工程技术研究中心,浙江丽水323000;2.庆元县农业局,浙江庆元323800)
灰树花,学名:Grifola frondosa,英文名:Maitake,属担子菌亚门(Basidiomycota)伞菌纲(Agaricomycetes)多孔菌目(Polyporales)亚灰树花菌科(Meripilaceae)树花属(Grifola)[1]。灰树花是最有价值的食药两用菇类,特别是从灰树花中提取的最有效成分灰树花D-fraction,具有极强的抗癌功效[2]。有研究表明,从灰树花深层发酵液和菌丝体中提取的多糖,与子实体中提取的多糖具有同样的抑制肿瘤、提高肌体免疫功能的作用[3]。顾顺明等[4]研究表明灰树花子实体和菌丝体具有相同种类的氨基酸,且氨基酸含量比较接近。国内外对食用菌中活性物质的研究多集中于食用菌中蛋白质的抗病毒、抗肿瘤和多糖抗肿瘤以及作为癌症辅助治疗药剂等方面[5]。陈宁等[6]从灰树花中分离到具有抗TMV活性的蛋白质。
液体深层发酵具有培养周期短,成本低,产量高,易于实现工业化生产,能快速增殖菌丝体细胞,活性物质的有效成分易于控制,生产效率高等优势。笔者对13种不同灰树花菌株进行栽培、摇瓶发酵,通过比较不同菌株子实体、菌丝体间胞内多糖和粗蛋白含量,筛选出胞内多糖、粗蛋白含量高,而且分别适宜栽培以及液体发酵的灰树花菌株,以期满足灰树花栽培与加工的不同需求,提供特定优良的菌株。
1 材料与方法
1.1 供试菌株与培养基
试验采用本单位从国内外收集的13个灰树花菌株(Grifola frondosa),编号和来源分别为G1:美国宾夕法尼亚州大学,G4:福建三明真菌研究所,G5:日本,G6:河北,G7、G8、G9、G10:上海农科院食用菌研究所,G13:四川,G20:山东泰安,庆灰151、庆灰152、小黑汀:浙江省庆元县食用菌科学技术研究中心。
培养基配方:木屑34%、棉籽壳34%、麦麸10%、玉米粉10%、晒干山表土10%、石膏1%、红糖1%,含水量55%~60%,pH自然。
斜面培养基:马铃薯200 g、葡萄糖2 g、蛋白胨2 g,水1 000 mL。
发酵培养基:玉米粒浸出物1 000 g、葡萄糖2 g、蛋白胨0.3 g、KH2PO40.3 g、MgSO4·7H2O 0.05 g,水1 000 mL。
1.2 主要试剂与仪器设备
苯酚:药检专用,国药集团化学试剂有限公司;浓硫酸:分析纯,浙江中星化工试剂有限公司;加速剂(3.5 gK2SO4和0.4 gCuSO4·5H2O):福斯分析仪器(苏州)有限公司;氢氧化钠:分析纯,西陇化工股份有限公司;无水乙醇:分析纯,安徽安特食品股份有限公司;硼酸:分析纯,太仓美达试剂有限公司。
MJ33水分快速测定仪,梅特勒托利多;Direct-Q超纯水系统,密理博;FW135固体样品粉碎机,天津泰斯特仪器有限公司;GZX-9240MBE热风内循环烘箱,上海博讯实业有限公司;PL403电子天平,梅特勒托利多;SKY-211B全温摇床,上海苏坤实业有限公司;Thermo移液器,美国热电;MLS-3780高压灭菌锅,日本三洋;DKL12消解仪,意大利VELP;UDK139凯氏定氮仪,意大利VELP;Lambda25紫外分光光度计,铂金埃尔默。
1.3 试验方法
1.3.1 不同菌株人工栽培产量的比较
按培养料配方要求称量后,先将红糖溶于水,然后用红糖水拌匀玉米粉、麦麸、山表土、石膏,下一步拌入木屑,最后拌入经预湿的棉籽壳,装入规格为15 cm×55 cm×0.04 cm聚乙烯筒袋。将料袋打一直径1.0 cm~1.5 cm的小孔,料温达100℃状态下保持16 h灭菌。灭菌彻底后冷却接种,接种时无菌操作。经人工栽培统计2茬菇(菌棒1茬菇和覆土2茬菇)产量,计算单产和生物转化率。
1.3.2 不同菌株液体发酵菌丝生物量的比较
水稻产量形成是一个复杂的系统过程,影响其产量的各个性状之间具有复杂的关联性[5]。因此,无论在育种工作中还是生产实际中都要综合考虑各项性状指标[6-7]。通过黔糯优11产量及主要性状的相关分析与通径分析,明确了产量构成要素之间的关系,在合理群体有效穗的同时,提高穗粒数和结实率是确保黔糯优11增产的关键措施。
发酵条件:25℃,摇床转速150 r·min-1,种子培养基接种量为直径6 mm圆饼5个,装液量为250 mL三角瓶装100 mL发酵液,初始pH为6.0,发酵周期为11 d,液体发酵培养基接种量为100 ml·L-1,发酵周期为5 d。
发酵结束后,将三角瓶中的菌丝体经60目筛过滤后,用蒸馏水冲洗干净,然后置于35℃烘箱中烘3 h后,调节烘箱温度至50℃烘干,用电子天平称量菌丝体干重,取5瓶菌丝体干重的平均值,以mg/100mL计。
1.3.3 不同菌株子实体、菌丝体胞内多糖含量测定
先将烘干的子实体进行粉碎,然后所有待测子实体在50℃下烘干24 h。将烘干的子实体、菌丝体置80℃水浴中恒温浸提2 h,共3次,过滤,弃残渣,取滤液,菌丝经超声波破碎30 min,加水煮沸浸提3 h(第1次提取2 h,第2次提取1 h),加水量90 mL(第1次提取60 mL,第2次提取30 mL),过滤,弃残渣,取滤液,上清液浓缩至10 mL,将上述浓缩液经无水乙醇洗涤后所得溶液为胞内多糖测试液。
取1 mL上述多糖溶液,加入苯酚1 mL,然后迅速加入5 mL浓硫酸摇匀,30℃水浴中显色20 min,反应生成橙黄色溶液,反应产物在490 nm处比色,采用外标法分析胞内多糖含量。
标准曲线制作:配制100 ml·L-1的葡萄糖标准溶液,吸取0、0.2 mL、0.4 mL、0.6 mL、0.8 mL、1.0 mL的标准溶液至10 mL试管中,用蒸馏水补至1.0 mL。向试管中加入1.0 mL5%苯酚溶液,然后迅速加入5.0 mL浓硫酸摇匀,30℃水浴中显色20 min,另以双蒸水代替多糖溶液同上操作,为空白对照,在490 nm波长处测定吸光度值。以多糖浓度为横坐标,吸光度值为纵坐标,绘制标准曲线。
1.3.4 不同菌株子实体、菌丝体粗蛋白含量的测定
按GB/T15673-2009食用菌中粗蛋白含量测定中的规定方法,取1 g灰树花粉放入消煮管,再加入浓硫酸10 mL,加速剂1片,之后进行梯度消解,150℃下消解30 min,260℃下消解60 min,420℃下消解120 min。
将带消化液的消煮管插在蒸馏装置上,以25 mL硼酸溶液为吸收液,加入2滴甲基红-溴甲酚绿混合指示剂,蒸馏装置的冷凝管末端浸入装有吸收液的250 mL锥形瓶内,然后向消煮管中加入40 mL氢氧化钠溶液进行蒸馏。使蒸馏液猛烈沸腾,释放出的氨被吸收液吸收,待吸收液变绿色之后继续蒸馏5 min,吸收液达100 mL左右时停止蒸馏。取下锥形瓶,使冷凝管末端离开液面,继续蒸馏1 min~2 min,并用蒸馏水冲洗冷凝管末端,洗涤液均需流入锥形瓶内,然后停止蒸馏。
立即用0.1 mol·L-1盐酸标准溶液进行滴定,吸收液由蓝绿色滴定至灰红色。30 s保持不变即为终点。
试样中粗蛋白含量以质量分数计,数值以克每百克(%)表示,计算结果保留到小数点后1位。
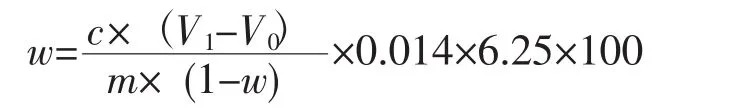
式中:c表示盐酸标准溶液的浓度,单位为mol·L-1;V0表示空白试液滴定消耗的盐酸标准溶液体积,单位为mL;V1表示试料滴定消耗的盐酸标准溶液体积,单位为mL;m表示试料的质量,单位为g;0.014表示氮的摩尔质量,单位为g·mmoL-1;w表示试料含水率,单位为%;6.25表示氮换算成粗蛋白质的系数。
2 结果与分析
2.1 不同菌株人工栽培产量
13个灰树花菌株,每个菌株栽培90棒(分3个小区),观察子实体颜色,计算平均每棒单产和生物转化率,结果见表1。
由表1结果可以看出,灰树花子实体颜色有白、白灰、灰等颜色。庆灰151、庆灰152、G7菌株平均单产较高,生物转化率较高;G13菌株平均单产最低,其余均相差不大。生物转化率同平均单产成正比。
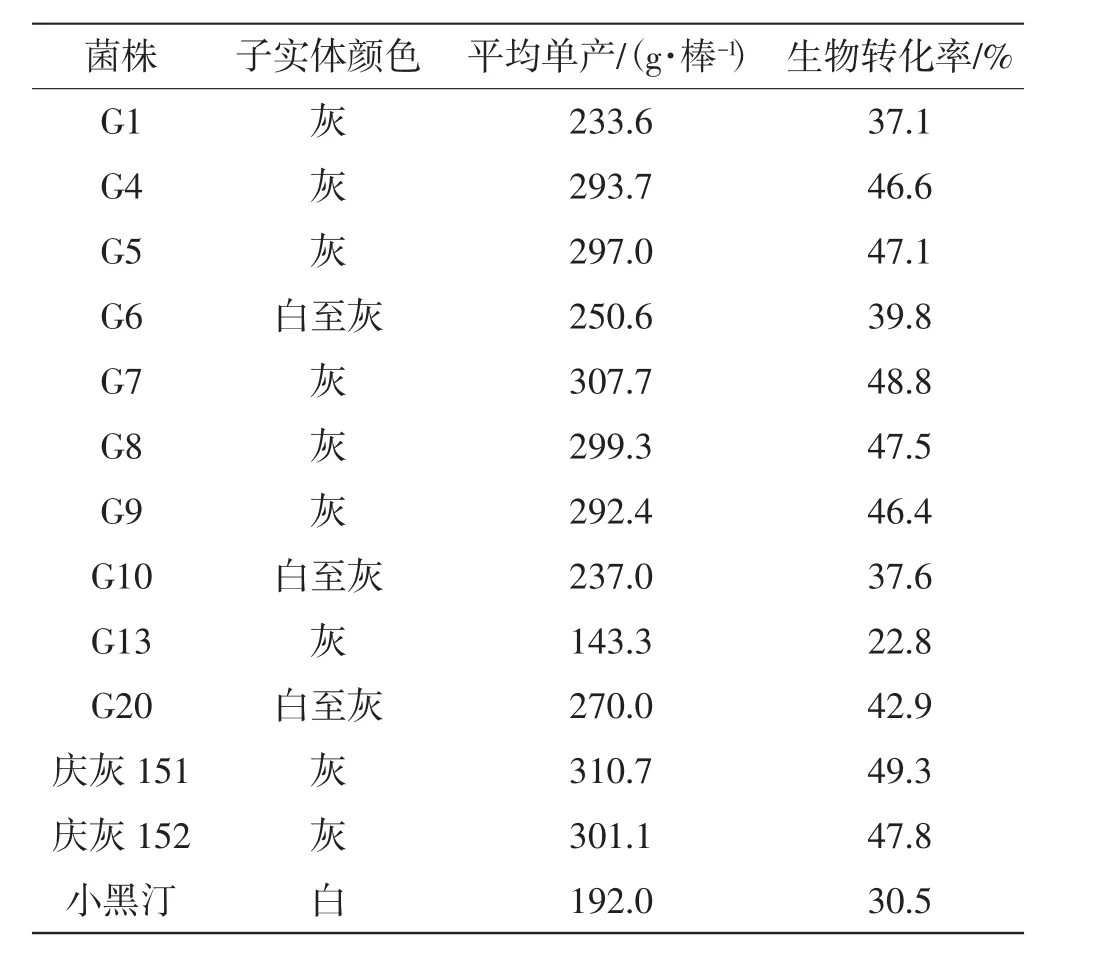
表1 试验菌株出菇性状Tab.1 Fruiting characteristics of test strains
2.2 不同菌株液体发酵菌丝生物量的比较
不同试验灰树花菌株的菌丝生物量测定情况见表2。
表2结果表明,G6菌株发酵培养液中菌丝生物量最大,达到725.1 mg/100mL,其次为G13、G20、G5、140、庆灰152、G9、G8、庆灰151菌株,菌丝生物量介于352.9 mg/100mL~208.0 mg/100mL,菌株G7、G10、G4、G1、小黑汀菌丝生物量均低于200 mg/100mL。发酵液颜色呈淡黄或棕黄色,菌丝球呈小米粒状或较小米粒稍大,发酵产物pH呈酸性,发酵液具有灰树花味。

表2 试验菌株菌丝生物量测定Tab.2 Mycelial biomass of test strains
2.3 不同菌株子实体、菌丝体胞内多糖含量的测定
不同灰树花菌株子实体、菌丝体胞内多糖含量的测定结果见图1。

图1 不同灰树花菌株子实体、菌丝体胞内多糖含量Fig.1 Intracellular polysaccharide content from fruiting body and mycelium of different Grifola frondosa strains
子实体胞内多糖含量测定结果表明,G5、G6、G1、G4、G13菌株子实体中胞内多糖含量较高,其中G5菌株最高达到17.89%,而庆灰151、庆灰152、小黑汀等栽培应用品种中子实体胞内多糖含量偏低。
菌丝体胞内多糖含量测定结果表明,G6菌株胞内多糖含量较高达到11.49%,其次为G1、G20菌株,而庆灰151、庆灰152、小黑汀等栽培应用品种中菌丝体胞内多糖含量较低。
分析认为,生产主栽灰树花品种经过多年栽培应用,可能菌株有所退化,导致胞内多糖含量有所下降。因此,选育出多糖含量高的灰树花新菌株,将是灰树花育种需考虑的目标方向之一。
2.4 不同菌株子实体、菌丝体粗蛋白含量的测定
不同菌株子实体、菌丝体粗蛋白含量的测定结果见图2。
子实体粗蛋白含量测定结果表明,除G13、庆灰151菌株子实体粗蛋白含量低于7.35%外,其余灰树花菌株子实体中粗蛋白含量均较高,G7菌株粗蛋白含量最高达到32.24%。菌丝体中粗蛋白含量测定结果表明,G6菌株菌丝体中粗蛋白含量最高达到21.44%,G20、G13菌株中粗蛋白含量稍高,其余的均相差不大。
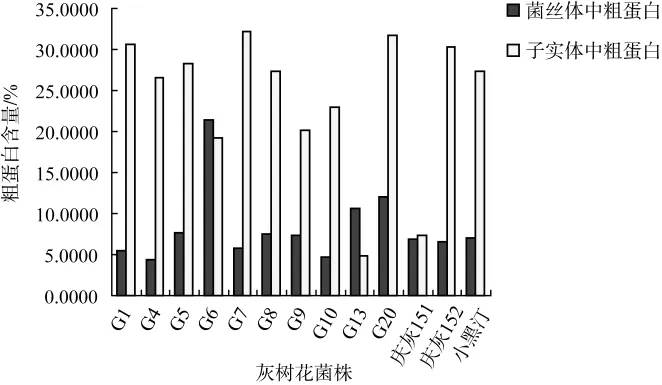
图2 不同菌株子实体、菌丝体粗蛋白含量Fig.2 Crude protein content from fruiting body and mycelium of different strains
3 小结
参试的13个灰树花菌株中,G5菌株为胞内多糖含量高,并且适宜子实体栽培应用的灰树花菌株;G6菌株为胞内多糖含量高,并且适宜液体发酵培养菌丝体的灰树花菌株;G7菌株为粗蛋白含量高,并且适宜子实体栽培应用的灰树花菌株;G6菌株为粗蛋白含量高,并且适宜液体发酵培养菌丝体的灰树花菌株。
在今后的灰树花育种工作中,可将多糖、粗蛋白含量作为品种品质的衡量指标,以期为深加工领域研发高附加值产品提供优良菌株。
[1]杨杨,郭健,李长田.基于核糖体基因的灰树花分子系统关系分析[J].中国食用菌,2016,35(6):42-45.
[2]甘长飞.灰树花的保健功效研究文献综述[C]//首届中国食用菌养生研讨会论文集.庆元:中国食用菌协会,2013:93-101.
[3]卜庆梅,倪艳波,黄清荣,等.灰树花液体发酵培养基的筛选试验[J].江苏农业科学,2003(6):103-105.
[4]顾顺明,孙晔,王潞江,等.发酵法生产灰树花菌丝体的研究[J].工业微生物,2003,33(4):1-4.
[5]孙正祥,王瑞霞.食用菌中生物活性蛋白的研究进展[J].食用菌学报,2009,19(2):85-90.
[6]陈宁,吴祖建,林奇英,等.灰花树中一种抗烟草花叶病毒的蛋白纯化及其性质[J].生物化学与生物物理学报,2004,31(3):283-286.

