醇类对UV-Fenton体系羟基自由基淬灭效率的影响
戴慧旺 ,陈建新 *,苗笑增 ,蒋柏泉 ,龚 娴 (.南昌大学资源环境与化工学院,江西 南昌 00;2.南昌大学鄱阳湖环境与资源利用教育部重点实验室,江西 南昌 00;.南昌市环境监测站,江西 南昌 008)
基于自由基氧化理论的高级氧化技术(AOPs)已被广泛应用于废水中难降解有机污染物的处理研究.作为AOPs之一的UV-Fenton技术,因其体系能产生活性极强的羟基自由基(·OH)以及应用环境友好型氧化剂H2O2而受到开发者的青睐[1-5].·OH氧化电位为2.8eV,具有极强的氧化性,能够快速且无选择性地通过夺氢或与不饱和碳-碳键加成氧化降解有机污染物[1,6].然而,正是由于·OH 具有极强的活性,其在水环境中的寿命非常短暂(约10-9s)[7-8],难以直接捕捉和定量测定,导致UV-Fenton体系中对·OH的生成机理和·OH与有机污染物的反应机制的研究存在一定的困难.
目前,国内外学者通常是将·OH 淬灭剂加入到所研究体系中,通过比较加入淬灭剂前后有机污染物的降解情况,以定性说明·OH 的存在和生成机理,定量计算·OH降解有机污染物的贡献率,以及推导·OH 与有机污染物的反应途径.·OH 淬灭剂的种类较多,如水杨酸[9]、苯甲酸[10]、苯酚[11]、碘化钾[12-13]以及醇类[14-16]等均有报道,其中以醇类的使用最为广泛.例如,Monteagudo等[14]在UV-Fenton降解酚类有机物的过程中加入叔丁醇,表征了氧化过程中·OH 在不同反应阶段的生成情况及作用机制;Hwang等[15]在类Fenton降解甲基叔丁基醚(MTBE)的体系中加入异丙醇,证明了·OH 是 MTBE降解的主要贡献者;Xu等[16]在多相Fenton降解4-氯苯酚的实验中加入正丁醇,证明了催化剂表面及溶液中的·OH是导致4-氯苯酚降解的主要氧化物种,并以此为基础进一步探讨了催化机理.
尽管目前将醇作为·OH淬灭剂运用于高级氧化领域的研究较多,但是很少有研究考虑到不同醇本身对·OH 淬灭效率的差异.而这种差异可能会在高级氧化体系的研究中,仅仅因为选择不同醇作为淬灭剂,而导致不同的研究结论.本文通过比较不同醇对多相与均相 UV-Fenton体系降解染料橙Ⅱ速率的影响,从而定量分析不同醇对·OH淬灭效率的影响,并测定了醇类对多相UVFenton体系中·OH浓度的影响,为UV-Fenton体系·OH的生成机理、反应机制以及淬灭剂的选择提供理论依据.
1 材料与方法
1.1 仪器与试剂
PH400型基础酸度计(上海安莱立思仪器科技有限公司);V-1600型分光光度计(上海翱艺仪器有限公司);UV-2300双光束紫外/可见分光光度计(上海天美科学仪器有限公司);Ocean optic QE65pro型光谱仪(HALMA).
实验所用试剂除特别标注外均为分析纯.橙Ⅱ、四氧化三铁、香豆素(99%)、7-羟基香豆素(99%)购于Aladdin;盐酸、30% H2O2购于西陇化工有限公司;氯化铁、氢氧化钠、亚硫酸钠、磷酸氢二钠、磷酸二氢钠、甲醇、乙醇、乙二醇、正丙醇、丙三醇、异丙醇、叔丁醇、正丁醇购于国药集团化学试剂有限公司.
1.2 实验方法
橙Ⅱ的降解在自制光化学反应器中进行[17].反应器由3部分构成,反应器内层设置石英套管,套管内放置低压汞灯(6W 254nm)作为反应光源;中间层为 UV-Fenton体系 ·OH产生和淬灭区;外层连接恒温水浴.反应器底部设置磁力搅拌器使反应体系混合均匀.整个反应装置密闭以隔绝其它光线的干扰.
降解过程水浴温度保持30℃恒定,橙Ⅱ初始浓度为0.2mmol/L,调节初始pH值为3.0,H2O2浓度 10mmol/L,反应容积 750mL.反应开始前向染料溶液投加催化剂,并加入一定浓度的醇,暗光搅拌30min,而后投加H2O2,开启紫外灯开始反应并以此为反应起点.均相UV-Fenton反应所用催化剂Fe3+浓度为0.05mmol/L,在相应的时间点取样后立即加入0.1mol/L氢氧化钠和0.05mol/L亚硫酸钠中止反应.多相UV-Fenton反应所用催化剂Fe3O4用量为 1g/L,在相应的时间点取样立即经滤头(0.45μm水系)过滤后测定.
·OH 的测定采用荧光光谱法,以香豆素为探针分子,捕获·OH生成具有强荧光特性的7-羟基香豆素.多相UV-Fenton体系中·OH浓度的测定方法如下[18-20]:不同时刻从体系取反应溶液5mL于装有50mL 2mmol/L香豆素溶液(pH=3.0)的石英广口瓶中,并置于另一封闭箱中用低压汞灯(6W 254nm)照射及磁力搅拌5min,而后对该混合液过滤(0.45μm 水系)并取 2.2mL滤液立即加入0.5mL缓冲溶液 (pH值为7.2的磷酸氢二钠和磷酸二氢钠混合溶液)混合均匀,最后置于光谱仪中测量荧光强度.基础实验除不加醇外其他实验条件与加醇淬灭实验一致.
1.3 分析方法
橙Ⅱ采用V-1600型分光光度计于最大吸收波长484nm处测定[21-22];全波长扫描用双光束紫外/可见分光光度计分析.·OH淬灭率的计算公式如下[23-24]:

式中:Kapp(基础)为不加淬灭剂条件下橙Ⅱ降解的表观一级动力学常数,计算公式如下[22]:
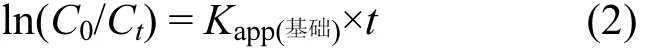
式中:C0为初始时刻橙Ⅱ的浓度,mg/L;Ct为反应过程中某一时刻橙Ⅱ的浓度,mg/L.
光谱仪的激发波长为345nm,实验确定的7-羟基香豆素在该激发波长下的发射波长为460nm,香豆素与·OH 的反应式如下[6,18-20]:

反应体系·OH的浓度由(3)式及7-羟基香豆素标准曲线关系可得:

式中:C·OH为·OH的浓度,μmol/L(该浓度值是反应器中浓度稀释13.5倍后的数值);C7HC为7-羟基香豆素的浓度,μmol/L;I460为 460nm 处的荧光强度值.每组设3个平行样,取平均值,实验数据的标准误差不超过5%.
2 结果与讨论
2.1 一元醇的链长及其同分异构体对多相UV-Fenton体系中·OH淬灭效率的影响
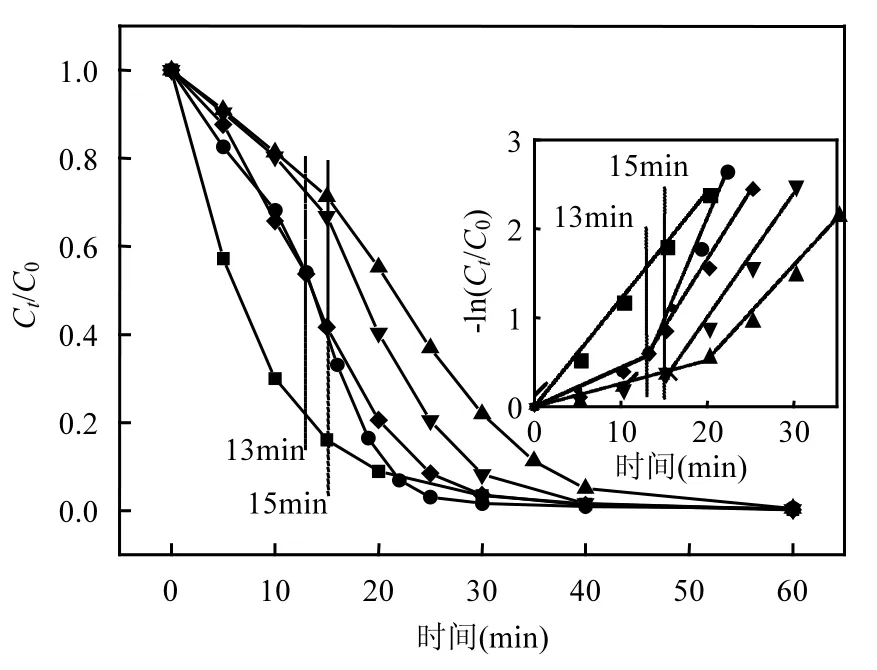
图1 一元醇链长对橙Ⅱ降解过程的影响(10mmol/L)Fig.1 Effect of alkanols with different carbon chain length on the degradation of OrangeⅡ
简单一元醇甲醇[25-26]、乙醇[26-27]、正丁醇[16]在Fenton体系中对活性自由基的研究已有应用,且被证明其对·OH淬灭效率较高.因此,本文首先对不同链长一元醇对多相 UV-Fenton降解橙Ⅱ的影响进行了讨论,结果见图1和表1.由图1及表 1可见,加入饱和一元醇后橙Ⅱ的降解均出现2个降解动力学阶段(以下简称1段,2段);加入甲醇、正丁醇的体系橙Ⅱ降解速率在前13min非常缓慢,从 13min开始降解速率急剧增快,并于30min基本降解完全;加入乙醇、正丙醇的体系橙Ⅱ降解趋势与前者相同,但各阶段降解时间相对滞后;不同碳链长度的一元醇对·OH 淬灭能力表现为:乙醇>正丙醇>正丁醇>甲醇.相较之下,虽然乙醇对·OH 的淬灭影响更为明显,但是从表 1可以看出,加入乙醇的体系橙Ⅱ的2段·OH的淬灭率只有11.7%,说明乙醇在UV-Fenton体系中对·OH的淬灭并不稳定.
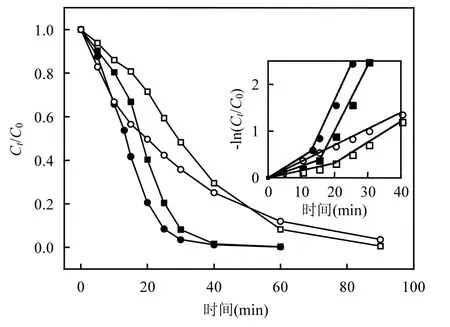
图2 醇的同分异构体对橙Ⅱ降解过程的影响Fig.2 Effect of alkanol isomers on the degradation of OrangeⅡ
相关一元醇的同分异构体正丙醇及异丙醇,正丁醇及叔丁醇对多相UV-Fenton体系·OH淬灭效率的影响见图 2和表1.结果表明,醇的同分异构体对·OH 淬灭效率差异非常大.加入异丙醇后橙Ⅱ的降解也出现2个阶段,其1段和2段对·OH的淬灭率分别为87.5%和63.3%,表现出非常强的淬灭能力;叔丁醇对·OH的淬灭非常稳定,橙Ⅱ的降解速率常数降低至 0.035min-1,淬灭率达70.8%;相反,正丙醇、正丁醇对·OH的淬灭能力较差,而且在第 2阶段表现出对橙Ⅱ降解的促进作用,其原因有待于进一步研究. ·OH与异丙醇、叔丁醇的夺氢反应及反应速率如下[28]:
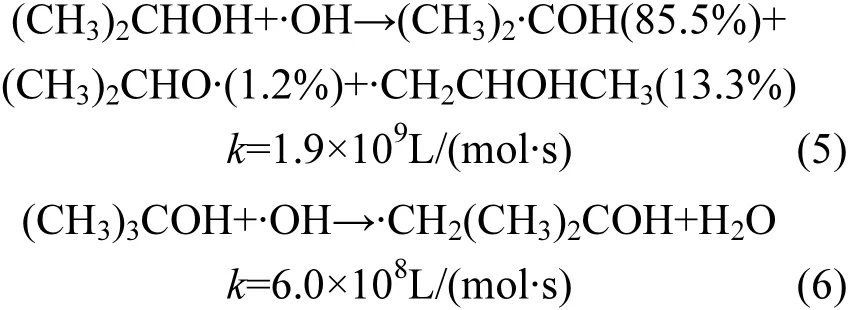
异丙醇[15,29-30]及叔丁醇[14,30-31]与·OH 的反应非常迅速,在Fenton体系中作为·OH淬灭剂应用最为广泛且效果较好,本文得到的结果与之相一致.

表1 一元醇链长及同分异构对多相UV-Fenton体系·OH淬灭效率的影响Table 1 Effect of alkanols with different carbon chain length and alkanol isomers on scavenging efficiencyto ·OH in heterogeneous UV-Fenton system
2.2 一元醇浓度对多相 UV-Fenton体系中·OH淬灭效率的影响
多相 UV-Fenton体系中,如图 3(a)所示,叔丁醇及异丙醇用量由5mmol/L增加到10mmol/L时,橙Ⅱ的降解速率均有所下降.随淬灭剂醇浓度的增大,单位时间内争夺·OH 的淬灭剂数量增加,使得橙Ⅱ的氧化被抑制,其降解速率降低.图 3(b)和表2给出不同浓度甲醇对·OH淬灭的比较,在反应的第1阶段橙Ⅱ的降解速率随着甲醇浓度的增大而减小,当甲醇浓度增加到20mmol/L时降解速率不再明显下降.但橙Ⅱ降解速率却在第 2阶段逐渐随着甲醇浓度的增大而增大并在30mmol/L达到最大值.相类似的, Roman等[32]在研究 TiO2光催化甲醇助产氢同时降解甲基橙的过程中也发现,甲醇的加入能极大地促进甲基橙的降解.该结果表明,对于·OH 的淬灭,仅增加淬灭剂的浓度可能并不是最佳选择,醇的种类更为重要.

图3 醇浓度对橙Ⅱ降解过程的影响Fig.3 Effect of alcohol concentration on the degradation of OrangeⅡ
为进一步探究醇影响下橙Ⅱ的降解情况,本文对加入10mmol/L甲醇的多相UV-Fenton体系溶液进行了全波长扫描.扫描结果如图 4所示,染料溶液在紫外区 310nm处的吸收峰是由萘基产生;484nm处的特征吸收峰是橙Ⅱ分子结构中氮-氮双键(染料分子的发色基团)的 n-π*电子跃迁产生的[21].染料溶液在 484nm 处的吸收峰逐渐减弱说明氮-氮双键被逐渐打开,紫外吸收区的减弱说明萘环逐渐被打开并生成一些中间产物.该研究结果与Chen等[21]所得结果一致.加入甲醇后橙Ⅱ分子仍能被氧化降解,且在10min后被氧化的速率明显加快.该结果表明甲醇等·OH淬灭剂的加入并不能改变水中有机污染物的降解途径,而仅仅是改变体系中参与降解过程的·OH的浓度.
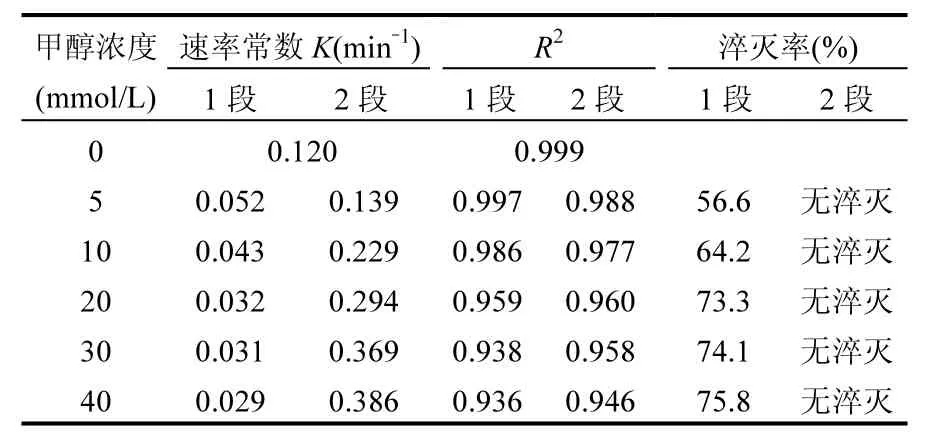
表2 甲醇浓度对多相UV-Fenton体系·OH淬灭效率的影响Table 2 Effect of methanol concentration on scavenging efficiency to ·OH in heterogeneous UV-Fenton system
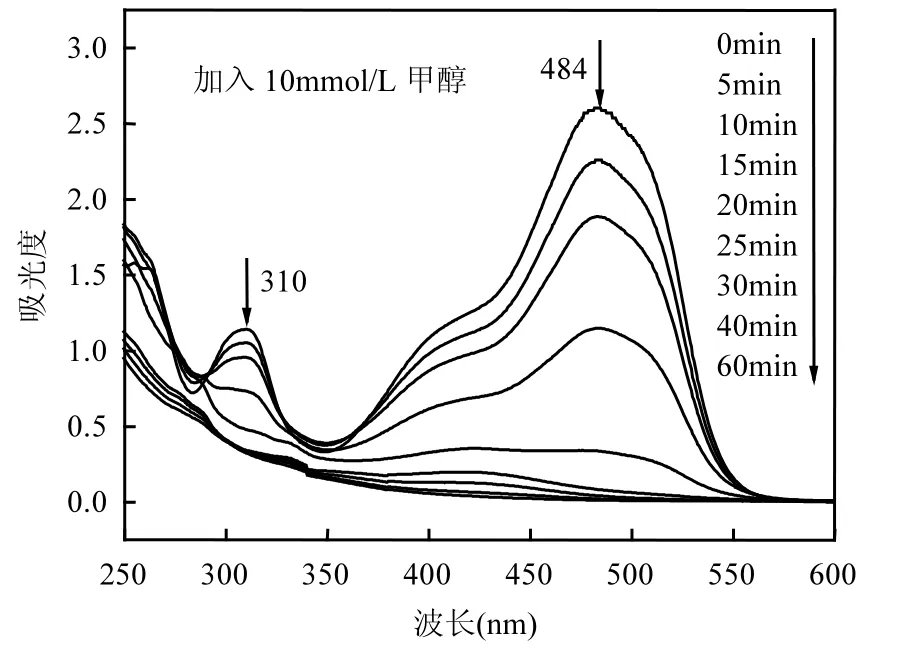
图4 不同时刻橙Ⅱ降解的全波长扫描Fig.4 UV-vis spectra changes of OrangeⅡ as a function of irradiation time
2.3 多元醇羟基数目对多相UV-Fenton体系中·OH淬灭效率的影响
不同羟基个数的甲醇、乙二醇、丙三醇对多相UV-Fenton体系降解橙Ⅱ的影响见图5及表3.加入乙二醇、丙三醇后多相UV-Fenton体系对橙Ⅱ的降解过程同样呈现2个阶段.相比甲醇,乙二醇和丙三醇降解的第1阶段延后至15min. 橙Ⅱ完全降解所需时间随着羟基数目的增加而延长,说明多元醇对·OH 的淬灭随着羟基个数的增加而增强.在醇分子中,由于羟基的影响,使得 α-氢较活泼,容易被氧化和脱氢[33],·OH与醇主要发生夺氢反应,且主要是夺取 α-氢[28].多元醇能提供的该类型氢数量更多,因此与相同链长一元醇相比,其对·OH淬灭能力更强.结合表1及表3,对比正丙醇和丙三醇,乙醇和乙二醇对·OH 淬灭的能力同样可以得出上述结论.不同羟基数目的醇对·OH 淬灭的能力表现为丙三醇>乙二醇>甲醇,其中丙三醇>正丙醇,乙二醇>乙醇.表3的结果显示丙三醇1段对·OH的淬灭率达到86.7%,2段淬灭率仍然能达到 61.7%,说明其对于多相 UVFenton体系的·OH淬灭效果较好.
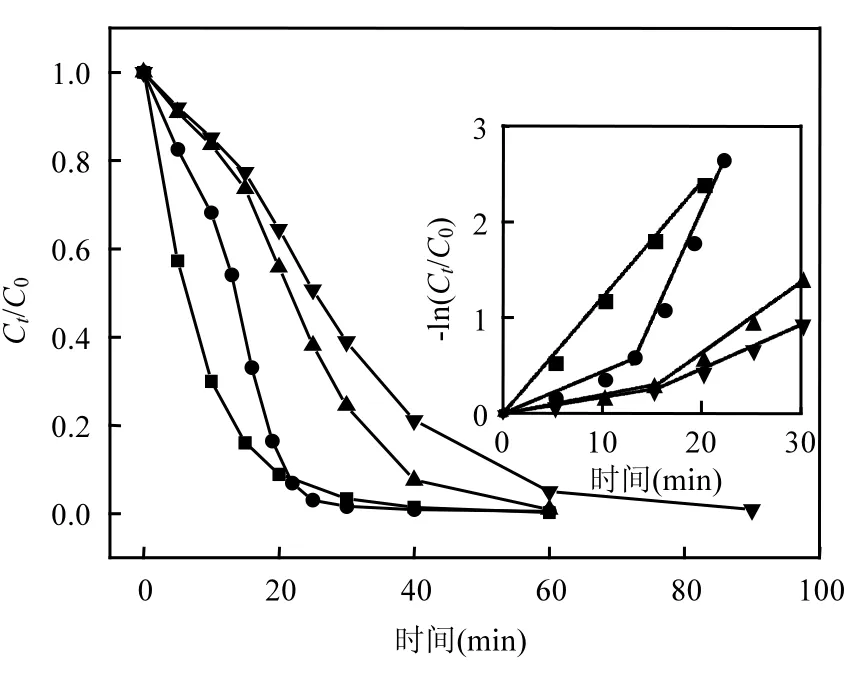
图5 多元醇羟基数对橙Ⅱ降解过程的影响Fig.5 Effect of polyol hydroxyl number on the degradation of OrangeⅡ
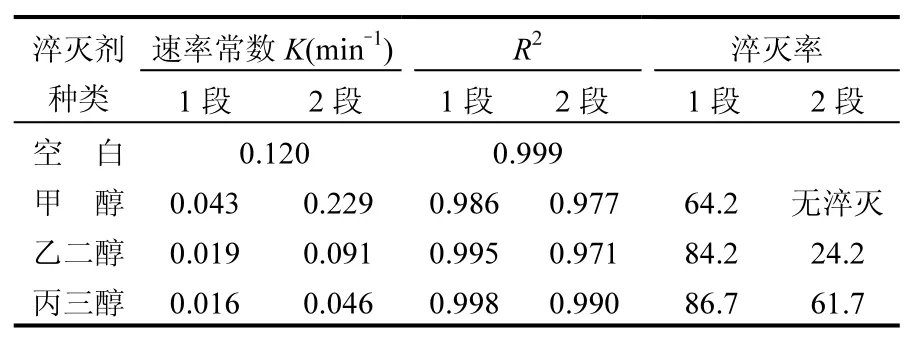
表3 多元醇羟基数对多相UV-Fenton体系·OH淬灭效率的影响Table 3 Effect of polyol hydroxyl number on scavenging efficiency to ·OH in heterogeneous UV-Fenton system
2.4 醇类对多相UV-Fenton体系中·OH生成浓度的影响
为探究醇对多相 UV-Fenton体系·OH生成浓度的影响,采用荧光光谱法对不同条件下·OH的生成进行了定量分析.图 6给出了基础条件下从反应器取样与香豆素混合在紫外光下照射5min后荧光强度的变化.7-羟基香豆素荧光峰值出现在460nm处,且荧光强度值随反应时间呈现先增大后减小的趋势,该图还给出了甲醇、丙三醇、叔丁醇条件下在40min处荧光峰值的比较,其中加入甲醇>不加淬灭剂>丙三醇>叔丁醇.
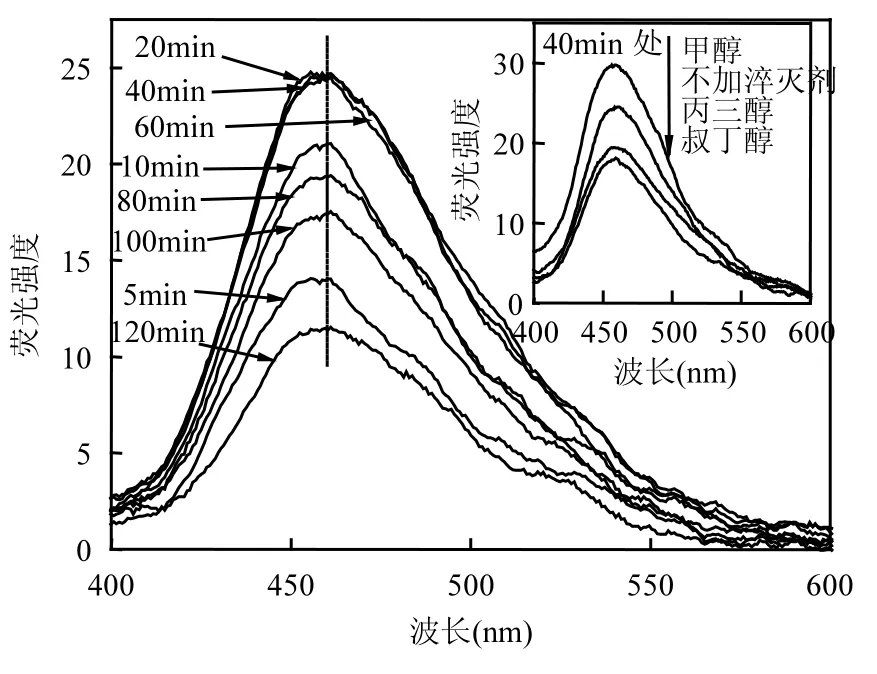
图6 不同反应时间7-羟基香豆素的荧光强度变化Fig.6 Fluorescence intensity changes of 7-hydroxycoumarin as a function of reaction time
不同醇条件下多相 UV-Fenton体系·OH的生成浓度如图 7所示,基础条件下橙Ⅱ脱色的初始阶段·OH的浓度急剧增加,在 60min基本完成脱色后·OH 浓度逐渐减小. Maezono等[19]认为,反应前期·OH增加是因为H2O2分解生成·OH的速率大于·OH 氧化橙Ⅱ的消耗速率,因此体系中·OH 积累,其浓度增加.反应后期随着 H2O2不断被消耗橙Ⅱ的降解基本完成,·OH浓度逐渐减少.体系加入叔丁醇的·OH在整个反应5min后的浓度并没有逐渐增大,而是始终维持在一个相对恒定的水平,说明·OH 在生成过程中不断被叔丁醇淬灭,而参与氧化降解橙Ⅱ的量较少,这时·OH的消耗速率大致等于生成速率.加入丙三醇后25min内·OH的浓度维持相对恒定,25min后·OH浓度逐渐增加但没有超过基础条件·OH浓度的最高值.然而加入 10mmol/L甲醇后 10~30min·OH 浓度急剧增大到 0.32μmol/L(基础条件下·OH浓度最大值为0.26μmol/L),说明此时甲醇对于·OH 的淬灭速率远远小于因甲醇加入后引起的·OH 的生成速率,40min后·OH浓度随着H2O2不断分解及橙Ⅱ的降解完成而逐渐减小.甲醇浓度进一步增大到20mmol/L时, 10~30min内·OH浓度不断增大并达到0.37μmol/L.由此说明,随甲醇浓度的增大, 能极大地促进体系中·OH 的生成,进而导致橙Ⅱ2段降解速率增大.需要说明的是, 甲醇能够促进体系中·OH 生成的具体原因还有待于进一步研究.
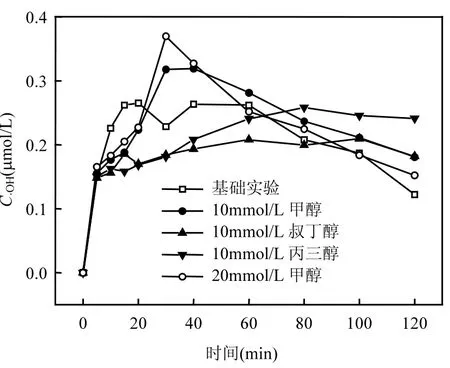
图7 不同醇条件下不同反应时间·OH的生成Fig.7 Hydroxyl radicals generated in different reaction time and different conditions
2.5 醇类对均相UV-Fenton体系中·OH的淬灭比较

图8 醇类对均相UV-Fenton体系橙Ⅱ降解过程的影响Fig.8 Effect of alcohols on degradation of OrangeⅡ in homogeneous UV-Fenton system
不同醇对均相 UV-Fenton体系·OH淬灭的影响如图8及表4所示.对比多相体系,不同醇对均相或多相 UV-Fenton体系·OH效能的影响表现为同一趋势,甲醇在两者体系中对·OH 的淬灭均不稳定,丙三醇、异丙醇、叔丁醇对·OH 的淬灭效果较好,且非常稳定.丙三醇对均相及多相UV-Fenton体系·OH淬灭效果较佳,可作为一种新型高效淬灭剂进行使用.

表4 醇类对均相UV-Fenton体系·OH淬灭效率的影响Table 4 The effect of alcohols on scavenging efficiency to·OH in homogeneous UV-Fenton system
3 结论
3.1 不同链长一元醇对 UV-Fenton体系中·OH淬灭能力为:乙醇>正丙醇>正丁醇>甲醇;若考虑相关醇的同分异构体,一元醇对·OH 淬灭能力为叔丁醇>异丙醇>乙醇>正丙醇>正丁醇>甲醇.
3.2 多元醇随链长和羟基数量的增加,对·OH的淬灭能力增强.
3.3 丙三醇在多相及均相 UV-Fenton体系中,能高效稳定地淬灭·OH,降低体系中·OH 的浓度,是一种高效的·OH淬灭剂.
[1]Feng J Y, Hu X J, Yue P L, et al. Discoloration and mineralization of Reactive Red HE-3B by heterogeneous photo-Fenton reaction[J]. Water Research, 2003,37:3776-3784.
[2]He J, Ma W H, He J J, et al. Photooxidation of azo dye in aqueous dispersions of H2O2/α-FeOOH [J]. Applied Catalyst B:Environmental, 2002,39:211-220.
[3]张亚平,韦朝海,吴超飞,等.光Fenton反应的Ce-Fe/Al2O3催化剂制备及性能表征 [J]. 中国环境科学, 2006,26(3):320-323.
[4]Li M K, Qiang Z M, Pulgarin C, et al. Accelerated methylene blue(MB) degradation by Fenton reagent exposed to UV or VUV/UV light in an innovative micro photo-reactor [J]. Applied Catalyst B: Environmental, 2016,187:83-89.
[5]Elmolla E S, Chaudhuri M, Degradation of the antibiotics amoxicillin, ampicillin and cloxacillin in aqueous solution by the photo-Fenton process [J]. Journal of Hazardous Materials,2009,172:1476-1481.
[6]Lin Z R, Zhao L, Dong Y H. Quantitative characterization of hydroxyl radical generation in a goethite-catalyzed Fenton-like reaction [J]. Chemosphere, 2015,141:7-12.
[7]Louit G, Foley S, Cabillac J, et al. The reaction of coumarin with the OH radical revisited: hydroxylation product analysis determined by fluorescence and chromatography [J]. Radiation Physics and Chemistry, 2005,72:119-124.
[8]Zhang J, Nosaka Y. Quantitative detection of OH radicals for investigating the reaction mechanism of various Visible-Light TiO2photocatalysts in aqueous suspension [J]. The Journal of Physical and Chemistry C, 2013,117:1383-1391.
[9]钟 萍,杨 曦,赵贵来,等.光助 Fenton试剂法氧化处理煤油废水溶液 [J]. 中国环境科学, 2002,22(5):460-463.
[10]Wang Y, Lin X H, Shao Z Z, et al. Comparison of Fenton,UV-Fenton and nano-Fe3O4catalyzed UV-Fenton in degradation of phloroglucinol under neutral and alkaline conditions: Role of complexation of Fe3+with hydroxyl group in phloroglucinol [J].Chemical Engineering Journal, 2017,313:938-945.
[11]Zhang J, Shao X T, Shi C, et al. Decolorization of Acid Orange 7with peroxymonosulfate oxidation catalyzed by granular activated carbon [J]. Chemical Engineering Journal, 2013,232:259-265.
[12]Song S, Xu L J, He Z Q, et al. Mechanism of the photocatalytic degradation of C.I. reactive black 5 at pH 12.0using SrTiO3/CeO2as the catalyst [J]. Environmental Science &Technology, 2007,41:5846-5853.
[13]苏海英,王盈霏,王枫亮,等. g-C3N4/TiO2复合材料光催化降解布洛芬的机制 [J]. 中国环境科学, 2017,37(1):195-202.
[14]Monteagudo J M, Duran A, San Martin I, et al. Roles of different intermediate active species in the mineralization reactions of phenolic pollutants under a UV-A/C photo-Fenton process [J].Applied Catal B: Environmental, 2011,106:242-249.
[15]Hwang S C, Huling S G, Ko S, Fenton-like degradation of MTBE:Effect if iron counter anion and radical scavenger [J].Chemosphere, 2010,78:563-568.
[16]Xu L J, Wang J L, Magnetic nanoscaled Fe3O4/CeO2composite as an efficient Fenton-Like heterogeneous catalyst for degradation of 4-Chlorphenol [J]. Environmental Science & Technology,2012,46:10145-10153.
[17]徐淑英,陈建新,王 琳,等.不同晶型铁氧化物 Fenton和UV-Fenton降解橙Ⅱ的性能 [J]. 安全与环境学报, 2017,17(4):1488-1453.
[18]Tokumura M, Morito R, Hatayama R, et al. Iron redox cycling in hydroxyl radical generation during the photo-Fenton oxidative degradation: Dynamic change of hydroxyl radical concentration[J]. Applied Catal B:Environmental, 2011,106:565-576.
[19]Maezono T, Tokumura M, Sekine M, et al. Hydroxyl radical concentration profile in photo-Fenton oxidation process:Generation and consumption of hydroxyl radicals during the discoloration of azo-dye Orange Ⅱ [J]. Chemosphere, 2011,82:1422-1430.
[20]Baba Y, Yatagai T, Harada T, et al. Hydroxyl radical generation in the photo-Fenton process:Effects of carboxylic acids on iron redox cycling [J]. Chemical Engineering Journal, 2015,277:229-241.
[21]Chen J X, Zhu L Z. Catalytic degradation of OrangeⅡ by UV-Fenton with hydroxyl-Fe-pillared bentonite in water [J].Chemosphere, 2006,65:1249-1255.
[22]Chen J X , Zhu L Z, UV-fenton discolouration and mineralization of Orange Ⅱ Over hydroxyl-Fe-pillared bentonite [J]. Journal of Photochemistry and Photobiology: A: Chemistry, 2007,188:56-64.
[23]Li G T, Wong K H, Zhang X W, et al. Degradation of Acid Orange 7using magnetic AgBr under visible light: The roles of oxidizing species [J]. Chemosphere, 2009,76:1185-1191.
[24]林晓旋,刘国光,李若白,等.臭氧作用下酮洛芬的降解行为及机理研究 [J]. 中国环境科学, 2017,37(2):598-605.
[25]张剑桥,迟惠中,宋 阳,等.Ce3+与 Cu2+协同强化 Fenton体系氧化苯酚的效能与机制研究 [J]. 环境科学, 2016,37(8):3067-3072.
[26]朱维晃,袁 博,杨 瑞.蒽醌类溶解有机质和模拟太阳光耦合驱动下的Fenton法对罗丹明B脱色特征的影响因素研究 [J].环境科学学报, 2015,35(2):508-513.
[27]Wang M L, Fang G D, Liu P, et al. Fe3O4@β-CD nanocomposite as heterogeneous Fenton-like catalyst for enhanced degradation of 4-chlorophenol (4-CP) [J]. Applied Catal B:Environmental,2016,188:113-122.
[28]Buxton G V, Greenstock C L, Helman W P, et al. Critical review of rate constants for reactions of hydrated electrons, hydrogen atoms and hydroxyl radicals (·OH/·O-) in aqueous solution [J].Journal of Physical and Chemical Reference Data, 1988,17:513-886.
[29]Xue X F, Hanna K, Despas C, et al. Effect of chelating agent on the oxidation rate of PCP in the magnetite/H2O2system at neutral pH [J]. Journal of Molecular Catalyst A: Chemical, 2009,311:29-35.
[30]存 洁,田森林,王 倩,等.二茂铁催化光助非均相类 Fenton氧化法处理含罗丹明 B废水 [J]. 中国环境科学, 2013,33(6):1011-1016.
[31]Chen F X, Xie S L, Huang X L et al. Ionothermal synthesis of Fe3O4magnetic nanoparticles as efficient heterogeneous Fentonlike catalysts for degradation of organic pollutants with H2O2[J].Journal of Hazardous Materials, 2017,322:152-162.
[32]Romão J, Salata R, Park S Y, et al. Photocatalytic methanol assisted production of hydrogen with simultaneous degradation of methyl orange [J]. Applied Catalyst A: General, 2016,518:206—212.
[33]曾昭琼.有机化学(第四版)上册 [M]. 北京:高等教育出版社,2004:272.

