聚酰胺复合纳滤膜去除水中PFOS的研究
许长青,王 磊,王佳璇,职 瑞 (西安建筑科技大学环境与市政工程学院,陕西省膜分离重点实验室,陕西 西安 710055)
作为一种人工合成的化合物,全氟辛烷磺酸(PFOS)的生产和使用已有超过 50a的历史.PFOS的分子结构中含有疏水的碳氟长链和亲水的磺酸基,因而具有非常优良的表面性能.目前发现的 PFCs大都具有很强的疏水性,在水中的溶解度很低,但由于 PFOS含有亲水的磺酸基并且通常以阴离子的形式存在,因而在水中的溶解度较高(570mg/L)[1-3].国内外已有大量的相关文献报道发现,PFOS能在水体中长期存在,造成地表水、地下水甚至饮用水等各种水体的污染[4-8]. PFOS被广泛用于灭火剂、感光材料表面处理剂、纺织品和皮革的整理剂、纸张的表面防污涂层、航空液压油、半导体行业的光阻剂和电镀行业的铬雾抑制剂等与人类生产和生活密切相关的产品中.
已有研究表明,PFOS具有引起机体脂质过氧化、致畸、致癌及神经毒性等多种毒性效应;而且在环境中较难降解,可远距离传输,并随食物链在动物和人体中累积、放大,因此被认为是新的一类具有内分泌干扰特性的持久性有机污染物[9].由于 PFOS具有生态毒性,如何有效地去除水中的 PFOS成为时下环境治理领域的一个热点,因此寻找一种高效可靠地去除 PFOS的技术方法显得尤为重要.
目前,比较典型的去除水中PFOS的方法有:膜处理工艺、吸附技术、光化学分解、声化学降解等.膜处理工艺相比其它工艺具有能耗低、效率高和工艺简单等特点[10],大量研究表明纳滤法对小分子痕量有机物的去除效果比较好[11-14].运用纳滤膜去除水中PFOS的相关研究较少,有很多影响因素尚未研究.针对现有研究的不足,本实验从PFOS浓度、离子种类、溶液总离子强度以及海藻酸对膜截留 PFOS的影响几方面展开研究,考察了纳滤膜去除水中 PFOS的性能与特征.
纳滤(NF)膜作为20世纪80年代末发展起来的一项新型的膜分离技术,其孔径范围介于反渗透(RO)膜和超滤(UF)膜之间[15-21].由于纳滤膜截留溶质的尺寸小于超滤膜,大于反渗透膜,且表面通常带电,这些独特的分离性能使得纳滤膜在去除水中天然有机物、药物、环境内分泌干扰物和个人护理品等低浓度有机物中发挥重要作用,可实现最大程度地去除水体中的有毒有害物质[22-24].本研究采用聚酰胺复合纳滤膜去除水中的 PFOS,主要考察 PFOS浓度、离子种类、总离子强度以及海藻酸等不同条件对纳滤膜去除PFOS及膜污染的影响,旨在为纳滤膜去除水中微量 PFOS的实际应用提供更多的理论支持.
1 材料与方法
1.1 实验试剂和水样
全氟辛烷磺酸(PFOS,100mg,纯度≥97%,美国 Sigma-aldrich公司),海藻酸(AA,美国 Sigmaaldrich公司),乙腈(色谱纯,美国 Thermo-Fisher公司),甲醇(色谱纯,美国 Thermo-Fisher 公司),氯化钠(分析纯,广东光华科技股份有限公司).氯化钙(分析纯)、氯化镁(分析纯)、氢氧化钠(分析纯)、盐酸(分析纯)均购买于天津市天力化学试剂有限公司.
实验原水是将 PFOS溶液、海藻酸和/或一定量的氯化钙、氯化钠添加到去离子水中配制而成.PFOS储备液浓度为30mg/L,置于4℃冰箱内保存.本实验中PFOS的初始浓度为10μg/L,海藻酸储备液浓度 2g/L,氯化钙、氯化钠用量按实验所需称量,使用氢氧化钠溶液和盐酸调节原水使其 pH=(7.5±0.1),氢氧化钠溶液和盐酸浓度均为1mol/L.在每一种污染实验前,将一定量标准储备液用去离子水稀释至所需浓度,将配好的污染液进行搅拌,使其充分混合,实验所需污染液均现用现配.
1.2 实验装置及过程
纳滤反应装置采用小型错流平板纳滤测试系统,如图 1所示.有效膜面积为 48cm2(12cm×4cm).实验用膜为聚酰胺纳滤膜.过滤试验条件均为:温度(23±1)℃,压力 0.6MPa,错流速度4.5cm/s.
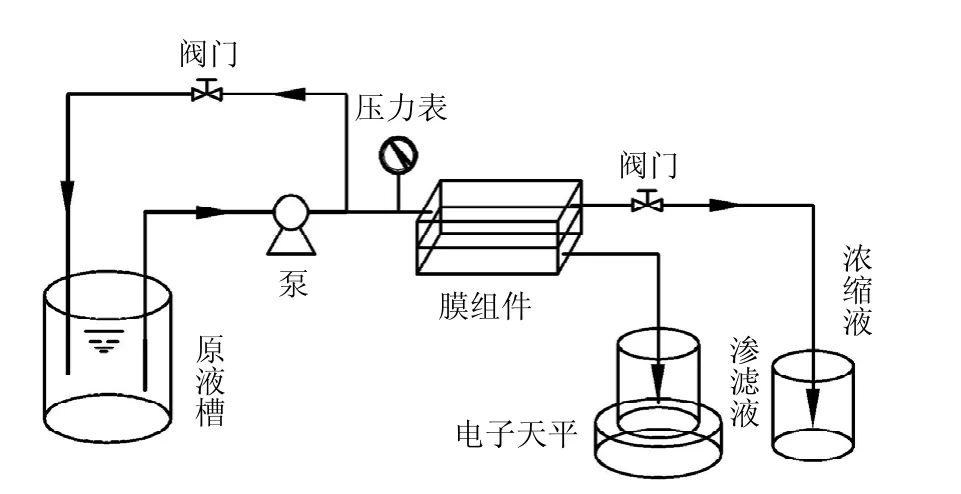
图1 小型错流平板纳滤测试装置示意Fig.1 Schematic diagram of cross flow flat nanofiltration test device
膜的渗透通量J计算公式如下:

式中:J为渗透通量,L/(m2·h);V为溶液渗透量,L;S为膜的有效面积,m2;t为过滤时间,h.
本实验主要分为 3个阶段,具体操作过程如下:(1)取一张性能良好的纳滤膜置于测试装置中用离子水预压 12h,直至膜通量稳定.(2)待膜通量稳定后,若所需原液中加入电解质,则需将去离子水换成相应的电解质基线溶液,过滤 1h,待通量稳定后记录初始膜通量 J0.若不加电解质则不需要进行此操作步骤.(3)换用新制备的PFOS污染液作为原液进行过滤试验 12h,为了保持原水中化学组成恒定,滤液回流至原液槽,并用电子天平实时监测污染过程中膜通量J1的变化.将料液换成 PFOS污染液后,每隔一定时间对原液和滤液取一次样,并置于冰箱内以待萃取.样品制取后,测定原液和滤液中PFOS的浓度,计算截留率,最后选取实验误差在1%以内的实验数据进行分析,截留率的计算公式如下:
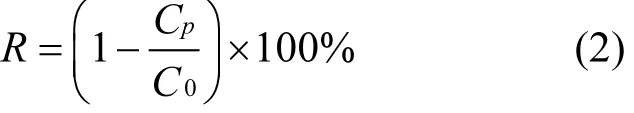
式中:Cp、C0分别表示 PFOS在滤液中和原液中的浓度,μg/L.
1.3 样品前处理
采用 CNW Poly-Sery HLB固相萃取柱(6mL,150mg,上海安谱实验科技股份有限公司)萃取水样中的 PFOS,依次用 4mL 0.1%氨水甲醇、4mL甲醇、4mL去离子水对固相萃取小柱进行活化;接着将水样过柱;之后用 4mL甲醇水(1:1,pH=5)进行淋洗并抽真空 20min,再用 4mL 0.1%氨水甲醇进行洗脱,洗脱后氮吹浓缩并进行定量分析.
1.4 仪器及分析方法
采用超高效液相色谱—三重四级杆质谱联用仪(UPLC- MS/MS,美国 Waters公司)进行PFOS样品分析.色谱柱为 C18柱(Waters AQUITY UPLC,柱长:100mm,内径:2.1mm,柱内填料粒径:1.7μm),流动相为乙腈/超纯水,流速为0.2mL/min.采用扫描电镜(SEM,JSM-6510LV,日本 JEOL)观测污染膜的表面结构;采用马尔文Zeta电位仪(ZS90Zeta,马尔文,英国)测定不同污染液的 Zeta电位;采用固体表面 zeta电位仪(SurPASS, AntonPaar GmbH,奥地利)测定纳滤膜的表面Zeta电位.
为减小实验误差,每组实验均做 3个平行样品进行测定.
2 结果与讨论
2.1 PFOS浓度对纳滤膜去除PFOS的影响
用去离子水稀释 PFOS储备液,配制不同浓度的 PFOS溶液,分别在 PFOS浓度为 5,10,25,50μg/L的条件下,考察纳滤膜对PFOS的去除效果,结果如图2所示.
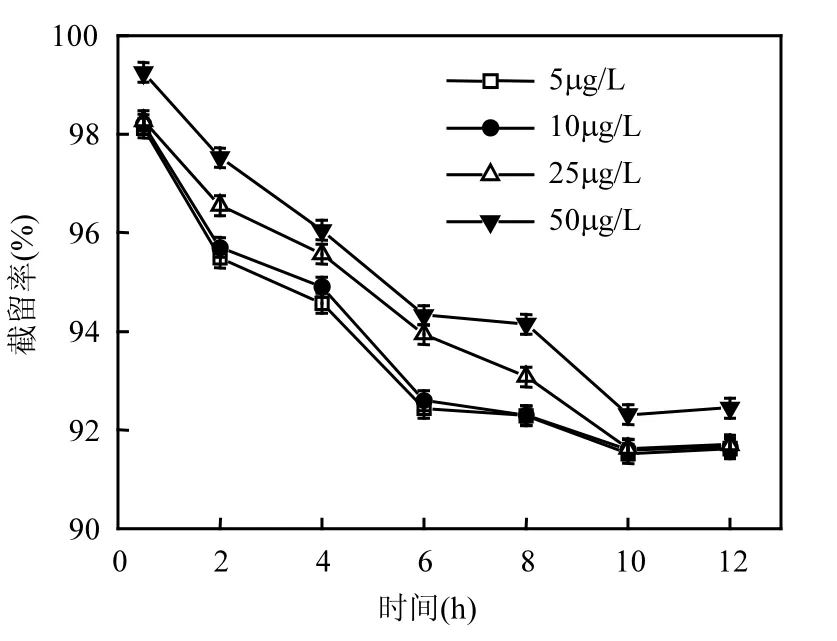
图2 PFOS浓度对PFOS截留率的影响Fig.2 Effects of PFOS concentration on the rejection of PFOS
由图 2可知,随着 PFOS浓度的升高,PFOS的截留率升高.这与纳滤膜对 PFOS的筛分作用有关,PFOS的分子量约为 499Da,而聚酰胺纳滤膜的截留分子量为 350Da,可知膜对 PFOS有一定的截留作用;随着PFOS浓度的升高,膜孔堵塞现象愈加明显,筛分作用增强,截留率上升.在过滤时间达到10h后,纳滤膜对PFOS的截留率仍可达到 90%以上.相似地,张莉等[25]考察了纳滤膜对水中环境荷尔蒙类小分子痕量有机物的去除效果,溶液浓度从 5µg/L增加到 500µg/L,截留率升高,且去除率基本都在85%以上,变化情况相似,机理一致.
2.2 溶液总离子强度对PFOS去除的影响
往原水中加入 NaCl溶液,调节溶液总离子强度分别为10,50,100,150mmol/L,比较不同总离子强度环境下膜对 PFOS截留效果的影响,结果如图3所示.
结果表明,当水样中的总离子强度越高,PFOS的截留率也随之升高.在溶液 pH=7.5±0.1的条件下,纳滤膜表面带有的官能团主要为去质子化的羧酸基团[26];同时,由于 PFOS的 pKa(酸度系数)值非常低,在pH=7.5±0.1的条件下,PFOS会发生解离并带有负电荷[27],根据以上的分析,可知纳滤膜表面和 PFOS都带负电,静电排斥作用是纳滤膜能够将PFOS截留的一个重要原因.溶液中存在的Na+可以中和膜与PFOS污染物所带的负电荷,使得静电排斥作用减小,因此更多的 PFOS能够吸附在膜表面.Na+浓度越高,电荷中和作用越明显,静电排斥作用越小,PFOS的截留率随之升高.另外,膜电位减小导致膜孔发生收缩,筛分作用增强,也是截留率升高的重要原因.在过滤实验前,膜面带电量为-23.2±0.1mV,随着溶液中离子强度的增加,膜表面所带负电荷逐渐减少(表1),膜孔收缩愈加明显,PFOS的截留率随之升高.
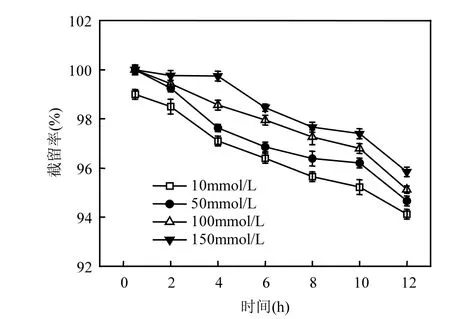
图3 不同总离子强度对PFOS去除的影响Fig.3 Effects of total ionic strength on the rejection of PFOS
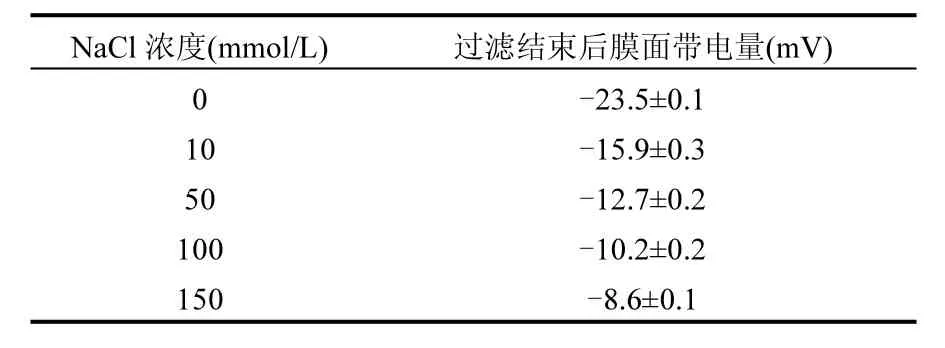
表1 不同总离子强度下过滤结束后膜面带电量Table 1 The membrane surface charge under different total ionic strengths after filtration
2.3 不同离子种类对PFOS截留效果的影响
分别往原水中加入 NaCl、CaCl2和 MgCl2来比较 3种电解质存在条件下,纳滤膜对 PFOS的截留效果.调节Ca2+、Mg2+离子强度为1mmol/L,用 NaCl调节溶液总离子强度都为 10mmol/L,结果如图4所示.
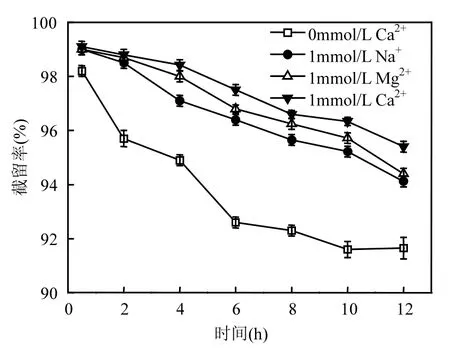
图4 不同离子种类对PFOS截留率的影响Fig.4 Effects of different electrolytes on the rejection of PFOS
结果显示,当水样中加入电解质后,PFOS的截留率有所升高,特别是钙离子存在时,PFOS的截留率提高十分明显,在过滤 12h时截留率仍高于95%.这是因为钙、镁离子会与PFOS发生络合反应,而钠离子则不会,络合之后目标污染物体积增大,膜的筛分作用增强,截留率提高.同时,钙离子和镁离子会对膜和 PFOS产生电中和及静电屏蔽作用,这对截留率的提升也发挥着重要作用.相似地,张健等[28]考察了不同操作压力(0.4,0.8,1.0,1.2MPa)下,Na+、Ca2+对水中 PFOS 的纳滤分离效果的影响,结果表明:与一价Na+相比,二价Ca2+对PFOS截留率的提高更为显著.
2.4 钙离子浓度对PFOS截留效果的影响
通过往原水中分别加入1,2,3mmol/L CaCl2,并加入NaCl调节溶液总离子强度为10mmol/L,将原水的pH值调节为7.5,考察纳滤膜对PFOS的去除效果,结果如图5所示.
结果表明,溶液中钙离子浓度越高,膜对PFOS的去除率也越高. Zhao等[29]考察了0.1,0.5,1.0,2.0mmol/L Ca2+分别与 100µg/L PFOS共存时,对水中 PFOS的纳滤去除效果的影响,也发现随着Ca2+浓度的增大, PFOS的截留率升高.造成该结果的可能原因如下:
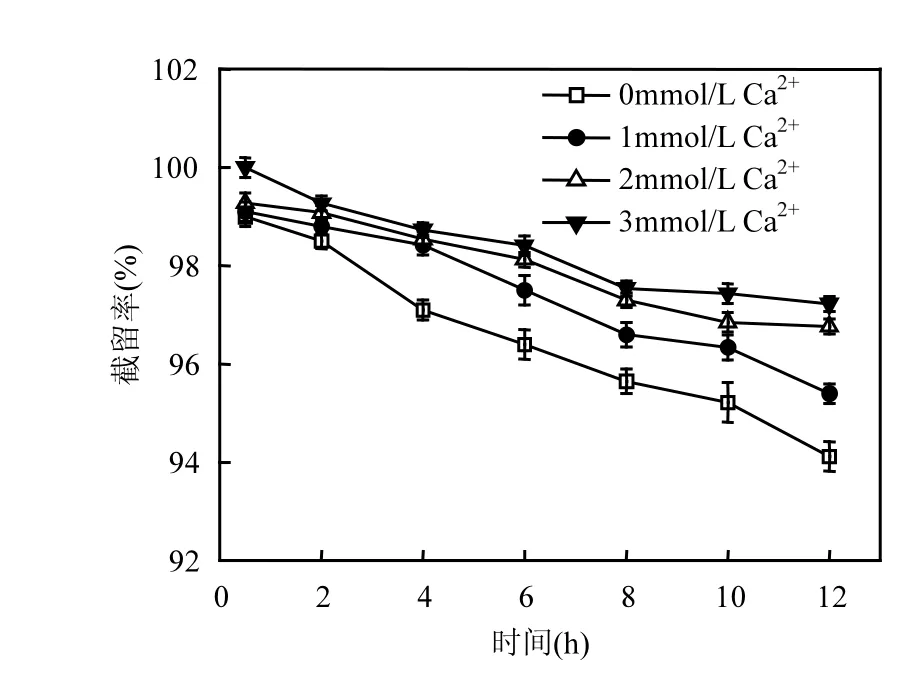
图5 不同钙离子浓度对PFOS截留率的影响Fig.5 Effects of different calcium ion concentration on the rejection of PFOS
(1)由于膜面含有氨基(-NH2)以及羧基(-COOH),PFOS溶液中的钙离子会使膜面与PFOS之间发生表面架桥作用,其过程如下:
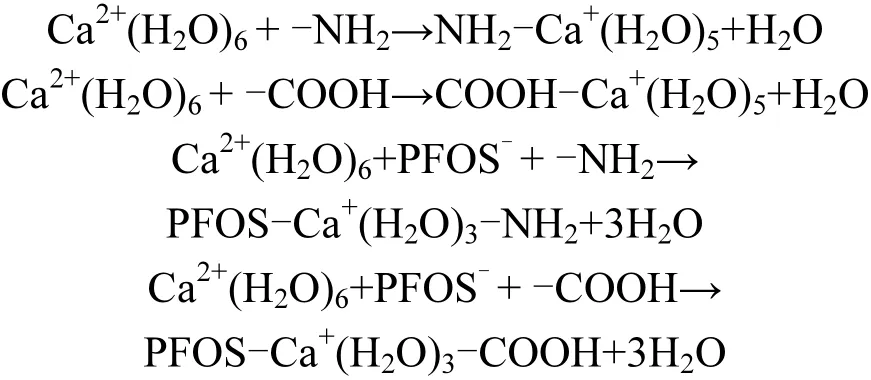
表面架桥作用会降低膜表面负电位,使得一部分PFOS吸附于膜面.
(2)钙离子的存在使 PFOS之间发生主体架桥作用,主体架桥过程如下:
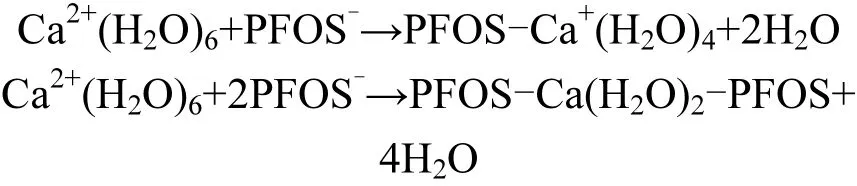
主体架桥对 PFOS截留的影响:减小 PFOS与膜面之间的静电斥力,使得PFOS在膜面的吸附作用增强[30-32];主体架桥作用使污染物体积增大,增强了膜对污染物的筛分作用.以上两种作用均加强了膜对PFOS的截留效果,也同时说明了筛分作用对纳滤膜去除 PFOS发挥了主要作用.
2.5 海藻酸对纳滤膜去除PFOS的影响
2.5.1 海藻酸对 PFOS截留率的影响 通过往原水中加入海藻酸,考察海藻酸对 PFOS去除情况的影响.海藻酸浓度为10mg/L,溶液pH值为 7.5,钙离子浓度为 1mmol/L,结果如图 6所示.
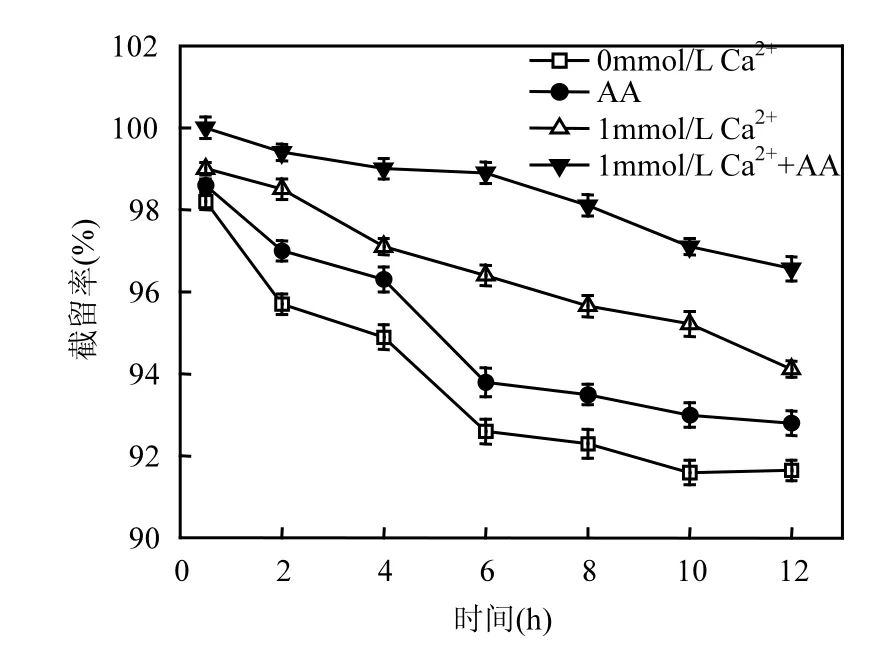
图6 海藻酸对PFOS截留率的影响Fig.6 Effects of alginate on the rejection of PFOS
由图 6可知,当 PFOS水样中加入海藻酸时,PFOS的截留率上升,尤其是在PFOS与钙离子共存的条件下,PFOS的截留率有很大提高.这是由于海藻酸带有大量解离的羧基,加入溶液中后,使 PFOS与膜面的静电斥力增加;同时,PFOS会与海藻酸结合,这一定程度上增大了污染物体积,使得膜对 PFOS的筛分作用增强[33-34].综上可知,在加入海藻酸后,两种作用同时发生,使得 PFOS的去除率有一定程度的提高.
2.5.2 海藻酸导致的膜污染 加入海藻酸虽然能够大幅提高PFOS的截留率,但是也会造成膜污染,导致膜通量的下降.利用扫描电子显微镜对污染后的纳滤膜的表面进行分析,结果如图7所示.
由图 7可以看出,在经过含有海藻酸的水样过滤后,纳滤膜表面积聚了很多污染物,膜孔堵塞现象明显,证实了膜污染的发生,而膜污染会引起膜通量的衰减.

图7 不同条件下膜表面扫描电镜图片Fig.7 SEM images of membrane surface for different conditions
3 结论
3.1 运用聚酰胺复合纳滤膜可以有效地去除水中的微量 PFOS.随着溶液中 PFOS浓度的升高,膜的筛分作用也变得更加明显,截留率也随之升高;过滤10h后,PFOS的去除率基本趋于平稳且仍可达到90%以上.
3.2 溶液中总离子强度以及离子种类是影响纳滤膜去除水中 PFOS效果的重要因素:随着溶液总离子强度的升高,PFOS与膜面之间的静电斥力减小,膜对PFOS的筛分作用增强,截留率提高;过滤12h时,在溶液总离子强度为150mmol/L的条件下,膜对PFOS的截留率仍在96%以上.PFOS截留受二价离子的影响较大,当离子浓度皆为1mmol/L时,Ca2+存在时纳滤膜对 PFOS的截留率高于 Na+存在时的截留率;另外,在表面架桥和主体架桥的作用下,随着 Ca2+浓度的增大,膜对PFOS的截留率升高.
3.3 溶液中加入海藻酸后,PFOS与膜面的静电斥力增加,同时污染物体积增大,筛分作用增强,PFOS的截留率有所提高.在pH=7.5,钙离子浓度 1mmol/L,海藻酸浓度为 10mg/L的条件下,过滤12h后PFOS的去除率仍可达到96%;但膜表面积累了一层污染物,导致膜污染的发生从而引起膜通量下降.
[1]Betts K S. Perfluoroalkyl acids: what is the evidence telling us?[J]. Environmental Health Perspectives, 2007,115(5):A250-A256.
[2]金一和,汤先伟,曹秀娟,等.全球性全氟辛烷磺酰基化合物环境污染及其生物效应 [J]. 自然杂志, 2002,24(6):344-348.
[3]Zhang R, Yan W, Jing C. Mechanistic study of PFOS adsorption on kaolinite and montmorillonite [J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2014,462:252-258.
[4]Moody C A, Hebert G N, Strauss S H, et al. Occurrence and persistence of perfluorooctanesulfonate and other perfluorinated surfactants in groundwater at a fire-training area at Wurtsmith Air Force Base, Michigan, USA [J]. Journal of Environmental Monitoring, 2003,5(2):341-345.
[5]Lein N P H, Fujii S, Tanaka S, et al. Contamination of perfluorooctane sulfonate (PFOS) and perfluorooctanoate (PFOA)in surface water of the Yodo River basin (Japan) [J]. Desalination,2008,226(1-3):338-347.
[6]Hansen K J, Johnson H O, Eldridge J S, et al. Quantitative characterization of trace levels of PFOS and PFOA in the Tennessee River [J]. Environmental Science & Technology, 2002,36(8):1681-1685.
[7]Ju X, Jin Y, Sasaki K, et al. Perfluorinated surfactants in surface,subsurface water and microlayer from Dalian coastal waters in China [J]. Environmental Science & Technology, 2008,42(10):3538-3542.
[8]Dauwe T, Van de Vijver K, De Coen W, et al. PFOS levels in the blood and liver of a small insectivorous songbird near a fluorochemical plant [J]. Environment International, 2007,33(3):357-361.
[9]Van Gossum H, Bots J, Snijkers T, et al. Behaviour of damselfly larvae (Enallagma cyathigerum)(Insecta, Odonata) after longterm exposure to PFOS [J]. Environmental Pollution, 2009,157(4):1332-1336.
[10]卢丽娟,唐敏康,陈 瑛,等.典型全氟化合物的去除技术研究进展 [J]. 四川环境, 2016,35(5):135-141.
[11]莫颖慧.污水纳滤深度处理的膜污染及其对微量有机物截留的影响 [D]. 北京:清华大学, 2013.
[12]毕 飞,陈欢林,高从堦.纳滤膜去除饮用水中微量有机物的研究进展 [J]. 现代化工, 2011,(7):21-26.
[13]Zhong P S, Widjojo N, Chung T S, et al. Positively charged nanofiltration (NF) membranes via UV grafting on sulfonated polyphenylenesulfone (sPPSU) for effective removal of textile dyes from wastewater [J]. Journal of Membrane Science, 2012,417:52-60.
[14]Ogutverici A, Yilmaz L, Yetis U, et al. Triclosan removal by NF from a real drinking water source—Effect of natural organic matter[J]. Chemical Engineering Journal, 2016,283:330-337.
[15]刘茉娥等编著.膜分离技术 [M]. 北京:化学工业出版社,1998:1-3.
[16]陈敏恒等编著.化工原理(第 2版) [M]. 北京:化学工业出版社,2000:284-286.
[17]刘家棋,姜忠义,王春艳,等.分离过程与技术 [M]. 天津:天津大学出版社, 2001:254-262.
[18]卢红梅.纳滤膜的特性及其在国内水处理中的应用进展 [J].过滤与分离, 2002,12(1):38-41.
[19]松本丰,岑运华.日本NF膜,低压超低压RO膜及应用技术的发展 [J]. 膜科学与技术, 1998,18(5):12-18.
[20]岳志新,马东祝,赵丽娜,等.膜分离技术的应用及发展趋势 [J].云南地理环境研究, 2006,18(5):52-57.
[21]Van der Bruggen B, Everaert K, Wilms D, et al. Application of nanofiltration for removal of pesticides, nitrate and hardness from ground water: rejection properties and economic evaluation [J].Journal of Membrane Science, 2001,193(2):239-248.
[22]Koyuncu I, Arikan O A, Wiesner M R, et al. Removal of hormones and antibiotics by nanofiltration membranes [J].Journal of Membrane Science, 2008,309(1):94-101.
[23]Braeken L, Van der Bruggen B. Feasibility of nanofiltration for the removal of endocrine disrupting compounds [J]. Desalination,2009,240(1-3):127-131.
[24]Listiarini K, Tan L, Sun D D, et al. Systematic study on calcium—alginate interaction in a hybrid coagulation-nanofiltration system[J]. Journal of Membrane Science, 2011, 370(1):109-115.
[25]张 莉.纳滤去除水中痕量环境荷尔蒙污染物质的影响因素研究 [D]. 西安:西安建筑科技大学, 2007.
[26]Wang J, Wang L, Miao R, et al. Enhanced gypsum scaling by organic fouling layer on nanofiltration membrane: characteristics and mechanisms [J]. Water Research, 2016,91:203-213.
[27]Campbell T Y, Vecitis C D, Mader B T, et al. Perfluorinated surfactant chain-length effects on sonochemical kinetics [J]. The Journal of Physical Chemistry A, 2009,113(36):9834-9842.
[28]张 健,赵长伟,宋 娜,等.纳滤去除饮用水中的 PFOS [J]. 环境工程学报, 2013,7(11):4236-4240.
[29]Zhao C, Zhang J, He G, et al. Perfluorooctane sulfonate removal by nanofiltration membrane the role of calcium ions [J]. Chemical Engineering Journal, 2013,233:224-232.
[30]Zhao C, Tang C Y, Li P, et al. Perfluorooctane sulfonate removal by nanofiltration membrane—the effect and interaction of magnesium ion/humic acid [J]. Journal of Membrane Science,2016,503:31-41.
[31]Wang F, Shih K. Adsorption of perfluorooctanesulfonate (PFOS)and perfluorooctanoate (PFOA) on alumina: influence of solution pH and cations [J]. Water Research, 2011,45(9):2925-2930.
[32]Mezei G, Raptis R G. Pyrazole-4-sulfonate networks of alkali and alkaline-earth metals. Effect of cation size, charge, H-bonding and aromatic interactions on the three-dimensional supramolecular architecture [J]. New Journal of Chemistry, 2003,27(9):1399-1407.
[33]Chang E E, Chang Y C, Liang C H, et al. Identifying the rejection mechanism for nanofiltration membranes fouled by humic acid and calcium ions exemplified by acetaminophen,sulfamethoxazole, and triclosan [J]. Journal of Hazardous Materials, 2012,221:19-27.
[34]Hong S, Elimelech M. Chemical and physical aspects of natural organic matter (NOM) fouling of nanofiltration membranes [J].Journal of Membrane Science, 1997,132(2):159-181.

