温度对FBAR反应器的运行特性及古菌微生物群落影响
赵洪颜,李 雪,李 楠,刘虹豆,朴仁哲,许广波,李艳茹,王伟东,崔宗均 (.延边大学农学院,
吉林 延吉 133002;2.黑龙江八一农垦大学生命技术学院,黑龙江 大庆 163000;3.中国农业大学生物质工程中心,北京 100091)
温度是影响有机废水厌氧发酵的重要因素之一.厌氧发酵温度大体上分为低温发酵(<20℃)、中温发酵(25~40℃)、高温发酵(>45℃)[1].高温厌氧发酵可以缩短发酵时间,底物广泛,杀死农业害虫,出水满足卫生标准[2],但能耗较高;中温厌氧消化目前研究较为广泛,但是对大肠杆菌等灭菌率低,反应运行也需要一定的能耗.研究表明未来厌氧发酵趋势是发展低温和室温厌氧发酵技术,因为高温和中温厌氧反应器运行过程中要消耗一定的热能,所以低温或室温厌氧发酵将会提高一定的经济利益[3-4].
国内外学者对不同温度环境下,不同类型的反应器处理有机废水和人工合成废水工艺进行了大量的研究.对高温(55℃)、中温(35℃)、低温(18~5℃)等温度条件下,用膨胀颗粒污泥床反应器(EGSB)、上流式厌氧污泥床反应器(UASB)、厌氧折流板反应器、搅拌式反应器和固定床厌氧反应器,处理工业废水、人工合成的葡萄糖废水等,均在单一温度或不同温度的运行效果和微生物群落变化进行了研究,结果表明在不同的温度下不同类型反应器的运行效果和微生物的群落丰富性及优势菌群存在一定的差异[5-8].但对同一类型反应器的 3个温度下微生物群落的变化研究较少,尤其是对固定床厌氧反应器不同温度下运行效果和微生物群落变化的研究尚未见到报道.
本研究以炭纤维为载体的固定床厌氧反应器(FBAR),研究不同温度下反应器运行效果及微生物群落.通过产气量、甲烷含量、出水的 VFA指标比较运行特性,采用克隆文库和定量PCR技术分析微生物群落的变化,探索固定床厌氧反应器最佳的运行温度及最佳温度条件下微生物群落的动态变化,旨在为将来固定床厌氧反应器在沼气工程中的应用提供理论基础.
1 材料与方法
1.1 反应器结构
固定床反应器使用 10mm厚的有机玻璃自行设计加工制作而成,有效容积为 10L,外径为24cm,总高度31cm,采用比表面积为1100m2/g的炭纤维(CF, Japan Carbon Company)作为反应器的微生物载体,用不锈钢丝包裹成 7个圆柱形的炭纤维载体(高:27cm;直径:5.5cm)放入反应器内.糖蜜废水由蠕动泵从反应器底部泵入反应器内,反应器所产的沼气由顶部所连接的集气袋来进行收集,通过排水法来进行气体体积的测量.在整个实验阶段,定期对反应器的出水与产气进行取样,用于检测 COD、pH值和甲烷含量.反应器置于生化培养箱内(Model MIR 254, Sanyo, Janpan),来控制反应器的运行温度,整套装置如图1所示.
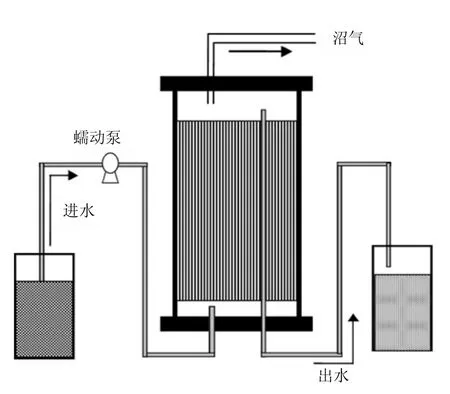
图1 反应器装置示意Fig.1 Schematic diagrams of the fixed-bed reactor
1.2 实验材料
反应器接种污泥的量为4L.接种污泥从天津可口可乐加工厂废水处理反应器中取得(种泥为长期处理含糖量较高的废水),总固体(TS)含量为33.63%,挥发性固体(VS)含量为6.16%.由10L的糖蜜(垂度:70%;糖度:45%),800g 猫粮和90L 的自来水配成COD为100000mg/L的原始糖蜜废水,稀释成所需要的 COD并且 COD: N: P维持在300~500:5:1 以提供微生物的生长所需.
1.3 反应器运行条件
反应器处理恒定 COD的糖蜜废水,糖蜜是微生物生长的主要碳源.3个反应器在中温(35℃)启动成功,初始COD为5000mg/L,水力停留时间(HRT)为3d,每个HRT增加5000mg/L,直至COD为20000mg/L.R1反应器在中温(35℃)正常运行,反应器的有机负荷(OLR)为 6.7kg/(m3·d),运行14d;R2反应器COD浓度恒定,逐渐增加温度,每2个 HRT 增加 5℃,直至温度达到 50℃,反应器的OLR 为 6.7kg/(m3·d),运行 14d;R3 反应器逐渐降低温度,每 2个 HRT 降低 5℃,当温度达到 15℃时,COD 降低到 10000mg/L,直至温度达到 4℃时,COD为 10000mg/L,反应器的 OLR为3.33kg/(m3·d),运行 14d.糖蜜废水用 5 当量的氢氧化钠来调节其pH值在7.0±0.2.
1.4 测定项目和方法
进出水pH值测定:用日本HOBA公司生产的B-212型微量pH计测定每天的进出水的pH值;进出水COD测定:在运行过程中,每隔2d分别取一次进、出水样,用COD速测仪(型号ET99731,德国 Lovibond公司产)按照说明书的方法进行测定;产气量:用湿式气体流量计(LML.1型,长春汽车滤清器有限责任公司)记录产气量;污泥总固体(TS)和挥发性固体(VS):采用重量法测定污泥总固体(TS)和挥发性固体(VS)[9];出水中挥发性脂肪酸(VFA)测定:岛津高效液相色谱(LCMS2020)测定[2].
1.5 微生物群落分析
1.5.1 样品DNA提取与16S rRNA基因PCR扩增 每个反应器运行结束时取样 2个,分别是炭纤维载体上附着的生物膜污泥与反应器底部的沉积污泥.沉积污泥的取样点在反应器的底部;附着污泥的取样点为每个反应器内部的 3小片活性炭纤维载体(15mm×30mm×2mm),取出这些小片从而得到附着污泥生物量.颗粒污泥样品经8000r/min离心 10min去掉上清液,每个样品取0.3g的沉淀用于DNA提取.基因组DNA用核酸提取试剂盒(百泰克生物科技有限公司,中国)的方法进行提取.
16S rRNA基因 PCR扩增在 Mastercycler gradient(Eppendorf,Germany)PCR仪中进行.用于DGGE分析的引物为 A348IF(5’-GGIGCAICAGGCGCGAAA-3’, Escherichia coli positions 348-365) plus U806IR-GC(5’-CGCCCGCCGCGCCCCGCGCCCGGCCCGCCGCCCCCGCCCC GGACTACCIGGGTITCTAA-3’,E. coli positions,788-806),扩增程序均为:首先 95℃预变性 5min,接着 25个热循环(93℃解链 1min,50℃退火1min,72℃延伸 1min 30s),最后 72℃延伸 5min.PCR产物用2%琼脂糖凝胶检测[10].
1.5.2 产甲烷古菌 16S rRNA基因克隆文库和系统发育分析 构建古菌 16S rDNA 克隆文库的 PCR 引物为:A109f (5′-ACKGCTCAGTAACACGT-3′) and A 912rt (5′-GTGCTCCCCCGCCAATTCCTTTA-3′)[11]. PCR 纯化后,连接到质粒pGEM®-T Easy Vector(Promega, Chiba, Japan),方法步骤按照试剂盒的说明进行.随机挑选 200个克隆子,然后通过双酶切(Hif one 和MSP one)筛选出不同的克隆子用于测序和序列分析.质粒中插入的DNA通过引物T7/SP6进行测序,测序送测序公司(上海生工).DNA序列通过GenBank网站,用 BLAST 软件进行比对,通过 http://www.ncbi.nlm.nih.gv/BLAST/数据库进行相似性检索,进行同源性分析和相关信息检索,近缘种序列及本研究所获得序列一起载入 CLUSTAL X软件包,通过程序MEGA 4构建系统发育树,分析亲缘关系及相似性[12].
1.5.3 产甲烷古菌的定量 PCR 对于实时定量PCR分析 不同古菌特异的引物对和5’-探针的序列,MBT (Methanobacteriales; MBT857F,MBT929F, MBT1196R;扩增长度:343bp); MMB(Methanomicrobiales; MMB282F, MMB749F,MMB832R; 扩 增 长 度 : 506bp);MSC(Methanosarcinaceae; MSC380F, MSC492F,MSC828R;扩增 长 度; 408bp) 和 MST(Methanosaetaceae; MST702F, MST753F,MST862R; 扩增长度: 164bp).在 TaqMan 探针上标上 FAM(荧光基团)和 BHQ-1(猝灭基团).定量PCR(Q-PCR)反应在ABI 7500仪器(Model 7500,Applied Biosystems, USA)中进行.定量PCR反应体系使用2 × TaqMan Universal PCR Master mix来配成 20μL,反应体系如下:5μL 的去离子水,1μL的引物(最终浓度:10μmol/L), 2μL的TaqMan probe(最终浓度:1μmol/L), 10μL 的 2×reaction solution,和1μL的DNA模板.两步PCR扩增程序如下:94℃变性 10min,接着 40个热循环(94℃变性 10s,60℃退火与延伸 30s),甲烷微菌的退火温度为63℃[13].
培养5株上述的甲烷古菌用其基因组DNA制作定量 PCR的标准曲线,这些标准菌株由NITE Biological Research Center (NBRC, Chiba,Japan)提供.通过传统 PCR用以上提到的相应引物对每一株甲烷菌的目的 rRNA基因进行扩增,纯化后连入 pGEM-T载体内.对每一个质粒DNA按照10倍浓度梯度进行102~109copies/μL不同梯度稀释,用于制作定量 PCR的标准曲线.根据相应的标准曲线,计算在样品中目的种群16S rRNA基因的浓度.通过每一个用于提取微生物DNA的颗粒污泥样品的VS浓度,把基于体积的浓度(copies/μL)换算成基于颗粒生物量的浓度(copies/g granule VSS).本实验中用于定量PCR分析的所有DNA样品都做3次重复分析.
2 结果与讨论
2.1 不同温度条件下产气量的变化
由图 2可见,在 35℃中温环境下,单位有机负荷的产气量为1.97~2.84L;在低温环境4℃下,单位有机负荷产气量在 1.78~2.5L;在高温 50℃的环境下,单位有机负荷的产气量在 1.35~1.98L.中温环境 35℃产气量最高,其次是低温 4℃的环境,高温环境 50℃固定床厌氧反应器的产气量最差.说明以炭纤维为载体的固定床厌氧反应器,最适合的温度条件是中温,主要原因是中温条件下,运行反应器内产甲烷菌群微生物的数量和丰富性最好,颗粒污泥的活性高,反应器运行效率高,所以单位有机负荷内处理糖蜜废水的能力最强,单位有机负荷产气量高,与其他研究结果相一致[14]. 4,35,50℃的加热料液消耗热量分别为 1003.3,1330,1330kg/m3[15],4℃时消耗热量最少,其他研究也证实 4℃处理废水是可行的[16-17].低温厌氧消化生产沼气在能耗和经济效益方面具有一定的优越性.

图2 不同温度条件下产气量的变化Fig.2 Change of biogas production under different temperature
2.2 不同温度条件下甲烷含量变化
由图 3可见,在 35℃中温环境下,甲烷含量为63.5%~70.7%;4℃时,甲烷含量维持在70.8%~74.5%之间;在 50℃时,甲烷含量维持在 57.3%~62.5%.说明在低温环境下,虽然甲烷的产气量低,但是甲烷含量一直处于较高的含量.主要原因是低温环境,产甲烷菌的代谢途径是嗜氢甲烷菌为主的代谢途径,消耗一部分剩余的 CO2,所以甲烷含量高[18].

图3 不同温度条件下甲烷含量的变化Fig.3 Change of methane content under different temperature
2.3 不同温度条件下挥发性脂肪酸(VFA)的变化
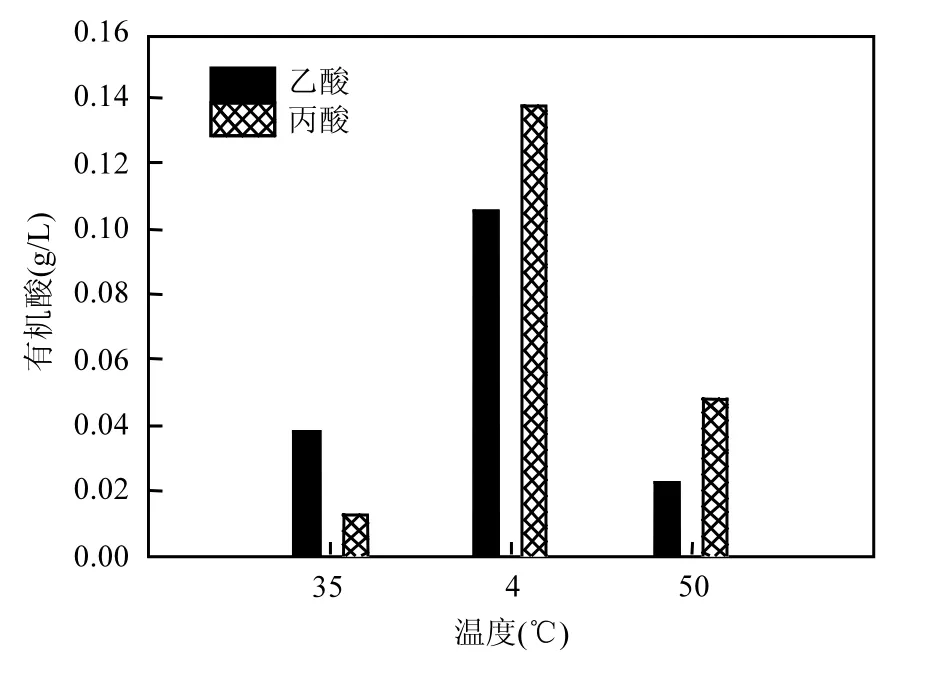
图4 不同温度条件下有机酸含量的变化Fig.4 Change of VFA content under different temperature
由图4可见,50℃的高温环境中,乙酸、丙酸的含量分别为 0.022,0.048g/L;35℃的中温环境,乙酸、丙酸的含量分别为0.038g/L; 4℃的低温环境,乙酸、丙酸的含量分别为0.12,0.14g/L.说明温度对固定床厌氧反应器的代谢有一定的影响,低温环境中,由于受到温度的冲击,使反应器内的有机酸来不及转化为CH4和CO2等无机物,而产生乙酸和丙酸累积现象[19].热力学分析表明,在低温环境中降解丙酸的能量效率低,所以低温环境中有利于嗜氢产甲烷菌生长[18];在高温和中温环境中,主要是嗜乙酸产甲烷菌代谢为主,所以没有产生VFA累积的现象[20].
2.4 不同温度条件下古菌克隆文库分析
由图5可见,在沉积污泥中,原始污泥检测到8个不同的克隆子,低温(4℃)污泥检测到5个克隆子;中温(35℃)污泥检测到 4个克隆子,高温(50℃)污泥检测到 9个克隆子;在炭纤维载体污泥中,低温(4℃)中检测到7个克隆子,中温(35℃)中检测到 7个克隆子,高温(50℃)中检测到 6个克隆子.在原始污泥中只有2个甲烷鬃毛菌科和泉古菌门,其中甲烷鬃毛菌是优势菌株;不同温度下沉积污泥中检测到的克隆子分别代表甲烷八叠球菌目、甲烷微菌目、泉古菌门,其中甲烷鬃毛菌是优势菌株;不同温度下炭纤维载体污泥中,分别代表甲烷八叠球菌目、甲烷微菌目、甲烷球菌目,其中甲烷鬃毛菌和甲烷微菌是优势菌株,产甲烷微菌在 3个温度中均存在,尤其低温(4℃)炭纤维载体上占绝对的优势.说明在不同温度微生物群落的优势菌株有一定的变化[21],主要原因是不同温度环境下反应器内优势菌的代谢途径有关.
由系统发育树可知,在高温(50℃)和中温(35℃)的环境中,甲烷鬃毛菌和甲烷八叠球菌是优势菌,原因是在高温环境中嗜乙酸产甲烷菌为主要代谢途径,乙酸氧化成氢和二氧化碳,为嗜氢甲烷菌提高了大量的氢[22-23],产生的分子态氢受到氢分压的调控,对 VFA 的利用非常重要.前人研究已经证实,在产甲烷菌的微生物群落生态系统多样性中,乙酸的浓度与嗜乙酸甲烷菌有直接的关系[5].此结果也解释了50℃时,乙酸浓度低的原因.其次,甲烷八叠球菌在 50℃高温的沉积污泥中是优势菌,甲烷八叠球菌是优势种群时的颗粒污泥很小,污泥容易从反应器中冲出,而颗粒污泥结构影响反应器的运行效率,所以在高温50℃时的产量比中温35℃低.
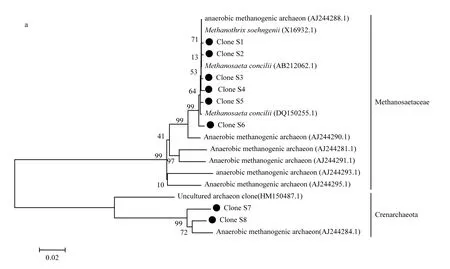
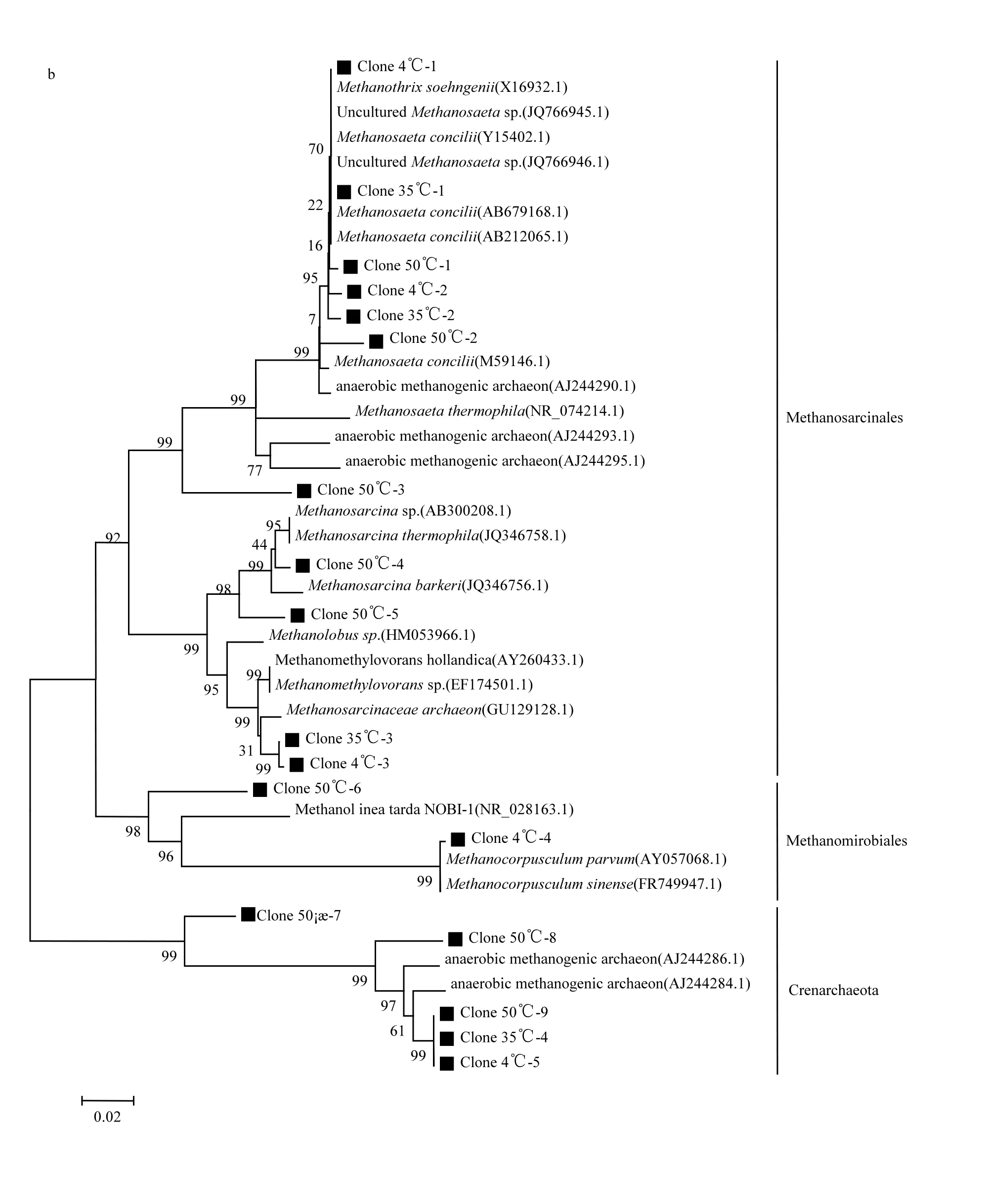
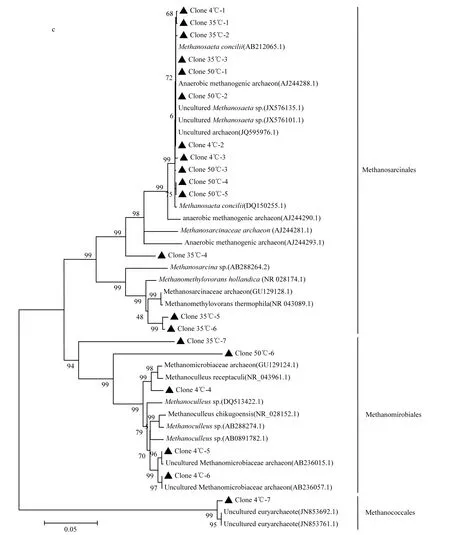
图5 不同温度条件下(50℃、35℃、4℃)炭纤维载体污泥和沉积污泥克隆系统发育分析Fig.5 Phylogenetic tree analysis of carbon fiber carrier sludge and depostion sludge under different temperature(50℃、35℃、4℃)
低温(4℃)的炭纤维载体上的产甲烷微菌是3个温度的优势种群,例如克隆子 4℃-4(Methanoculleus sp., 98%)从胜利油田中分离的嗜氢产甲烷菌;4℃-5(Uncultured Methanomicrobiaceae archaeon gene, 99%)和 4℃-6 (Uncultured Methanomicrobiaceae archaeon gene, 99%)是以丙酸为底物,低H2分压的条件下分离培养的产甲烷微菌[24].已有研究证实固定床厌氧反应器在低温环境中运行时,附着在炭纤维载体上的优势菌是产甲烷微菌[7,18].因为炭纤维为产甲烷微菌的生长提供了附着的载体,所以低温下厌氧反应器中的颗粒污泥中产甲烷微菌是优势菌,同时证实产甲烷微菌主要是以嗜氢产甲烷菌的代谢途径为主[18,25-26].基于热力学原因分析有五种不同的机理[27],最主要是低温环境中嗜氢产甲烷菌的代谢途径需要氢的浓度低,在系统中保持较低的氢分压,有利于嗜氢产甲烷菌生长[24,28],所以低温时的甲烷含量高于中温和高温.甲烷鬃毛菌在低温 4℃时炭纤维载体污泥中微生物多样性比较丰富,研究表明甲烷鬃毛菌为炭纤维载体上的颗粒污泥的形成有很大的贡献,为固定床厌氧反应器在低温或其它环境冲击下稳定运行提供了良好的微生物生态系统.分析表明,不同环境条件下固定床厌氧反应器内部微生物群落的丰富性存在很大的差异.
2.5 不同温度条件下产甲烷菌定量分析
由图6可见,在原始污泥中,甲烷鬃毛菌是优势产甲烷菌,其中 16S rRNA 基因浓度占测定16S rRNA 基因组总浓度的52.96%.与在厌氧环境的颗粒污泥中含有大量的产甲烷鬃毛菌的报道相符合[18,26,29].同时也与克隆文库系统发育树分析的结果相一致.
高温 50℃运行的反应器,沉积污泥中产甲烷杆菌是优势菌,16S rRNA基因浓度占测定16S rRNA 基因组总浓度的61.90%;炭纤维载体污泥中产甲烷鬃毛菌是优势菌,其16S rRNA 基因浓度占测定16S rRNA 基因组总浓度的55.09%;中温35℃运行的反应器中,沉积污泥和炭纤维载体污泥中产甲烷鬃毛菌均是优势菌,16S rRNA 基因浓度占测定 16S rRNA 基因组总浓度分别是78.07%和 56.03%;低温 4℃运行的反应器,沉积污泥和炭纤维载体污泥中的优势菌都是甲烷微菌,16S rRNA 基因浓度分别占测定 16S rRNA基因组总浓度的74.15%和80.85%.
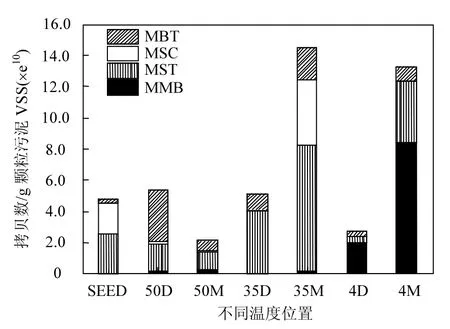
图6 不同温度条件下产甲古菌定量分析Fig.6 Quantitative analysis of the methanogenic group under different temperature
林长松等[30]的研究指出在中温 35℃的条件下固定床厌氧反应器的产气量、COD去除率、累积产气量明显与普通的UASB反应器.在低温4.8℃温度条件下普通UASB厌氧反应器的产量是 0.11gCOD/(L⋅d)[17],而本研究 4℃环境中固定床厌氧反应器的产气量是 0.35gCOD/(L⋅d),原因是 35℃和 4℃附着在炭纤维载体污泥中的 16S rRNA基因组总浓度分别比沉积污泥中 16S rRNA 基因组总浓度增加 64.58%和 79.60%;而50℃附着在炭纤维载体上污泥中 16S rRNA 基因组总浓度分别比沉积污泥中 16S rRNA 基因组总浓度减少了60.32%.说明炭纤维载体为固定床的厌氧反应器在中温和低温环境中起到了附着颗粒污泥、固定微生物的作用,使反应器内污泥具有较高的活性.另外,中温和低温环境中容易附着在炭纤维载体上的产甲烷微菌逐渐增加[7],尤其是低温环境中产甲烷微菌 16S rRNA 基因浓度增加的数量较大,而产甲烷微菌主要代谢途径是利用嗜氢甲烷菌代谢,有利于嗜氢甲烷菌(甲烷微菌)生长,所以低温环境固定床厌氧反应器产气量增加较大,至于甲烷微菌喜欢附着在炭纤维载体上的原因有待于进一步分析.
高温环境中沉积污泥中产甲烷杆菌是优势菌群,与前人的报道在55℃的高温厌氧反应器中产甲烷杆菌是优势菌群的结果相一致,同时也指出高温厌氧反应器的产甲烷菌活性远远低于中温厌氧反应器和低温厌氧反应器[31].所以固定床厌氧反应器更适合中温和低温环境运行,产气量的结果也可以证实这一点.
3 结论
3.1 不同温度条件下,中温 35℃单位产气量最高,最高值达到 2.84L;低温环境 4℃,产甲烷含量最高,其值达到74.5%;低温环境容易引起VFA的累积导致反应器酸败.
3.2 不同温度条件下古菌克隆和定量分析表明,产甲烷鬃毛菌是中温和高温反应器内的优势菌,高温50℃附着在炭纤维载体上的16S rRNA基因浓度占测定 16S rRNA基因组总浓度的55.09%,中温35℃16S rRNA基因浓度占测定16S rRNA基因组总浓度的 56.03%;低温 4℃炭纤维载体污泥中的优势菌都是产甲烷微菌16S rRNA基因浓度分别占测定16S rRNA基因组总浓度的80.85%.
3.3 从能源和经济效益角度分析低温条件更适合沼气发酵,而且以嗜氢产甲烷菌代谢途径为主.
[1]El-Mashad H M, Zeeman G, van Loon W K, et al. Effect of temperature and temperature fluctuation on thermophilic anaerobic digestion of cattle manure [J]. Bioresource Technology,2004,95:191-201.
[2]Akuzawa M, Hori T, Haruta S, et al. Distinctive responses of metabolically active microbiota to acidification in a thermophilic anaerobic digester [J]. Microbial Ecology, 2011,61:595-605.
[3]Lettinga G, Rebac S, Zeeman G. Challenge of psychrophilic anaerobic wastewater treatment, TRENDS in Biotechnology [J].2001,19:363-370.
[4]卞 伟,赵昕燕,侯爱月,等.季节性温度对短程硝化系统微生物群落的影响 [J]. 中国环境科学, 2017,37(4):1366-1374.
[5]Hori T, Haruta S, Ueno Y, et al. Dynamic transition of a methanogenic population in response to the concentration of volatile fatty acids in a thermophilic anaerobic digester [J]. Appl.Environ. Microbiol., 2006,72:1623-1630.
[6]O'Reilly J, Lee C, Collins G, et al. Quantitative and qualitative analysis of methanogenic communities in mesophilically and psychrophilically cultivated anaerobic granular biofilims [J].Water Res., 2009,43:3365-3374.
[7]Zhang D, Li J, Guo P, et al. Dynamic transition of microbial communities in response to acidification in fixed-bed anaerobic baffled reactors (FABR) of two different flow directions [J].Bioresource Technology, 2011,102:4703-4711.
[8]Bialek K, Kim J, Lee C, et al. Quantitative and qualitative analyses of methanogenic community development in high-rate anaerobic bioreactors [J]. Water Research, 2011,45:1298-1308.
[9]贺延龄.废水的厌氧生物处理 [M]. 北京:中国轻工业出版社,1998.
[10]Wang X, Haruta S, Wang P, et al. Diversity of a stable enrichment culture which is useful for silage inoculant and its succession in alfalfa silage [J]. FEMS Microbiology Ecology, 2006,57:106-115.
[11]Lueders T, Friedrich M W. Effects of Amendment with Ferrihydrite and Gypsum on the Structure and Activity of Methanogenic Populations in Rice Field Soil [J]. Applied and Environmental Microbiology, 2002,68:2484-2494.
[12]Gao L J, Yang H Y, Wang X F, et al. Rice straw fermentation using lactic acid bacteria [J]. Bioresource Technology, 2008,99:2742-2748.
[13]Yu Y, Lee C, Kim J, et al. Group-specific primer and probe sets to detect methanogenic communities using quantitative real-time polymerase chain reaction [J]. Biotechnol. Bioeng., 2005,89:670-679.
[14]Enright A M, Collins G, O'Flaherty V. Temporal microbial diversity changes in solvent-degrading anaerobic granular sludge from low-temperature (15degrees C) wastewater treatment bioreactors [J]. Syst. Appl. Microbiol., 2007,30:471-482.
[15]陈泽兴,刘建禹,李文涛.寒区沼气发酵地源热泵增温系统的初步研究 [J]. 农机化研究, 2011,(3):219-222.
[16]McKeown R M, Scully C, Mahony T, et al. Long-term(1,243days), low-temperature (4-15degrees C), anaerobic biotreatment of acidified wastewaters: bioprocess performance and physiological characteristics [J]. Water Res., 2009,43:1611-1620.
[17]Kalyuzhnyl S V, Skylar M A, Kizimenko V I, et al. One- and Two-Stage Upflow Anaerobic Sludge-Bed Reactor Pretreatment of Winery Wastewater at 4—10°C [J]. Appl. Biochem. Biotechnol.,2001,90:107-124.
[18]Zhang D D, Zhu W B, Tang C,et al. Bioreactor performance and methanogenic population dynamics in a low-temperature(5-18degrees C) anaerobic fixed-bed reactor [J]. Bioresource Technology, 2012,104:136-143.
[19]Dhaked R K, Singh P, Singh L. Biomethanation under psychrophilic conditions [J]. Waste Management, 2010,30:2490-2496.
[20]Xia Y, Wang Y, Fang H H, et al. Thermophilic microbial cellulose decomposition and methanogenesis pathways recharacterized by metatranscriptomic and metagenomic analysis [J]. Sci. Rep.,2014,(4):6708.
[21]张立国,班巧英,李建政.UASB反应器中产甲烷菌对温度胁迫的响应 [J]. 中国环境科学, 2016,36(4):1082-1086.
[22]Ahring B K. Methanogenesis in thermophilic biogas reactors [J].Antonie van Leeuwenhoek, 1995,67:91-102.
[23]Petersen S P, Ahring B K. Acetate oxidation in a thermophilic anaerobic sewage-sludge digestor: the importance of nonaceticlastic methanogenesis from acetate [J]. FEMS Microbiology Letters, 1991,86:149-152.
[24]Sakai S, Imachi H, Sekiguchi Y,et al. Cultivation of methanogens under low-hydrogen conditions by using the coculture method [J].Applied and Environmental Microbiology, 2009,75:4892-4896.
[25]McKeown R M, Hughes D, Collins G, et al. Low-temperature anaerobic digestion for wastewater treatment [J]. Current Opinion in Biotechnology, 2012,23:444-451.
[26]O'Reilly J, Lee C, Chinalia F, et al. Microbial community dynamics associated with biomass granulation in lowtemperature (15degrees C) anaerobic wastewater treatment bioreactors [J]. Bioresour. Technol., 2010,101:6336-6344.
[27]Dolfing J, Larter S R, Head I M. Thermodynamic constraints on methanogenic crude oil biodegradation [J]. The ISME Journal,2007,2:442-452.
[28]Conrad R, Wetter B. Influence of temperature on energetics of hydrogen metabolism in homoacetogenic, methanogenic, and other anaerobic bacteria [J]. Archives of Microbiology, 1990,155:94-98.
[29]McHugh S, Collins G, Flaherty V O. Long-term, high-rate anaerobic biological treatment of whey wastewaters at psychrophilic temperatures [J]. Bioresour. Technol., 2006,97:1669-1678.
[30]林长松,袁旭峰,崔宗均,等.2种不同性能炭纤维载体的固定床厌氧反应器运行效果比较 [J]. 环境工程学报, 2014,(1):203-209.
[31]McHugh S, Carton M, Mahony T, et al. Methanogenic population structure in a variety of anaerobic bioreactors [J]. FEMS Microbiology Letters, 2003,219:297-304.

