酰化高丝氨酸内酯对巨噬细胞模型影响初探
, ,,,,
(扬州大学食品科学与工程学院,江苏扬州 225127)
我国是世界上淡水养殖业最为发达的国家,淡水养殖鱼类产量已达2715多万吨,连续20多年位居世界第一。然而,我国淡水鱼加工比例较低,淡水鱼捕获后极易腐败变质,这造成了巨大的经济损失。细菌增殖是导致鱼类腐败变质的主要原因,其本质是鱼体内的蛋白质、碳水化合物及脂肪等营养成分被细菌分泌的降解酶分解,产生胺和硫化物等腐败产物[[1-3]。群体感应(Quorum Sensing,QS)是一种普遍存在于细菌间的细胞密度依赖型信息交流机制[4],细菌利用QS监控自身群体密度变化,在其生长过程中会分泌自诱导物作为信号分子,当其浓度达到一定阈值后即与受体蛋白结合改变其蛋白构象,进而激活某些特定基因表达机制,展现出新的生理生化特征,如形成生物被膜、产生抗生素、产生毒力因子以及合成胞外蛋白酶等[5-7]。
在淡水鱼腐败菌中,革兰氏阴性菌占有很大比重[8]。N-乙酰高丝氨酸内酯(N-acyl-homoserine-lactone,AHLs)是革兰氏阴性菌的主要信号分子[9],AHLs与淡水鱼的腐败有着密切的联系,准确检测AHLs信号分子是研究淡水鱼品质控制技术的基础。细胞是构成生物体的基本组成和功能单元[10]。细胞传感技术利用细胞高敏感性的特点,可以迅速识别外界环境的变化,具有主动、真实、准确等优势[11]。此外,根据细胞的生理变化和细胞力学的特殊性质,可将细胞用于定性或定量检测未知毒物,确定该物质的存在及含量,从而实现对危害物的检测和评价[12-16]。
本文以淡水鱼腐败菌产生的信号分子(AHLs)为研究对象,采用Ana-1与RAW 264.7两种巨噬细胞模型,通过检测细胞活力、胞内Ca2+水平变化以及流式细胞术和扫描电镜观察,筛选敏感识别特定AHLs的巨噬细胞株,为构建基于细胞传感的水产品中腐败菌检测方法提供研究基础。
1 材料与方法
1.1 材料与仪器
巨噬细胞Ana-1与RAW 264.7 购自中科院上海细胞库;AHLs:C4-HSL、C6-HSL、C8-HSL、C10-HSL和3OC12-HSL Sigma公司;Gbico胎牛血清、DMEM培养液 森贝伽生物科技有限公司;DMSO、0.1 mol/L PBS、青霉素-链霉素、胰酶消化液、Fluo-4 AM(5 mmol/L钙离子荧光探针)、CCK-8试剂盒、Annexin V-FITC细胞凋亡检测试剂盒 碧云天生物技术有限公司。
SW-CJ-1F型单人双面净化工作台 苏州净化设备有限公司;SX-500型高压蒸汽灭菌锅 日本TOMMY公司;TG16-WS台式高速离心机 湘仪离心机仪器有限公司;CM 100透射电镜 荷兰Philips公司;FACSAria IIU流式细胞仪 美国BD公司;S-4800场发射扫描电镜 日本日立公司;二氧化碳恒温培养箱 美国Thermo Fisher公司;IX51荧光显微镜 日本Olympus公司;Infinite 200 PRO酶标仪 瑞士Tecan公司。
1.2 实验方法
1.2.1 细胞的培养与收集 在饱和湿度、5% CO2浓度的37 ℃恒温培养箱中,分别使用RPMI 1640完全培养液和DMEM完全培养液(均添加10%的胎牛血清)对ANA-1细胞和RAW264.7细胞进行培养。两种细胞的培养方法相同,每隔2 d更换一次培养液,当细胞铺满培养瓶底面积80%时,视为细胞对数生长期。此时加入0.25%胰蛋白酶消化,轻轻吹打细胞直至细胞全部悬浮,1000 r/min离心4 min,弃上清液,获得对数生长期的细胞供后续实验使用。
1.2.2 CCK-8检测细胞活力 两种对数生长期细胞,用对应的无血清培养液重悬后转移至96孔板中约5000个/孔,于37 ℃培养12 h。贴壁后分别加入终浓度为10 μmol/L的AHLs(C4-HSL、C6-HSL、C8-HSL、C10-HSL、3OC12-HSL),设置含细胞但不含AHLs的空白对照组,不含细胞与AHLs的调零组,每组三个平行,37 ℃处理2 h。处理结束后每孔加入培养液总体积10%(10 μL)的CCK-8,37 ℃孵育1 h,测定其在450 nm处吸光度。
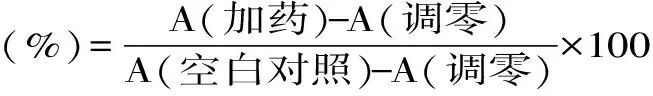
式中,A(加药):具有细胞、CCK-8溶液和AHLs孔的OD值;A(调零):具有CCK-8溶液而不含细胞与AHLs孔的OD值;A(空白对照):具有细胞、CCK-8溶液而没有AHLs孔的OD值。
1.2.3 细胞内Ca2+水平的检测 收集两种对数生长期细胞,用对应的无血清培养液重悬后转移至24孔板中,37 ℃培养12 h,使细胞贴壁。贴壁后用0.1 mol/L PBS清洗细胞3次去除培养液,每孔加入终浓度为3 μmol/L的Fluo-4 AM探针,37 ℃培养1 h进行荧光探针装载。用0.1 mol/L PBS洗涤细胞2~3次,再孵育30 min以确保Fluo-4 AM在细胞内完全转变成Fluo-4。加入终浓度为10 μmol/L的AHLs(C4-HSL、C6-HSL、C8-HSL、C10-HSL和3OC12-HSL),空白对照组不添加AHLs,每组3个平行,37 ℃处理2 h。用荧光酶标仪检测,检测激发波长为455 nm,发射波长为515 nm。
Ca2+浓度由加药组的荧光强度与空白对照组的荧光强度的比值(F/F0)表示[17]。
1.2.4 C10-HSL对Ana-1细胞凋亡的流式细胞术检测 收集Ana-1细胞,加入终浓度为10 μmol/L的C10-HSL,37 ℃培养2 h后再次离心收集,使用195 μL Annexin V-FITC结合液重悬细胞,依次加入5 μL Annexin V-FITC、10 μL碘化丙啶染色液并混匀,室温避光孵育15 min,进行流式细胞仪检测。根据双变量流式散点图仪器直接计算并读出百分比数据结果。
1.2.5 电镜观察C10-HSL对Ana-1细胞凋亡的影响
1.2.5.1 透射电镜 Ana-1细胞经终浓度为10 μmol/L的C10-HSL处理2 h后,收集细胞,琼脂包裹后切成边长3 mm小方块,2.5%戊二醛固定4 h以上。0.1 mol/L的PBS清洗3次,每次15 min。1%锇酸固定2 h。0.1 mol/L的 PBS清洗3~4次,每次15 min。依次经50%、70%、80%、90%、95%、100%的乙醇和100%丙酮、100%丙酮(加无水硫酸钠)梯度脱水,每次15 min。按丙酮∶树脂=1∶1 浸透1 h,丙酮∶树脂=1∶2 浸透2 h,纯树脂 2 h浸透。包埋、聚合(37 ℃烘箱12 h,60 ℃烘箱48 h)。超薄切片,醋酸双氧铀、枸橼酸铅双重染色10 min。利用透射电镜观察细胞内部结构。
1.2.5.2 扫描电镜 Ana-1细胞经终浓度为10 μmol/L的C10-HSL处理2 h后,收集细胞,琼脂包裹切片加入2.5%的戊二醛中固定4 h,保存于4 ℃冰箱中。然后用0.1 mol/L的PBS清洗3次,每次15 min。按照50%、70%、80%、90%、95%、100%的乙醇梯度脱水,每次15 min,然后用含无水硫酸钠的100%乙醇再脱水15 min。将样品放入CO2临界点干燥45 min,取出粘贴在样板上准备镀膜,利用场发射扫描电镜进行观察。
1.3 数据处理
2 结果与分析
2.1 AHLs对细胞活力的影响
由图1可以看出,当终浓度为10 μmol/L时,5种AHLS(C4-HSL、C6-HSL、C8-HSL、C10-HSL和3OC12-HSL)均能够显著抑制巨噬细胞Ana-1和RAW 264.7细胞的活力。其中对Ana-1细胞活力抑制作用最强的为C10-HSL,与空白对照组相比细胞活力降低了47.8%,作用效果最弱的为3OC12-HSL,细胞活力仅降低了21.3%。对RAW 264.7细胞而言,C8-HSL与3OC12-HSL的作用效果较强,与空白对照组相比细胞活力分别降低了45.4%与45.9%;而C4-HSL的效果最弱,与空白对照组相比活力降低了35.9%。
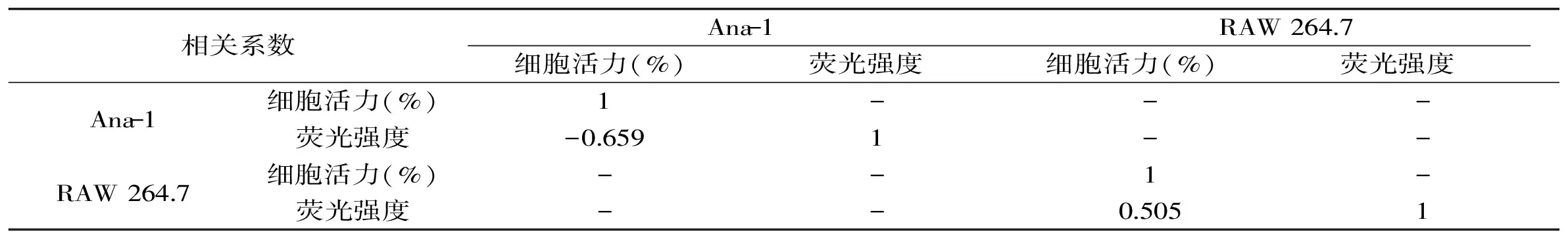
表1 细胞活力与荧光强度变化相关性分析Table 1 Correlation analysis between cell viability and Ca2+ level

图1 AHLs对于巨噬细胞Ana-1和RAW 264.7活力的影响Fig.1 Effects of AHLs on cell viability of Ana-1 and RAW 264.7 cells注:* 与空白对照组比较具有统计学差异(p<0.05),图3同。
总体看来,AHLs对RAW 264.7细胞的活力抑制效果更强,但五种AHLs之间的差别不大。而与其他四种AHLs比较,C10-HSL对Ana-1细胞的活力抑制效果更加明显。
2.2 AHLs对细胞内Ca2+水平的影响
实验所使用的Fluo-4 AM是一种可以穿透细胞膜的荧光染料,Fluo-4 AM进入细胞后被酶剪切形成Fluo-4,与钙离子结合,产生荧光[18]。
图2显示装载了Fluo-4荧光探针后,Ana-1与RAW 264.7在荧光显微镜下图像。图2A为只装载探针不加AHLs的空白对照组,荧光微弱;图2B为加入AHLs处理的Ana-1细胞,可以看到较明显的荧光;图2C为加入AHLs处理的RAW 264.7细胞,具有较强烈的荧光。结果表明经AHLs处理后,两种巨噬细胞胞内Ca2+水平升高。研究发现,这种Ca2+浓度升高来源于细胞凋亡早期的细胞外Ca2+的内流及胞内钙库(如内质网)的钙释放[19]。

图2 C10-HSL对Ana-1细胞和RAW 264.7细胞的胞内Ca2+水平影响Fig.2 Effects of C10-HSL on the Ca2+ levels in Ana-1 cells and RAW 264.7 cells注:A.对照组;B.10 μmol/L C10-HSL处理后Ana-1细胞; C.10 μmol/L C10-HSL处理后RAW 264.7细胞。
由图2的结果可以证明钙离子荧光探针的加载成功,接下来则是对荧光强度进行定量分析。由图3可知,与空白对照组比较,5种AHLs 均能使Ana-1细胞内Ca2+浓度升高,其中C10-HSL的处理效果最为明显,这与细胞活力变化结果相一致。RAW 264.7细胞与空白对照组相比Ca2+浓度同样都有所升高,其中C6-HSL和C10-HSL处理后Ca2+浓度增加最多,且AHLs对RAW 264.7细胞作用效果更强。
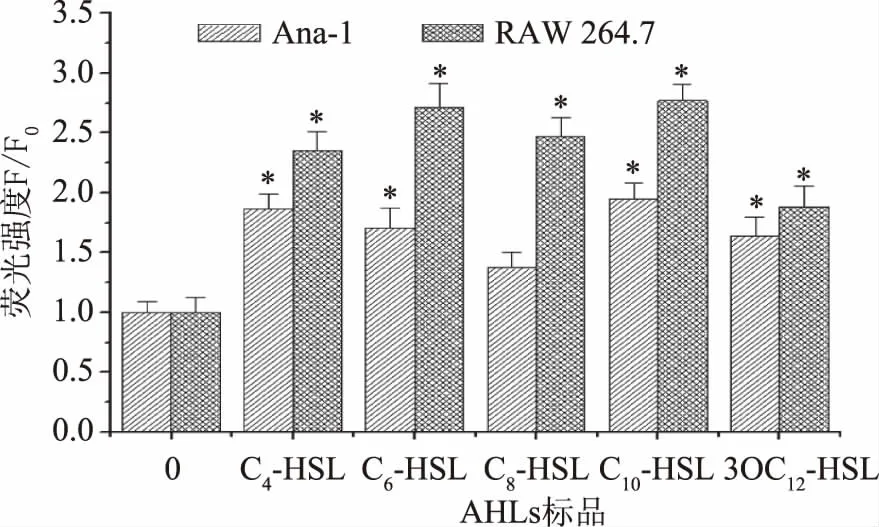
图3 AHLs对Ana-1细胞和RAW 264.7细胞胞内Ca2+水平的影响Fig.3 Effects of AHLs on the intracellular Ca2+ levels of Ana-1 cells and RAW 264.7 cells
2.3 细胞活力与Ca2+水平变化相关性分析
汇总数据如表1所示,并利用SPSS对两种细胞的细胞活力和Ca2+水平的变化进行相关系数分析。
SPSS相关系数分析结果显示,RAW 264.7细胞两指标相关系数为0.505,Ana-1细胞活力与Ca2+水平之间相关系数为-0.659。胞内钙离子作为一种重要第二信使,其胞内浓度变化与细胞凋亡密切相关[20]。研究发现,AHLs可诱导内质网钙离子释放并与其诱导凋亡直接相关[21]。相关性分析结果表明,RAW 264.7细胞两指标间无相关性,而Ana-1细胞活力与Ca2+水平存在相关性,且在体外培养过程中,相比于RAW264.7细胞,Ana-1细胞具有培养操作简单,生长迅速,不易分化等特点,因此综合上述因素选择Ana-1细胞以及对Ana-1作用最强的C10-HSL进行后续实验。
2.4 C10-HSL对Ana-1细胞凋亡的流式细胞检测
由图4可知,对照组Ana-1细胞凋亡率为9.8%,坏死率为0.5%,而经10 μmol/L C10-HSL处理2 h后,凋亡细胞数量显著升高(占19.9%),坏死细胞占2.5%,这一结果表明,C10-HSL能够诱导Ana-1细胞发生凋亡。
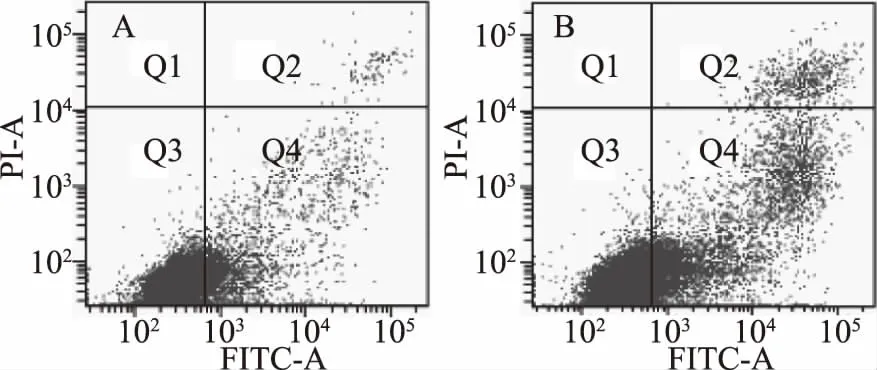
图4 流式细胞检测凋亡情况 Fig.4 Apoptosis detection by flow cytometry注:A为正常Ana-1细胞作为对照组;B为10 μmol/L C10-HSL处理后的Ana-1细胞作为实验组。图中Q2区(FITC+/PI+)是非活细胞,即坏死细胞;Q3区(FITC-/PI-)显示的是活细胞;Q4区(FITC+/PI-)显示的是凋亡细胞。
2.5 C10-HSL对Ana-1细胞凋亡的透射电镜观察
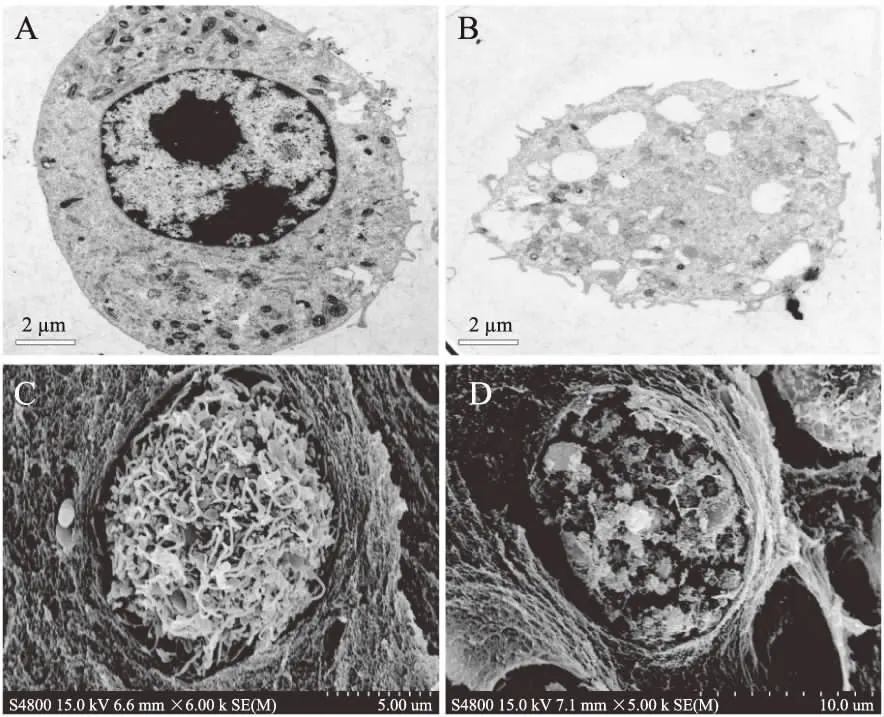
图5 C10-HSL对Ana-1细胞形态的影响 Fig.5 Effects of C10-HSL on the morphology of Ana-1 cells注:A和C分别为正常组Ana-1细胞透射电镜和扫描电镜图;B和D分别为10 μmol/L C10-HSL处理组Ana-1细胞透射电镜和扫描电镜图。
由图5A可知,放大8000倍观察下正常巨噬细胞形态饱满,表面有长短不一的隆起或微绒毛。胞质内有许多颗粒,胞核完整,核仁明显。图5B经10 μmol/L C10-HSL处理2 h后8000倍观察,Ana-1细胞形态已经破碎,细胞核消融,出现大量囊泡,内容物流出并伴随明显的脱颗粒现象,证明了细胞发生了较严重的凋亡。图5C为扫描电镜放大6000倍观察到的正常Ana-1细胞,细胞形态完好,表面有明显的绒毛隆起,未见破损。图5D为放大5000倍的10 μmol/L C10-HSL处理后Ana-1细胞,细胞膜被破坏,内部结构露出,细胞破损严重。以上观察结果,证明了C10-HSL对于小鼠巨噬细胞Ana-1有诱导凋亡以及坏死的作用,为后续利用Ana-1细胞识别C10-HSL提供了基础。
3 结论
结果表明,终浓度为10 μmol/L的C4-HSL、C6-HSL、C8-HSL、C10-HSL和3OC12-HSL均能够显著抑制巨噬细胞Ana-1和RAW 264.7细胞活力并提高胞内Ca2+浓度。其中Ana-1细胞活力与Ca2+水平变化存在一定相关性,且对C10-HSL有较为灵敏反应,并且考虑到体外培养的操作便捷性和细胞株本身的稳定可靠性,因此选择Ana-1与C10-HSL进行流式细胞检测以及电镜观察,证明了C10-HSL能诱导Ana-1细胞凋亡以及坏死的作用(总凋亡率为22.4%),为后续构建基于Ana-1细胞的荧光传感器定量检测C10-HSL提供理论研究基础,解决目前只能定性分析的缺陷。本实验所研究的结果可以为预防和控制淡水鱼腐败菌提供指导和思路。
[1]Gram L,Dalgaard P. Fish spoilage bacteria-problems and solutions[J]. Current Opinion in Biotechnology,2002,13(3):262-266.
[2]Broekaert K,Heyndrickx M,Herman L,et al. Seafood quality analysis:molecular identification of dominant microbiota after ice storage on several general growth media[J]. Food Microbiology,2011,28(6):1162-1169.
[3]赵海鹏,谢摇晶,严文蓉. 南美白对虾冷藏过程中的细菌分离初步鉴定及菌相分析[J]. 江苏农业学报,2011,27(1):164-168.
[4]马德宾,胡福泉. 细菌语言分子-N-乙酰高丝氨酸内酯[J].生命的化学,2010,30(6):893-897.
[5]Mcclean K H,Winson M L,Taylor A,et al. Quorum sensing and chromobacterium violaceum:exploitation of violacein production and inhibition for the detection of N-acylhomoserine lactones[J]. Microbiology,1997,143(12):3703-3711.
[6]Davis B M,Jensen R,Williams P,et al. The interaction of N-Acylhomoserine lactone quorum sensing signaling molecules with biological membranes:Implications for inter-kingdom signaling[J]. Plos One,2010,5(10):e13522.
[7]Crépin A,Barbey C,Beury-Cirou A,et al. Quorum sensing signaling molecules produced by reference and emerging soft-rot bacteria(DickeyaandPectobacteriumspp.)[J]. Plos One,2012,7(4):e35176.
[8]Jiang DL,Feng DD,Hui J,et al. Preliminary study on an innovative,simple mast cell-based electrochemical method for detecting foodborne pathogenic bacterial quorum signaling molecules(N-Acyl-Homoserine-Lactones)[J]. Biosensors and Bioelectronics,2017,90:436-442.
[9]Malik A K,Fekete A,Gebefuegi I,et al. Single drop microextraction of homoserine lactones based quorum sensing
signal molecules,and the separation of their enantiomers using gas chromatography mass spectrometry in the presence of biological matrices[J]. Microch imica Acta,2009,166(1-2):101-107.
[10]Kumari A,Pasini P,Deo S K,et al. Biosensing systems for the detection of bacterial quorum signaling molecules[J]. Analytical Chemistry,2006,78(22):7603.
[11]Struss A,Pasini P,Ensor C M,et al. Paper strip whole cell biosensors:a portable test for the semiquantitative detection of bacterial quorum signaling molecules[J]. Analytical Chemistry,2010,82(11):4457.
[12]Banerjee P,Franz B,Bhunia AK. Mammalian cell-based sensor system[M]. Berlin:Springer,2010:21-55.
[13]Gu W,Pei Z,Jiang D,et al. A novel and simple cell-based electrochemical impedance biosensor for evaluating the combined toxicity of DON and ZEN[J]. Biosensors & Bioelectronics,2015,70(15):447-454.
[14]Kadenbach B,Arnold S,Lee I,et al. The possible role of cytochrome coxidase in stress-induced apoptosis anddegenerative diseases[J]. Biochimica ET Biophysica Acta Bioenergetics,2004,1655(3):400-408
[15]Apati A,Janossy J,Brozik A,et al. Effects of intracellualar calcium on cell survival and the MAPK pathway in a human hormone-dependent leukemia cell line(TF-1)[J]. Annals of the New York Academy of Sciences,2003,1010(1):70-73.
[16]Walter L,Hajnoczky G. Mitochondria and endoplasmic reticulum:the lethal interorganelle cross-talk[J]. Journal of Bioenergetics and Biomembranes,2005,37(3):191-206.
[17]Ahn E Y,Lim S T,Cook W J,et al. Calmodulin binding to the fas death domain:Regulation by fas activation[J]. Journal of Biological Chemistry,2004,79(7):5661-5666.
[18]Rust C,Bauchmuller K,Bernt C,et al. Sulfasalazine reduces bile acid induced apoptosis in human hepatoma cells and perfused rat livers[J]. Gut,2006,55(5):719.
[19]Liu C,Zhang M,Hu M Y,et al. Increased glucagon-like peptide-1 secretion may be involved in antidiabetic effects of ginsenosides[J]. Journal of Endocrinology,2013,217(2):185-196.
[20]Li H,Wang L,Ye L,et al. Influence of Pseudomonas aeruginosa quorum sensing signal molecule N-(3-oxododecanoyl)homoserine lactone on mast cells[J]. Medical Microbiology & Immunology,2009,198(2):113-121.
[21]Qu M,Boruah B M,Zhang W,et al. A rat basophilic leukaemia cell sensor for the detection of pathogenic viruses[J]. Biosensors and Bioelectronics,2013,43(1):412.

