糖尿病视网膜病变患者血清糖化白蛋白水平诊断价值分析
朱 辉,陆 胜⋆
(无锡市锡山人民医院检验科,江苏 无锡 214011)
糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病微血管并发症之一。随着糖尿病发病率的上升,DR的发生率亦呈上升的趋势。血清糖化白蛋白(glycated albumin,GA)是葡萄糖通过非酶促糖基化反应与血浆中白蛋白结合形成[1]。许多研究认为,GA可通过诸多途径导致糖尿病并发症的发生与发展[2-3]。本研究分析了122例2型糖尿病(type 2 diabetes mellitus,DM)患者的血清GA水平,初步探讨其在DR诊断中的价值。
1 资料与方法
1.1 一般资料
选取我院2015年6月至2017年3月内分泌科或眼科住院的2型糖尿病患者122例。所有2型DM患者的诊断均符合WHO标准[4];同时,DR的诊断参照1984年全国眼底病协作组制定的诊断标准[5],由高年资眼科医师行直接眼底镜或眼底荧光血管造影,将122例2型DM患者分成糖尿病无视网膜病变(NDR)组55例,其中男30例,女25例,平均年龄(65.26±3.89)岁;非增生性糖尿病视网膜病变(NPDR)组43例,其中男22例,女21例,平均年龄(69.33±4.02)岁;增生性糖尿病视网膜病变(PDR)组24例,其中男14例,女10例,平均年龄(73.48±3.25)岁;正常对照组为同期来我院体检者98例,其中男性58例,女性40例,平均年龄(68.58±5.21)岁。经检者均无肝、肾、脑、血液及内分泌系统等各种病患。
1.2 方法
所有患者及对照组均空腹采集静脉血标本。空腹血糖(fasting plasma glucose,FPG)检测采用己糖激酶(HK)法,试剂为罗氏公司原装产品;GA检测采用液态酶法,试剂为日本旭化成制药株式会社生产,两者均在罗氏Cobas C 701全自动生化分析仪上检测;糖化血红蛋白(HbA1c)在伯乐D-10糖化血红蛋白分析仪上采用高效液相色谱法检测,试剂为伯乐公司配套产品。
1.3 统计学方法
2 结 果
2.1 2型DM组、NDR组、NPDR组、PDR组及正常对照组间检测指标比较
2型DM组FPG、GA及HbA1c水平均高于正常对照组(P<0.05);DM三组之间两两比较,各指标间均有显著差异(P<0.05);且随着DR病情加重,各指标水平呈增高的趋势。见表1。
2.2 GA及HbA1c诊断效能比较
ROC曲线显示GA诊断视网膜病变的曲线下面积(Auc)为0.868,敏感性为83.60%,特异性为74.41%,95%可信区间0.816~0.909,阳性预测值76.90%,阴性预测值75.85%,诊断截点为18.66%;HbA1c诊断DR的Auc为0.786,敏感性77.94%,特异性71.23%,95%可信区间0.737~0.847,阳性预测值74.34%,阴性预测值72.23%,诊断截点为6.69%。经Z检验,GA的诊断效能高于HbA1c,差异有统计学意义(P<0.05),见表2及图1。
表1 患者组及对照组各项检测指标比较(±s)

表1 患者组及对照组各项检测指标比较(±s)
组别 例数 FPG(mmol/L) GA(%) HbA1c(%)正常对照组 98 5.94±0.65 14.01±1.99 5.93±0.24 DM组 122 7.38±1.28 18.13±3.87 6.45±0.59 NDR组 55 6.40±0.53 15.55±1.38 6.37±0.52 NPDR组 43 7.92±0.89 19.26±1.62 6.75±0.56 PDR组 24 8.66±1.25 24.88±2.29 7.33±0.60

表2 GA及HbA1c对DR的诊断效能比较
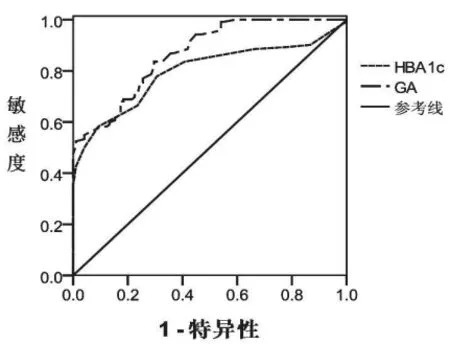
图1 GA、HbA1c诊断DR的ROC曲线
3 讨 论
糖尿病视网膜病变是2型DM主要的微血管病变之一。许多研究[2,3,6]认为,DR的发生、发展与长期血糖控制不良引起的高血糖状态密切相关。其主要机理可能是长期高血糖引起的“糖毒性效应”导致胰岛β细胞的凋亡,使残留的胰岛β细胞功能不断减退;另外,晚期糖基化终末产物(AGEs)的产生与积聚导致微血管发生改变,毛细血管内皮细胞发生增殖,网膜组织缺氧释放出血管增殖物质,形成新生血管而发生增殖性病变。
糖化血红蛋白(HbA1c)是葡萄糖与血液中血红蛋白由不可逆的非酶促反应形成,能反映8~12周患者的平均血糖水平,且不受饮食、抽血时间等影响。目前,HbA1c是评估长期血糖控制的金标准。2010年美国糖尿病协会(ADA)将HbA1c作为糖尿病的诊断标准。本文的研究也证实了HbA1c与DR有较好的相关性和诊断效能。
糖化白蛋白是血清白蛋白与葡萄糖发生非酶促糖基化反应而形成的糖基化产物,能反映2~3周的平均血糖水平[7]。同HbA1c相比,GA在反映近期血糖水平的控制上更为敏感。同时,GA同样不受饮食、抽血时间的影响,在反映血糖的控制上,能充分反映近期的血糖水平。本文的检测数据显示,GA诊断DR的ROC面积为0.868,大于HbA1c的0.786,两者有显著差异(P<0.05),说明在DR的诊断上,GA的效能更为高效。同时在敏感性、特异性、阳性预测值及阴性预测值上,GA均高于HbA1c,但无统计学差异,可能同样本量有一定的关系。同时本研究分析得到的GA诊断截点为18.66%,HbA1c的诊断截点为6.69%,与沙敏等[3]的研究结果GA为24%,HbA1c为9.35%差异较大,可能与病例的选择及检测方法有关。分析原因,许多证据证明GA不仅仅局限于一个血糖监测指标,亦或是AGEs的前体,其本身可能作为一种致病蛋白参与了DR的发生发展,导致细胞损伤,是糖尿病DR发病机制之一[8]。而HbA1c检测的影响因素较多,如HbA1c的测定会受血红蛋白和一些短寿命红细胞的疾病的影响,例如肾性贫血、溶血性贫血等[9]。在这种情况下,HbA1c的检测就会受到一定的限制。
综上所述,在DR的诊断上,GA较HbA1c有更高的效能。但两者均随DR病变程度加重呈增高趋势,故一定程度能反映DR的病情严重程度。本研究的样本数量有限,同时GA检测的标准化还存在一定的问题,故数据结论有一定的局限性。GA在DR诊断中的应用,还需进一步深入探讨。
[1]赵芳,张芳,邱玲,等.酶法测定糖化白蛋白的方法性能验证及其初步临床应用[J].中华检验医学杂志,2013,36(4):343-347.
[2]Pan J,Li Q, Zhang L, et al. Serum glycated albumin predicts the progression of diabetic retinopathy-a fi ve year retrospective longitudinal study[J]. J Diabetes complicatio ns,2014,28(6):772-778.
[3]沙敏,石冬敏,王亚南,等.血清糖化白蛋白水平升高对糖尿病视网膜病变的诊断价值[J].微循环学杂志,2014,24(4):64-66.
[4]徐向进,潘长玉,田慧,等.WHO及美国糖尿病学会糖尿病诊断标准在老年人群中应用的分析和评估[J].中华内分泌代谢杂志,2002,18(5):357-361.
[5]全国眼底病协作组.糖尿病视网膜病变分期标准[J].中华眼科杂志,1985,21(2):113.
[6]曹辉彩,王雅宁,张志强,等.缺血修饰白蛋白、糖化白蛋白和糖化血红蛋白与2型糖尿病合并视网膜病变的相关性研究[J].中国医药导报,2017,14(15):72-75.
[7]董亚君,苏志强.糖化白蛋白的临床意义[J].医学综述,2016,22(19):3767-3770.
[8]Moritas, Kasayama S, Deguchi R, et al. Glycated albumin,rather than HbA1c, re fl ects diabetic retinopathy. in pationts with type 2 diabetes mellitus. Journal of Diabetes& Metabolism [J].2013,37:592-597.
[9]中华医学会糖尿病学分会.中国血糖监测临床应用指南(2011年版)[J].中华糖尿病杂志,2011,03(1):13-21.

