贻贝粘蛋白降解的关键酶
吴珂,康瑞娟,何利中
(江阴贝瑞森生化技术有限公司,江苏 江阴 214434)
0 引言
随着生物技术的进步和组织工程学的发展,越来越多的生物材料被用于医疗领域。这些生物源性材料包括蛋白质(胶原蛋白、贻贝粘蛋白)、多糖类(透明质酸、壳聚糖)以及这些生物大分子与传统材料复合行程单新材料。这些新材料的应用引发了对其安全性的担忧,迫切需要制定针对这些材料和相关产品的质量控制标准。2016年,国家重点研发计划设立了“新一代生物材料质量评价关键技术研究”项目,其中针对贻贝粘蛋白标准研究设立了专题,着重研究贻贝粘蛋白材料和产品的降解性能和免疫原性。
生物材料有别于传统无机或合成材料的特性之一在于其可降解性。生物源性材料降解后产生的氨基酸、多肽、寡糖、单糖等产物,大部分都是人体内原来就存在的物质,因此,很难通过体内研究定量追踪,需要模拟体内环境建立体外模型,获得体外研究的数据。
基于构建体外降解模型的需求,本文针对人体的蛋白质水解环境进行了文献调研,并对其中的关键酶的作用进行了综述。
1 贻贝粘蛋白
贻贝粘蛋白(mussel adhesive protein,MAP)是一种多酚类单一蛋白生物材料。贻贝粘蛋白提取自紫贻贝(blue mussel, Mytilus edulis)的足丝腺,贻贝粘蛋白与高等植物细胞壁中的伸展蛋白(在糖链间起连接作用)很相似,是属于糖蛋白类型的一种粘液蛋白,具有超强的黏着性能。贻贝粘蛋白分子由 70-90个重复的多肽片段组成, 每个肽段由 10 个氨基酸组成,其中 2 个是赖氨酸。这使得蛋白具有较高的等电点,在人体生理 pH 值下带有很强的正电荷。每个贻贝粘蛋白分子带 150 以上正电荷。另外,贻贝粘蛋白肽链片段中有 10% 的 DOPA 基团 (3,4- 二羟基苯丙氨酸)。在 pH 值 5 及以下, 蛋白溶液可以稳定存。但在pH 值较高的情况下,DOPA 中的一些酚羟基氧化成醌,这一过程在儿茶酚氧化酶存在下会被加速。氧化的 DOPA 和未氧化的 DOPA 交联,形成高分子网状聚合物[1-3]。
由于赖氨酸及多巴基团的存在,贻贝粘蛋白可通过静电相互作用吸引带负电荷的表皮细胞、成纤维细胞、血管内皮细胞、神经细胞等的贴壁和爬行替代,形成创面保护膜和带有正电荷的网状支架用于促进创面的愈合。也可作为组织粘合剂用于闭合皮肤组织、闭合黏膜组织、闭合骨组织,以及血管、神经、肌肉、软组织等的治疗。贻贝粘蛋白创面修复敷料是目前已知的唯一含有多巴集团的天然蛋白产品,具有抗炎、促进创面愈合、止痒、抑制黑色素;可用于外科、妇产科、烧伤科、整形科、皮肤科、激光美容等多个科室使用。适用于浅表性创面的防护,临床浅II度烧伤创面的防护和治疗。在体液渗出情况下,贻贝粘蛋白创面修复敷料可以牢固结合于创面,形成微观、非连续、纳米级、带有正电荷的生物支架,通过静电相互作用吸引带负电荷的表皮细胞、成纤维细胞、血管内皮细胞、神经细胞等的贴壁和爬行替代,促进创面的愈合,且不影响体液的渗出和水蒸气、氧气、二氧化碳等的通透。
当贻贝粘蛋白材料所形成的医疗器械产品与体液和组织接触后,尤其是长期接触的情况下,存在着被降解的风险。因此,贻贝粘蛋白在体内的稳定性以及可能的降解产物及其去向成为其安全性评价的关键。人体不同器官组织的酶环境差异巨大,贻贝粘蛋白在降解的不同阶段,其物质种类、分子量、形态、厚度、通透性、免疫原性、细胞毒性、皮内刺激等存在显著差异。因此,对于贻贝粘蛋白降解的研究宜采用体内体外研究相结合的方式进行。首先构建体外模型,通过体外试验(例如组织、匀浆、细胞或酶复合液)研究确证有降解产物,然后再利用动物试验进行毒代动力学研究,描述外来化合物随着时间的变化在体内吸收、分布、代谢和排泄的情况。因此,了解体内蛋白质水解环境,明确参与外源蛋白水解的酶的种类,就成为构建体外降解模型的先决条件。
2 蛋白酶概述
蛋白酶是水解蛋白质肽链的一类酶的总称,蛋白质(大分子)在蛋白酶的作用下分解成氨基酸、多肽等小物质。蛋白酶广泛存在于动物内脏、植物茎叶、果实和微生物中。生物体的生理活动和疾病的发生,如食物之消化吸收、血液之凝固、溶血作用、炎症、血压调节、细胞分化自溶、机体衰老、癌症转移、生理活性肽的活化等,莫不与蛋白酶有关。
作为一种重要的生物活性物质,蛋白酶有多种分类方法:按其水解多肽的方式,可以将其分为内肽酶和外肽酶;以最适pH的方式,分为中性蛋白酶、酸性蛋白酶、碱性蛋白酶;按来源可分为动物蛋白酶、植物蛋白酶、微生物蛋白酶;以活性中心来划分,可分为半胱氨酸蛋白酶、金属蛋白酶、丝氨酸蛋白酶、天门冬氨酸蛋白酶四大类[4]。学术上通常以活性中心来划分蛋白酶。见图1。

图1 蛋白酶分类图[5]
3 皮肤中的蛋白酶
到目前为止,贻贝粘蛋白产品主要应用于皮肤创伤和疾病的治疗,因此,我们的调研重点也就集中于皮肤中蛋白酶的种类和作用。研究表明,在人体皮肤的表皮层中存在着一个完整的蛋白水解网络,由超过30种酶组成,执行着越来越多的基本功能[5]。这些蛋白酶及其抑制剂分布于表皮各处,它们之间的精妙平衡维持着皮肤的正常功能,酶与抑制剂之间的调控失衡是导致皮肤各种病理状况的主要原因。
皮肤的表皮层又可以分为角质层(stratum corneum)、颗粒层(stratum granulosum)、棘层(stratum spinosum)和基底层(stratum basale),每一层中都含有不同的蛋白酶和抑制剂,它们驻留在各种细胞室,包括细胞器内,锚定到细胞膜上,分布在细胞外基质间。图2是表皮层蛋白酶及其抑制剂的示意图。其中不同家族的蛋白酶和相应的抑制剂用同一种颜色表示。主要的蛋白酶类有金属蛋白酶(红色)、丝氨酸蛋白酶(蓝色)、半胱氨酸蛋白酶(橙色)、天冬氨酸蛋白酶(绿色)以及紫色的扁菱形蛋白酶irhom2[6]。这些蛋白酶参与角质细胞的分化与成熟(例如ADAM17 (在高尔基体中被Furin 蛋白酶激活,参与后期的细胞成熟化过程,如表皮生长因子EGF及其配体的调节),ADAM17缺乏会导致炎症性皮肤和肠综合征);参与信号转导过程(例如ADAM10 (与分化初期核信号传导途径相关,剪切E-cadherin(钙黏着蛋白),从而促进β-连环蛋白转移至内核中并激活下游目的基因的表达)。此蛋白功能的缺失会导致网状肢端色素沉着);维持正常的皮肤功能(例如半胱天冬酶 caspase 14,缺失会导致角质延迟或角化不全);这些蛋白酶的活性都受抑制剂的调节。
在非炎症条件下,两种主要的蛋白酶负责健康皮肤的大部分蛋白水解活性,即激肽释放酶(KLK)5和7。蛋白酶抑制剂LEKTI(淋巴上皮Kazal型相关抑制剂)在正常条件下调节这两种蛋白酶的活性[7]。大多数组织蛋白酶通常作为无活性蛋白酶分泌,然后在组织中被激活。 其一个例子是皮肤中的三种主要的激肽释放酶5,7和14的激活。它们都以非活性状态分泌,然后在组织中活化。激肽释放酶5通过自我裂解以低速自动激活。活化的激肽释放酶5然后激活激肽释放酶7和14,活化的激肽释放酶14反过来激活激肽释放酶5和7,从而加速激活。所有这些都受到组织中蛋白酶抑制剂的量的调节,如何维持这种平衡还没有完全阐明,也几乎不可能确定,因为这种微妙的活化和抑制之间的平衡是依赖于各成分的局部浓度[8]。
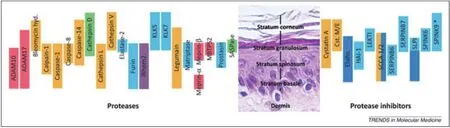
图2 表皮中的蛋白酶及其抑制剂[6]
由图2可见,表皮的正常功能主要是由丝氨酸蛋白酶及其抑制剂维持,是表皮层中最重要的一类蛋白酶。丝氨酸蛋白酶是一个以丝氨酸为活性中心的重要蛋白酶家族,它们的作用是断裂大分子蛋白质中的肽键,使之成为小分子蛋白质。在哺乳类动物里面,丝氨酸蛋白酶扮演着很重要的角色,特别是在消化,凝血和补体系统方面。胰蛋白酶就是其中最具代表性的一种。
4 胰蛋白酶
胰蛋白酶Trypsin (Parenzyme)为蛋白酶的一种,是从牛、羊、猪的胰脏提取的一种丝氨酸蛋白水解酶。在脊椎动物中,作为消化酶而起作用。它能把多肽链中赖氨酸和精氨酸残基中的羧基侧切[9]。它不仅起消化酶的作用,而且还能限制分解糜蛋白酶原、羧肽酶原、磷脂酶原等其它酶的前体,起活化作用。是特异性最强的蛋白酶,在决定蛋白质的氨基酸排列中,它是不可缺少的工具。胰蛋白酶专一作用有碱性氨基酸精氨酸及赖氨酸羧基所组成的肽键。酶本身很容易自溶,由原先的β-胰蛋白酶酶转化为α-胰蛋白酶,再进一步降解为拟胰蛋白酶,乃至碎片,活力也逐步下降而丧失。
胰蛋白酶能选择地水解蛋白质中由赖氨酸或精氨酸的竣基所构成的肽链,能消化溶解变性蛋白质,对未变性的蛋白质无作用,因此,能使脓、痰液、血凝块等分解、变稀,易于引流排除,加速创面净化,促进肉芽组织新生[10],此外还有抗炎症作用。
5 结论
贻贝粘蛋白产品目前的适应症主要集中在皮肤浅表创面的防护,而皮肤中主要的蛋白酶是丝氨酸蛋白酶。因此,我们可以利用丝氨酸蛋白酶的代表-胰蛋白酶研究贻贝粘蛋白的降解,从而了解贻贝粘蛋白的降解特性,为贻贝粘蛋白产品的开发和应用提供依据。
[1] Haeshin L, Norbert F.S, Phillip B.M. Single-molecule mechanics of mussel adhesion [J].Pnas, 206,103(35):129-1303.
[2] Waite J.H, Benedict C.V. Asay of Dihydroxyphenylalanine(Dopa) in Invertebrate Structural Proteins [J]. Methods in Enzymology,1984,107:397-413.
[3] YuM,HWANGJ, DEMINGTJ.Roleof L-3,4-Dihydroxyphenylalanine in Mussel Adhesive Proteins [J].J Am Chem Soc,19,121:5825-5826.
[4] 胡学智,王俊.蛋白酶生产和应用的进展[J].工业微生物,2008,38(4).
[5] 徐晓峰(导师:冷云伟).重组胰蛋白酶大肠杆菌的发酵与表达[D].中国矿业大学硕士论文, 2016.
[6] De Veer, Simon J, Furio, et al. Proteases: common culprits in human skin disorders.Trends in Molecular Medicine , 2014, 20(3):166-178.
[7] Kasparek P, et al. KLK5 and KLK7 Ablation Fully Rescues Lethality of Netherton Syndrome –Like Phenotype[J]. PLOS Genetics, 2017,13,1.
[8] Prassas I., Eissa A., Poda G., et al. Unleashing the therapeutic potential of human kallikrein- related serine proteases[J]. Nature Reviews Drug Discovery, 2015 (14): 183-202.
[9] 邓菊云.微生物碱性蛋白酶研究进展[J].现代食品科技,2008,24(3).
[10] 汪世华,王文勇,黄益洲,等.丝氨酸蛋白酶研究进展[J].福建农业学报,2007,22(4): 453-456.

