真菌毒素(DON、AFB1)对 HepG2/C3A细胞联合毒性及机理研究
李文竹, 张根义, 桑亚秋
(江南大学 食品学院,江苏 无锡 214122)
脱氧雪腐镰刀菌烯醇 (Deoxynivalenol,简称DON)是一种单端孢霉烯族毒素,主要是由生长在谷类物品如小麦、玉米等上的粉红镰刀菌和禾谷镰刀菌产生。因该毒素能够引发动物呕吐的特征,故将其定名为呕吐毒素 (Vomitoxin)[1-2]。黄曲霉毒素(Aflatoxin,简称AFT)是一类主要由黄曲霉和寄生曲霉在一定条件下产生的毒性代谢产物的总称[3-4]。在大豆、玉米、牛奶等制品中经常会发现其存在,黄曲霉毒素已经导致严重的食品安全问题。其中黄曲霉毒素B1的毒性最强,具有很强的致癌性、致畸性和致突变性[5-7]。AFB1是一种肝毒素,主要作用于肝脏细胞,而DON虽无明确的靶器官,但是主要作用于分裂较快的细胞[8]。实验采用HepG2/C3A作为实验对象,除能形成稳定的细胞系,有利于实验的连续性,一致性外,还具有较高的P450酶系,主要参与外源性药物的代谢,对体内的物质转化也起到重要作用[9-10]。近几年,国内外研究者也对其联合作用有不同的研究,国外对于坦桑尼亚北部人群食用比目鱼可能接触到多种真菌毒素进行研究,发现AFB1与DON同时存在,并且对于当地小孩造成严重毒害现象[11]。有研究表明,当AFB1与DON同时作用于猪的肝脏细胞后,其细胞存活率明显下降,可以观察到线粒体肿胀、内质网扩张以及许多脂肪粒等现象,其联合作用效果表现出明显的加和效应[12],但是并没有涉及到基因表达层面的具体毒性机制。现如今人们面临真菌毒素的危害多是2种或者2种以上真菌毒素的同时存在,这也大大增加了对人及动物的危害性。而当前国内外主要侧重于研究单一真菌毒素毒性情况,对于2种或多种真菌毒素的联合作用研究尚且不多[13-14]。DON与AFB1常存在于同一谷物中,因此本研究主要探讨2毒素对HepG2/C3A细胞的联合毒性作用,及诱导HepG2/C3A细胞发生凋亡的毒性机制探究,为研究多种真菌毒素共存时的联合作用机制提供理论基础,并结合低浓度下引起细胞凋亡程度对真菌毒素的早期检测提供依据,在食品安全方面具有重大意义。
1 材料与方法
1.1 材料与仪器
人肝癌细胞株HepG2/C3A,美国模式培养物集存库提供;脱氧雪腐镰刀菌烯醇(DON)、二甲亚枫(DMSO)、SRB 染料、 三氯乙酸 (TCA)、Tris base、Hoechst33258、小牛胸腺DNA,美国Sigma公司产品;黄曲霉毒素B1(AFB1),上海百灵威化学技术有限公司产品产品;DMEM低糖培养基、MEM、HEPES、胎牛血清(FBS)、含 2.5 g/L EDTA 的胰蛋白酶(Trypsin)、无酚红 HBSS,Gibco 公司产品;细胞凋亡检测试剂盒、细胞周期检测试剂盒,碧云天公司产品;UNIQ-10柱式Trizol总RNA抽提试剂盒,上海生工生物工程技术服务有限公司产品;PrimeScriptTMRT试剂盒、SYBR®Premix Ex TaqTMII试剂盒,常州博弘生物工程有限公司产品。
CO2细胞培养箱、实时荧光定量PCR仪,美国Thermo公司产品;荧光酶标仪,美国Molecular Devices公司产品;流式细胞仪,美国碧迪公司产品。
1.2 试验方法
1.2.1 细胞复苏与培养 从液氮灌中取出冻存管于37℃恒温水浴锅中解冻1 min左右,并轻轻摇动令其尽快融化,用乙醇消毒后开启,吸出细胞悬液于离心管中,900 r/min离心5 min,弃上清液,加入含有体积分数20%胎牛血清培养液,并轻轻吹打,接种到培养瓶中,于37℃,体积分数5%CO2培养箱中进行培养,次日用含体积分数10%胎牛血清培养液更换进行常规培养。HepG2/C3A细胞采用含有体积分数10%的胎牛血清、体积分数1%MEM以及体积分数1%的HEPES的DMEM低糖培养基于37℃,体积分数5%CO2培养箱中进行培养。细胞生长恢复到正常状态并处于对数期即可进行后续试验。
1.2.2 DON、AFB1对HepG2/C3A细胞单独及联合抑制率的测定 采用SRB染色法[15]测定细胞增值抑制率。调整细胞密度为1×104个/孔,接种于96孔板,同时设定空白组,孵育24 h后,加入含毒素的培养液。设置DON、AFB1单独作用浓度分别为:DON浓度为 0 (溶剂对照组)、0.56、1.125、2.25、4.5、6.75 μmol/L;AFB1浓度为 0(溶剂对照组)、2.5、5、10、20、30 μmol/L。 联合染毒浓度为 0(溶剂对照组),DON(0.56 μmol/L) +AFB1(2.5、5、10、20 μmol/L);DON(1.125 μmol/L)+AFB1(2.5、5、10、20 μmol/L);DON(2.25 μmol/L)+AFB1(2.5、5、10、20 μmol/L)。 每组设定5个平行孔,继续孵育24 h后,加入200 μL 4℃遇冷的三氯乙酸(TCA)溶液,4℃下固定1 h后,用去离子水洗4遍,室温晾干,加入4 g/L SRB染液,室温下避光染色30 min,体积分数1%的乙酸溶液洗4遍,室温晾干。加入10 mmol/L的Tris base缓冲溶液200 μL,于酶标仪上震荡5 min后测定490 nm下的吸光度 (A)。计算不同浓度的真菌毒素对HepG2/C3A细胞的增值抑制率。增值抑制率计算式:
增值抑制率=[1-(A1-A0)/(A1-A0)]×100%[16]。式中,A1表示实验组吸光度值,A0表示空白组吸光度值
1.2.3 细胞内总双链DNA含量测定 调整细胞密度为2×104个/孔,接种于96孔板,孵育 24 h后,加入含毒素的培养液。DON、AFB1单独及混合作用浓度同1.2.2。每组设定5个平行孔,继续孵育24 h后,用37℃预热的HBSS洗一遍,将96孔板置于-80℃冰箱中冷冻1 h后于37℃水浴锅中加热30 min,加入 100 μL 去离子水,再次冷冻 1 h,将其取出后于37℃水浴锅中加热30 min,向每个孔中加入 100 μL 20 μg/mL 的 Hoechst 33258 染液,摇晃孔板使其混匀。同时配制小牛胸腺DNA标准曲线。室温下避光静置30 min,采用荧光酶标仪测定各孔的荧光值。
1.2.4 HepG2/C3A细胞凋亡率测定 调整细胞密度为3×105个/孔,接种于 12孔板,孵育 24 h后,分别对应加入 0.56 μmol/L DON 和 2.5 μmol/L AFB1以及两者混合浓度,并设定对照组继续孵育24 h后,PBS洗涤贴壁细胞并收集细胞,取5万~10万重悬的细胞,1 200 r/min离心 5 min,加入 195 μL AnnexinV-FITC结合液轻轻重悬细胞。再加入5 μL AnnexinV-FITC,轻轻混匀后,加入 10 μL 碘化丙啶染色液,室温避光孵育15 min,随即进行流式细胞仪检测。
1.2.5 HepG2/C3A细胞周期测定 调整细胞密度为3×105个/孔,接种于 12孔板,孵育24 h后,分别对应加入 0.56 μmol/L DON 和 2.5 μmol/L AFB1以及两者混合浓度,并设定对照组继续孵育24 h后,PBS洗涤贴壁细胞并收集细胞,加入1 mL冰浴预冷的PBS,重悬,1 200 r/min离心5 min,弃上清液,加入1 mL冰浴预冷的体积分数70%乙醇,混匀,4℃固定24 h。再次1 200 r/min离心5 min,加入1 mL冰浴预冷的PBS继续1 200 r/min离心5 min,最后弃上清液,加入PI染色工作液500 μL,37℃孵育30 min,随即进行流式细胞仪检测。
1.2.6 RNA提取及实时荧光定量PCR 调整细胞密度为5×106个/孔,接种于6孔板,孵育24 h后,分别对应加入 0.56 μmol/L DON 和 2.5 μmol/L AFB1以及两者混合浓度,并设定对照组继续孵育24 h后。采用UNIQ-10柱式Trizol总RNA抽提试剂盒进行RNA提取,采用PrimeScriptTMRT试剂盒进行RNA反转录,以及采用SYBR®Premix Ex TaqTMII试剂盒进行QPCR反应。按2-△△Ct方法计算。上下游引物以及内参引物序列见下表1所示。
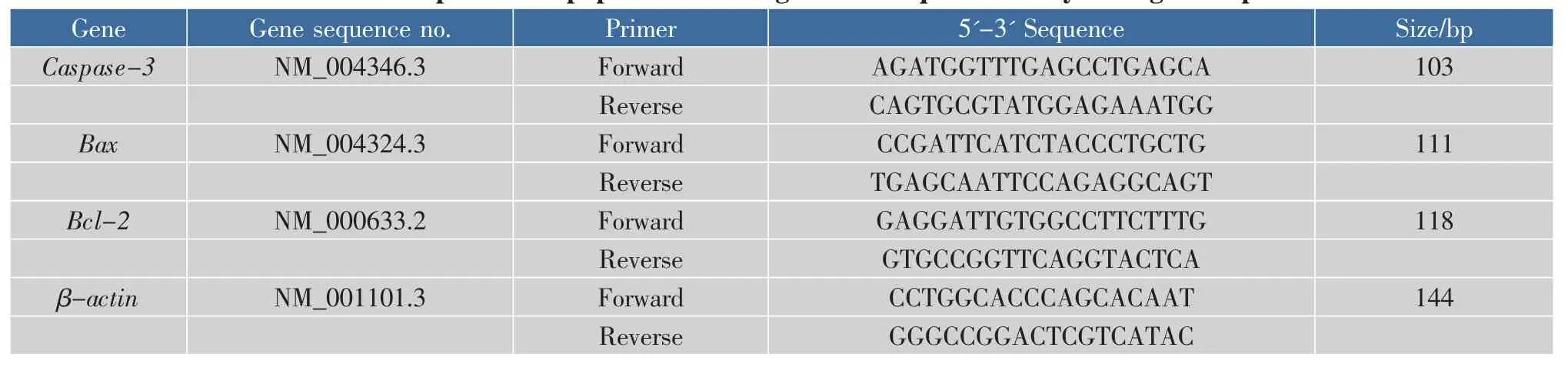
表1 凋亡相关基因引物序列Table 1 Primer pairs for apoptosis-related gene in RTq-PCR analysis of gene expression
1.2.7 RNA-Seq测序 调整细胞密度为5×106个/孔,接种于6孔板,孵育24 h后,分别对应加入0.56 μmol/L DON和2.5 μmol/L AFB1以及两者混合浓度,并设定对照组继续孵育24 h后,收集细胞并速冻后利用干冰运送,委托深圳华大基因进行RNASeq全基因测序。
1.2.8 统计学分析 所有试验重复3次,每组浓度设定5个平行。采用origin85进行绘图,SPSS 19.0软件进行单因素方差分析 (One-way ANOVA),以p<0.05为显著性差异,p<0.01代表具有高度显著差异。联合作用类型采用成对样本T检验分析。实验数据均以±s(平均值±标准差)形式表示。
2 结语与讨论
2.1 DON、AFB1对HepG2/C3A细胞增殖抑制率影响
真菌毒素 DON、AFB1单独及联合作用于HepG2/C3A细胞后,其结果表明,不同浓度DON、AFB1以及两者混合毒素分别处理HepG2/C3A细胞24 h后,与对照组相比,随着毒素处理剂量的增加,单独作用时的毒素对HepG2/C3A细胞的增值抑制率不断增加,呈现出剂量相关性。如图1(a)所示,当DON单独作用24 h,浓度从0.56~6.75 μmol/L时,其抑制率从25.24%增加到50.62%,而AFB1单独作用浓度从2.5~30 μmol/L时,其细胞增值抑制率由20.18%增加到39.22%。当两者以不同浓度混合作用于该细胞时如图1(b)所示,其细胞抑制率不断增加,并且均高于单独作用时的抑制率,呈现出剂量相关性。由图1(a)可以看出DON的毒性较AFB1要高,当毒素浓度逐渐升高,对细胞的损伤作用越大,造成细胞死亡越严重。
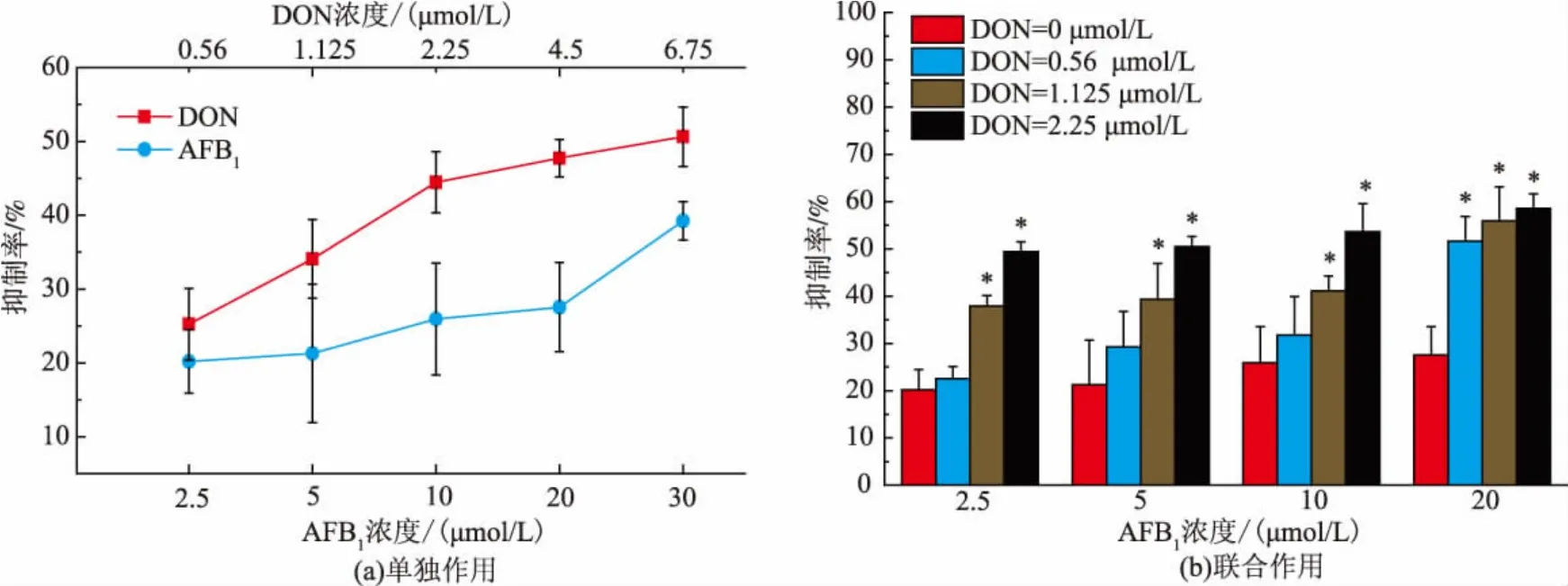
图1 真菌毒素DON、AFB1对HepG2/C3A细胞的增值抑制率的影响(24 h)Fig.1 Effect of DON and AFB1on proliferation inhibition rate on HepG2/C3A cells(24 h)
2.2 DON、AFB1对细胞内总双链DNA相对含量的影响
当细胞受到真菌毒素的作用时,会引起细胞内线粒体损伤,造成细胞内DNA双链发生一系列变化,从而引起DNA损伤。不同浓度DON、AFB1以及两者混合毒素分别处理HepG2/C3A细胞24 h后,与对照组相比,随着毒素处理剂量的增加,单独作用时的毒素使得HepG2/C3A细胞内的双链DNA含量不断减少,呈现出剂量相关性。如图2(a)所示,当DON浓度从0.56~6.75 μmol/L时,其相对含量从75.28%下降到50.90%,而AFB1单独作用浓度从2.5~30 μmol/L时,其双链DNA相对含量由79.56%下降到58.87%。可以看出DON引起DNA相对含量变化程度高于AFB1。当两者以不同浓度混合作用于该细胞时,结合图2(b)所示,可以看出其细胞内DNA相对含量呈现下降的趋势,并且均低于单独作用时的DNA相对含量。
2.3 DON、AFB1对细胞凋亡率的影响
正常细胞中磷酯酰丝氨酸(PS)位于细胞膜的内表面,细胞受到外来刺激,引起细胞发生早期凋亡时,PS会从细胞膜内迁移到细胞膜外表面。Annexin是一类广泛分布于真核细胞浆内钙离子依赖的磷脂结合蛋白,参与细胞内的信号转导。AnnexinV选择性的结合PS从而可以检测到细胞的早期凋亡。而碘化丙啶(PI)是一种核酸染料,它并不能透过完整的细胞膜,但是在细胞发生晚期凋亡的时候,细胞膜通透性增加,此时PI可以透过细胞膜使得细胞核染成红色。采用AnnexinV-FITC双染试剂[17],可以判断出细胞出现各个凋亡阶段的情况。从实验结果可以看出,低浓度的0.56 μmol/L DON、2.5 μmol/L AFB1以及两者混合毒素分别处理HepG2/C3A细胞24 h,与对照组相比,两者均能引起细胞产生显著的凋亡现象,并且联合作用条件下引起细胞发生凋亡的程度均高于单独作用时的情况。
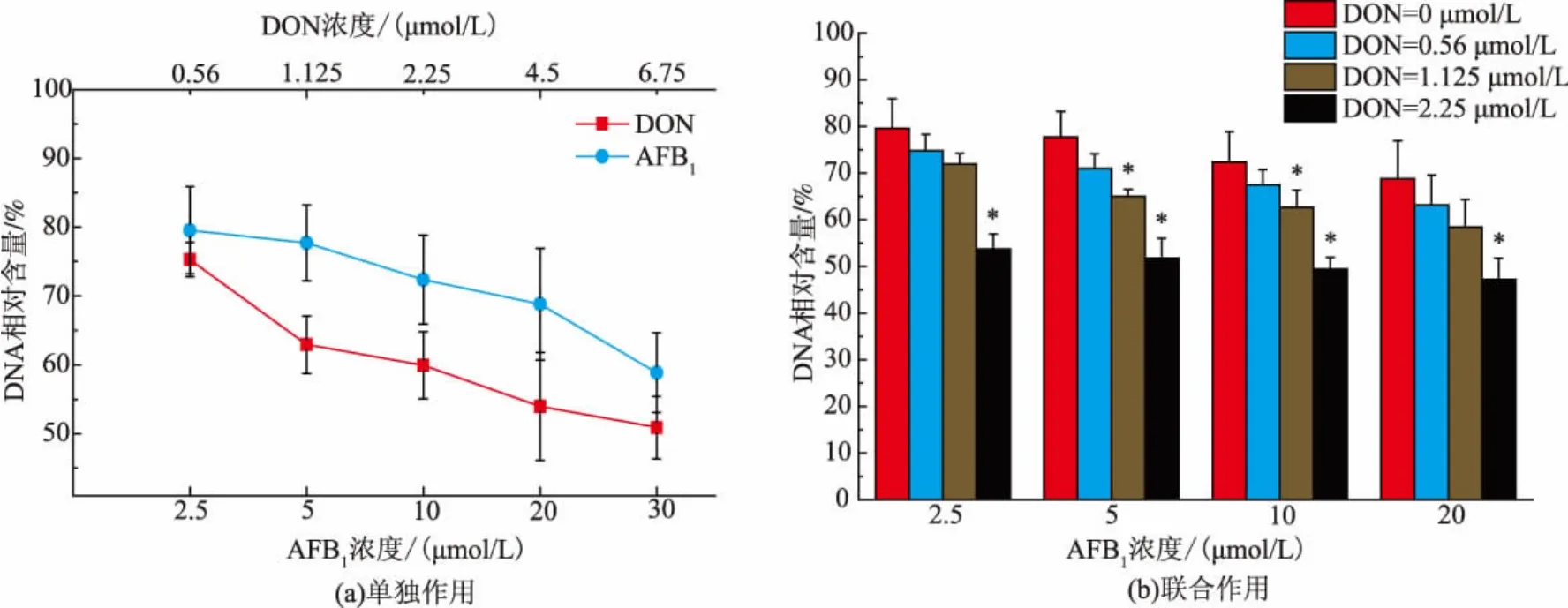
图2 真菌毒素DON、AFB1对HepG2/C3A细胞内双链DNA的影响(24 h)Fig.2 Effect of DON and AFB1on DNA content on HepG2/C3A cells(24 h)

图3 真菌毒素DON、AFB1对HepG2/C3A细胞凋亡率的影响(24 h)Fig.3 Effect of DON and AFB1on apoptosis rate of HepG2/C3A cells(24 h)
2.4 DON、AFB1对细胞周期的影响
碘化丙啶(PI)是一种双链DNA荧光染料,与双链DNA结合后可以产生荧光,并且所产生的荧光强度与双链DNA相对含量成正比。因此,通过流式细胞仪测定细胞中DNA相对含量,使用Modifit软件分析细胞周期分布,得出各个时期细胞所占比例,从而判断出各毒素组对细胞生长阶段的阻滞情况[18]。
从实验结果可以看出,0.56 μmol/L DON、2.5 μmol/L AFB1以及两者混合毒素分别处理HepG2/C3A细胞24 h,与对照组相比,0.56 μmol/L DON组能够引起G2/M期细胞增加,而2.5 μmol/L AFB1组能够引起S期和G2/M期细胞比例增加,当两者混合作用于HepG2/C3A细胞时,能同时引起S期和G2/M期细胞比例增加,说明0.56 μmol/L DON可以引起细胞G2/M期发生阻滞,2.5 μmol/L AFB1以及两者混合作用下可以诱导细胞发生S期和G2/M期阻滞现象。经过分析,2种真菌毒素单独作用引起HepG2/C3A细胞周期发生变化与联合作用时并不具有显著差异(p<0.05),这也再次说明了2种真菌毒素作用于HepG2/C3A细胞的联合作用类型为加和作用。
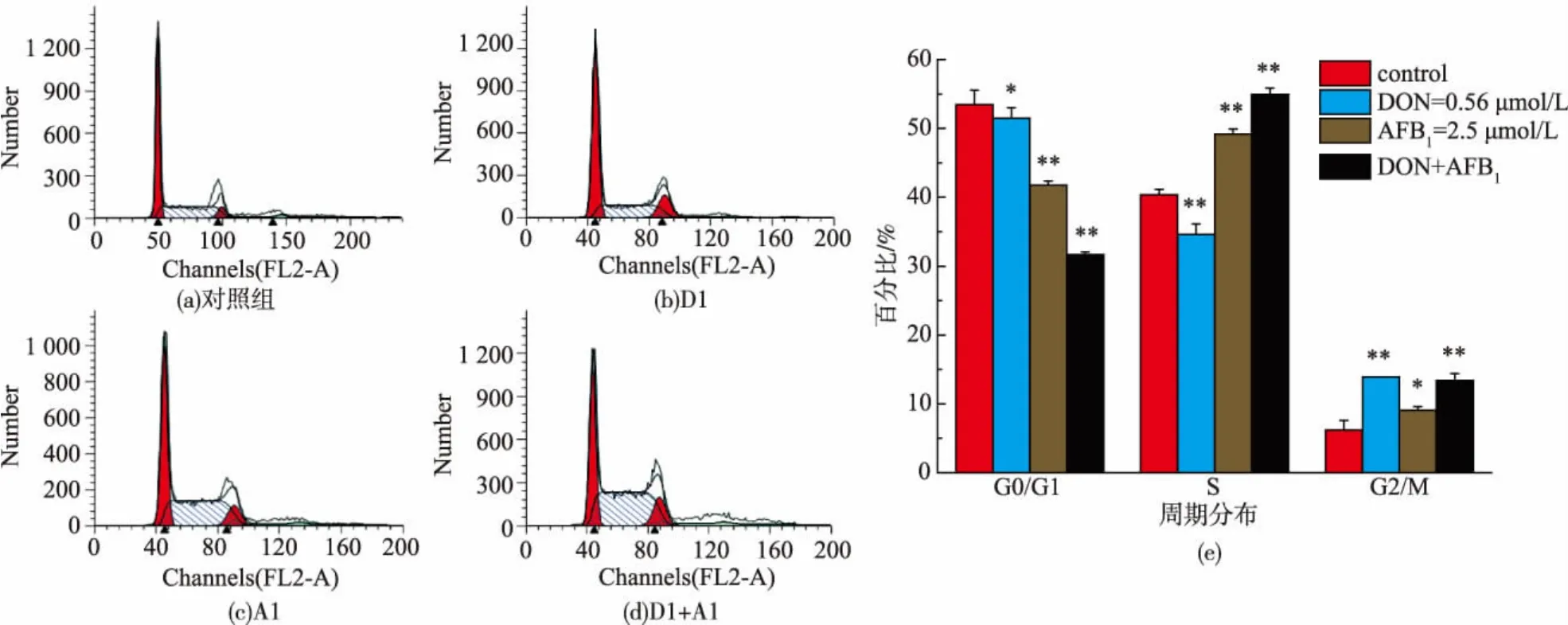
图4 真菌毒素DON、AFB1对HepG2/C3A细胞周期的影响(24 h)Fig.4 Effect of DON and AFB1on cell cycle of HepG2/C3A cells(24 h)
2.5 DON、AFB1对细胞凋亡相关基因mRNA表达量影响
为了进一步研究DON和AFB1对细胞凋亡的影响,又通过RT-qPCR对细胞凋亡相关基因Caspase-3,Bax和 Bcl-2 mRNA水平进行研究,见图5。实验结果表明,caspase-3和Bax的mRNA相对表达量增加而Bcl-2表达量则下降且变化具有显著性差异。并且2种毒素的混合作用引起的相关基因mRNA表达程度均要高于单独作用情况,后者Bcl-2混合作用时的表达量低于单独作用时的表达水平。这进一步证明二者作用于HepG2/C3A细胞的联合效应为加和效应。
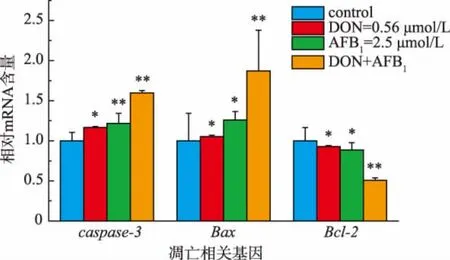
图5 真菌毒素DON、AFB1对HepG2/C3A细胞凋亡相关基因mRNA表达的影响(24 h)Fig.5 Effect of DON and AFB1on apoptosis-relative genes mRNA level of HepG2/C3A cells(24 h)
2.6 DON、AFB1对细胞联合毒性作
实验主要针对以上细胞毒性指标的测定来分析其可能的相互作用类型,通过对上述毒性指标的实验值与理论值进行成对样本T检验分析其显著性来说明此2种真菌毒素作用于HepG2/C3A细胞的联合毒性类型。其分析结果见表2所示。
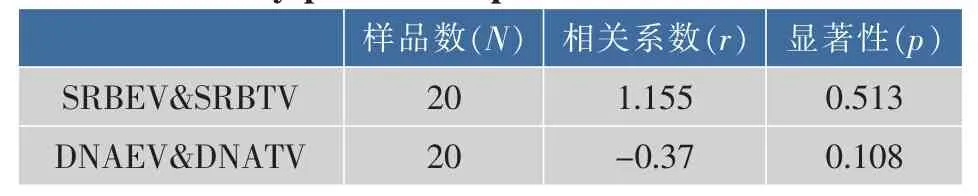
表2 成对样本T检验分析HepG2/C3A细胞内四个毒性指标实验值与理论值的差异Table 2 Differences between EV and TV on HepG2/C3A cells by paired-samples T-tests
经过成对样本T检验分析后得出,上述2个毒性指标的实验值与理论值之间并没有显著差异,即p>0.05。表明这2种毒素作用于HepG2/C3A细胞的联合类型为加和作用。
2.7 RNA-Seq测序及机理研究
2.7.1 差异基因表达筛选及聚类分析 经RNASeq测序,我们进行3组样品的对比分析,利用RPKM(Reads Per Kb Million reads)算法[19]计算出每组比对样品中基因的表达量,通过比较不同样本之间的数据从而筛选出差异表达的基因,其组间差异基因见图6(a)所示。其中AFB1处理组中有182个基因表达上调,6个基因表达下调;DON处理组中有74个表达基因上调,79个基因表达下调;混合处理组中基因表达上调的有260,基因表达下调的有98个。针对组间差异之间的交集聚类分析,取显著差异表达基因差异倍数的log2值利用cluster软件对其进行聚类分析,结果见图6(b)所示,其中每一行代表一个基因,每一列代表一个实验条件,右边对应的是该基因的ID号。
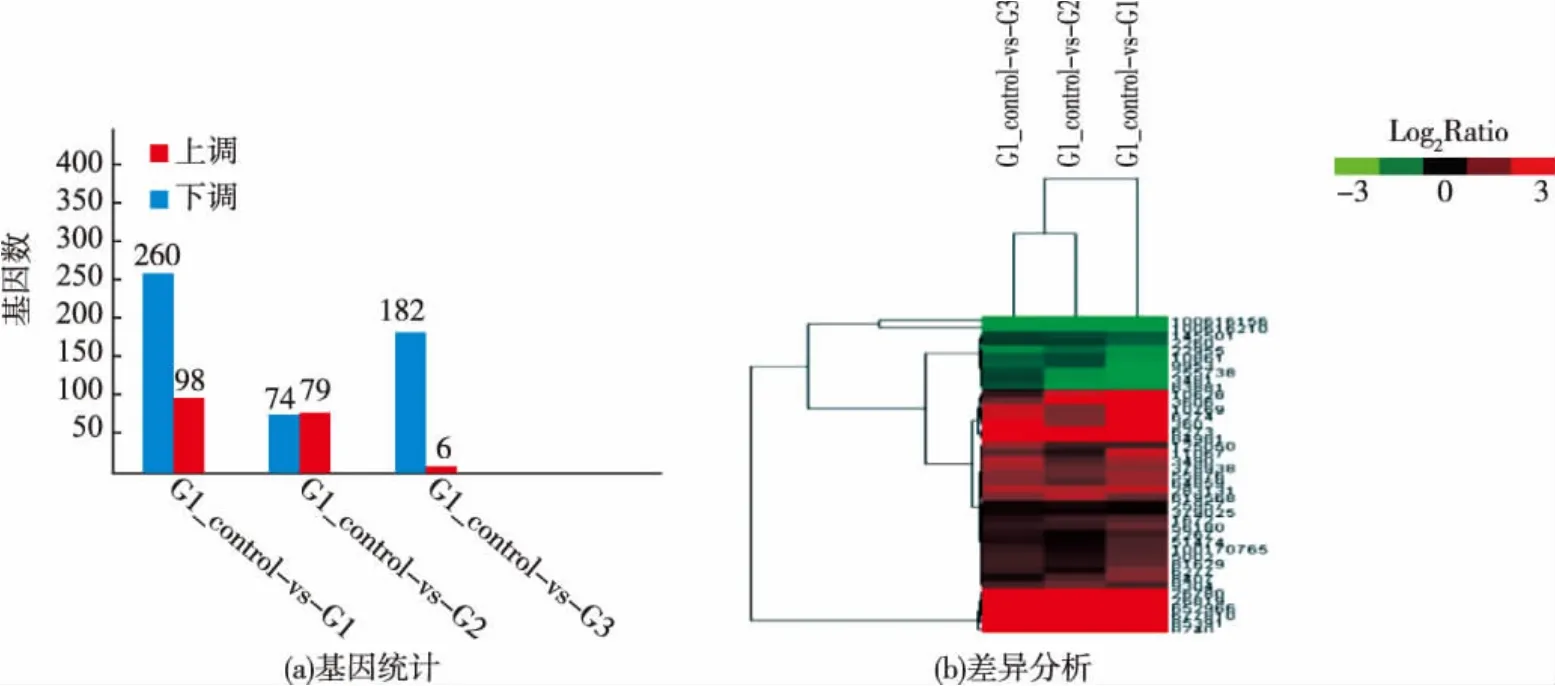
图6 3组比对样本间差异基因统计和聚类分析Fig.6 Three groups of differentially expressed genes and cluster analysis
2.7.2 Pathway分析 通过对富集出来的差异基因,进一步做pathway富集分析,主要是以KEGG pathway[20]为单位,应用超几何检验,找出与整个基因组比较后差异表达基因中显著性富集的pathway。结果显示AFB1以及AFB1与DON混合处理组所富集出来的pathway主要是通过P53信号通路(p<0.01)影响细胞凋亡和周期阻滞。而DON处理组中P53信号通路并不显著,而DON主要是影响核糖体循环这条通路(p<0.01),阻止蛋白质合成,对细胞造成一定程度的毒性作用。但是单独和混合作用组都会引起JNK/c-JUN通路和P38 MAPK通路的激活,pathway分析结果与Mishra[21]和Lu[22]等研究结果一致,也有文献报道真菌毒素ST会通过这些通路进而影响细胞周期阻滞、细胞凋亡及DNA损伤等毒性作用[23-24]。从实验测序中可以看出,DON与AFB1作用于HepG2/C3A细胞的主要毒性机理并不相同,混合作用组中AFB1起主导作用。
3 结语
研究发现,DON和AFB1均能引起细胞增殖抑制率增加以及细胞内总双链DNA的下降,并且其混合作用强度均大于单独作用效果,经成对样本T检验分析,两者联合作用为加和作用,这也与之前研究结果相同[12]。Sun L.H.[25]等研究多种真菌毒素对大鼠肝脏细胞的毒性作用,结果表明AFB1与DON的联合作用为协同作用。有人研究了由于实验对象的不同,从而导致联合效应的不同[26]。本研究中当毒素作用浓度增加,引起的毒性变化不断增强,均表现出剂量相关性。且在低浓度下会引起相应毒性指标的变化,引起细胞凋亡和周期阻滞,可以反映出细胞早期染毒状态。凋亡相关基因caspase-3和Bax mRNA含量上升且Bcl-2 mRNA含量下降,进一步说明2毒素均能引起细胞发生凋亡并且两者的混合作用表现出加和效应。同时,通过RNA-Seq全基因测序分析,我们得到AFB1与DON作用于HepG2/C3A细胞的主要毒性机理并不相同。通过对差异基因进行pathway的分析得出AFB1主要影响P53信号通路(p<0.01)而DON主要影响核糖体循环这条通路(p<0.01),阻止蛋白合成,对细胞造成一定程度的毒性作用。但是他们同时都会引起JNK/c-JUN通路和P38 MAPK通路的激活。由此我们得出AFB1与DON主要是通过2条不同的信号通路同时影响细胞凋亡和细胞周期阻滞。从基因分子层面,研究其具体的主要凋亡途径。为食品安全防护提供有力的保护措施。
[1]HUANG Kai,HUANG Minging,ZHU Zuxian,et al.Research progress on toxicity of DON[J].Feed Review,2013,12:8-11.(in Chinese)
[2]SCHOTHORST R,VAN E H.Collection of occurrence data of Fusarium toxins in food and assessment of dietary intake by the population of EU member states[J].Toxicol Letter,2004,153:133-143.
[3]CHAN H T,CHAN C,HO JOHN W,et al.Inhibition of glycyrrhizic acid on aflatoxin B1-induced cytotoxicity in hapatoma cells[J].Toxicology,2003,188(2-3):211-217.
[4]JEANNOT E,BOORMAN G A,KOAYK O,et al.Increased incidence of aflatoxin B1-induced liver tumors in hepatitis virus C transgenic mice[J].Cancer,2012,130(6):1347-1356.
[5]WU Zhaofan.Research progress of AFB1[J].Gansu Science and Technology,2010,26(18):89-93.(in Chinese)
[6]KEW M C.Aflatoxins as a cause of hepatocellular carcinoma[J].Gastrointestin Liver Dis,2013,22(3):305-310.
[7]SUPRIYA C,GIRISH B P,REDDY P S.Aflatoxin B1-induced reproductive toxicity in male rats:possible mechanism of action[J].Toxicol,2014,33(3):155-161.
[8]DU R H,CUI J T,WANG T,et al.Trichothecin induces apoptosis of HepG2 cells via capase-9 mediated activation of the mitochondrial death pathway[J].Toxicon,2012,59(1):143-150.
[9]BANDELE O J,SANTILLO M F,FERGUSON M,et al.In vitro toxicity screening of chemical mixtures using HepG2/C3A cells[J].Food Chem Toxicol,2012,50(5):1653-1659.
[10]MASSEY T E,SMITH G B,TAM A S.Mechanisms of aflatoxin B1lung tumorigenesis[J].Lung Res,2000,26:673-683.
[11]MARTIN E K,CANDIDA P S,HAPPY M,et al.Co-exposures of aflatoxin with deoxynivalenol and fumonisin from maize based complementary foods in Rombo,Northern Tanzania[J].Food Control,2014,41:76-81.
[12]HE C H,FAN Y H,WANG Y,et al.The individual and combined effects of deoxynivalenol and aflatoxin B1on primary hepatocytes of cyprinus carpio[J].Int J Mol Sci,2010,11(10):3760-3768.
[13]THESLA P,MICHAEL F,DUTTON A,et al.Cytotoxicity of aflatoxin B1and its chemically synthesized epoxide derivative on the A549 human epithelioid lung cell line[J].Mycopathologia,2000,151:155-159.
[14]FATMA B,EMNA E G,SALWA A E,et al.Pathway of deoxynivalenol-induced apoptosis in human colon carcinoma cells[J].Toxicology,2009,264:104-109.
[15]VICHAI V,KIRTIKARA K.Sulforhodamine B colorimetric assay for cytotoxicity screening[J].Nature Protocols,2006,1(3):1112-1116.
[16]LI A P.Metabolism comparative cytotoxicity assay(MCCA)and cytotoxic metabolic pathway identification assay(CMPIA)with cryopreserved human hepatocytes for the evaluation of metabolism-based cytotoxicity in vitro:Proof-of-concept study with aflatoxin B1[J].Chem Biol Interact,2009,179(1):4-8.
[17]WSBER F,FREUDINGER R,SCHOWERDT G,et al.A rapid screening method to test apoptotic synergisms of ochratoxin A with other nephrotoxic substances[J].Tpxicology in Vitro,2005,19(1):135-143.
[18]WU Jianyong,ZHAO Dezhang.Comparison among several methods for apoptosis examination by flow cytometry[J].Journal of Chongqing Medical University,2010,35(9):1386-1389.(in Chinese)
[19]MORTAZAVI A,WILLIAMS B A.Mapping and quantifying mammalian transcriptomes by RNA-Seq[J].Nature,2008,5(7):621-628.
[20]KANEHISA M,ARAKIM,GOTO S,etal.KEGG forlinkinggenomesto life and environment[J].Nuleic Acids Research,2008,36:480-484.
[21]MISHRA S,TRIPATHI A,CHAUDHARI B P,et al.Deoxynivalenol induced mouse skin cell proliferation and inflammation via MAPK pathway[J].Toxicology and Applied Pharmacology,2014,279:186-197.
[22]LU X,HU B,SHAO L,et al.Integrated analysis of transcriptomics and metabonomics profiles in aflatoxin B1-induced hepatotoxicity in rat[J].Food and Chemical Toxicology,2013,55:444-455.
[23]XIN X,JUAN W,LING X X,et al.Involvement of MAPK and PI3K signaling pathway in stergmatocystin-induced G2 phase arrest in human gastric epithelium cells[J].Mol Nutr Food Res,2011,55:749-760.
[24]DONGHUI Z,YU C,HAITAO S,et al.stergmatocystin-induced DNA damage triggers G2 arrest via ATM/P53-related pathway in human gastric epithelium GES-1 cells in vitro[J].PloS One,2013,8(5):e65044.
[25]SUN L H,LEI M,ZHANG N Y,et al.Individual and combined cytotoxic effects of aflatoxin B1,zearalenone,deoxynivalenol and fumonisin B1 on BRL 3A rat liver cells[J].Toxicon,2015,95:6-12.
[26]MCKEAN C,TANG L,TANG M,et al.Comparative acute and combinative toxicity of aflatoxin B1and fumonisin B1in animals and human cells[J].Food Chem Toxicol,2006,44(6):868-876.

