影响洋葱浓缩汁高温凝聚物形成因素及其控制
薛娜娜, 张 慜*, 卢利群
(1.江南大学 食品学院,江苏 无锡 214122;2.海通食品集团有限公司,浙江 慈溪 315300)
洋葱,俗称玉葱、圆葱等,为百合科葱属草本植物,耐寒,高产,耐贮运,供应期长[1],是我国特色的农产品资源和调味料,也是传统的药食两用植物。
近现代医学研究表明,洋葱中含有的化学成分主要为硫化物、类黄酮、苯丙素酚类、甾体皂甙类、含氮化合物和前列腺素类等;其药理作用主要有抑菌、抗癌、降血糖、降血脂、抗血小板凝聚和抗氧化作用等[2-3]。洋葱以其丰富的营养成分和良好的药理价值被誉为 “蔬菜皇后”[4]。
我国洋葱长期以鲜食为主,成熟的洋葱加工产品很少,且主要存在于调味料市场,如洋葱片或洋葱粉等干制品。近几年,葱姜蒜复配调味料[5]、洋葱酱[6]、洋葱保健酒[7]等附加值较高的洋葱制品逐渐被开发并报道。而在欧美国家,洋葱的食用量较大,除鲜食外,成熟的洋葱制品种类多样,可用于休闲食品和方便食品的调味[8]。目前在国际市场上,浓缩汁为贸易的主要形式[9],将洋葱加工成浓缩汁,不仅可以节省贮运量,延长贮藏期,还可以作为调味料根据需要任意调配,达到常年均衡供应,从而提高洋葱的利用价值,推动我国调味料和农产品加工的国际化发展。
目前我国洋葱浓缩汁的加工中存在技术难题,其中有洋葱浓缩汁(70°Brix)用高温(>95 ℃)自来水稀释后有凝聚物形成,且静置一定时间后,凝聚物基本完全沉降形成沉淀。这种凝聚物一经产生,不会自行消失,严重影响产品的品质,降低消费者对产品的可接受程度。对影响此类洋葱浓缩汁凝聚物形成的因素及其控制方法研究至今未见报道。本实验对高温自来水稀释后无凝聚物产生的正常浓缩汁和有凝聚物产生的非正常浓缩汁的金属离子、总酚、蛋白质、黄酮、还原糖含量进行比较,研究了添加金属离子对正常浓缩汁的影响,分析了添加金属螯合剂对凝聚物的抑制作用,为解决洋葱浓缩汁高温凝聚物的形成问题提供参考。
1 材料与方法
1.1 材料与试剂
洋葱浓缩汁,海通食品科徐州有限公司提供;浓硝酸、高氯酸、没食子酸、福林酚试剂、碳酸钠、无水乙醇、磷酸、考马斯亮蓝G-250、亚硝酸钠、硝酸铝、氢氧化钠、芦丁、葡萄糖、3,5-二硝基水杨酸、酒石酸钾钠、苯酚、亚硫酸钠、柠檬酸、柠檬酸钠、乙二胺四乙酸二钠、六偏磷酸钠均为分析纯,购于国药集团化学试剂有限公司。
1.2 主要实验仪器
UV2600紫外可见分光光度计,天美(中国)科学仪器有限公司产品;SSW-420-2S型电热恒温水槽,上海博迅实业有限公司医疗设备厂制造;Spectra-AA220原子吸收分光光度计,美国Varian公司产品;MX-S旋涡混合器,北京科博赛尔科技有限公司产品;PL203电子分析天平,梅特勒-托利多仪器(上海)有限公司产品;Starter-3100型pH计,上海五久自动化设备有限公司产品。
1.3 实验指标与测定方法
1.3.1 金属离子质量分数的测定 正常浓缩汁和非正常浓缩汁样品经浓硝酸-高氯酸消化处理,处理方法参考GB 5009.15-2014标准,采用原子吸收分光光度计测定钾、钙、铁、锌、铜元素的质量分数。
1.3.2 总酚的测定 福林酚试剂法[10],取没食子酸标准品10 mg,去离子水溶解并定容至100 mL,得标准液。 分别准确量取标准液 0.0、0.1、0.2、0.3、0.4、0.5 mL于10 mL离心管中,加入5 mL去离子水,再分别依次加入0.5 mL福林酚显色剂和10 g/dL Na2CO3溶液2 mL,定容刻度。75℃水浴10 min,在760 nm波长下测定吸光度A。所得标准曲线方程为y=8.957x-0.001 8,R2=0.999 4。
取2种浓缩汁各1 g,去离子水定容至100 mL,分别取0.5 mL溶液于10 mL离心管,按标曲测定方法加入试剂,以空白溶液作为参比溶液,在760 nm波长下测定吸光度。
1.3.3 蛋白质的测定 考马斯亮蓝法[11],精确称取牛血清蛋白10 mg,用去离子水定容至100 mL,配制成0.1 mg/mL的BSA标准溶液,置于4℃冰箱备用。精确称取考马斯亮蓝G-250 100 mg,用50 mL体积分数95%的乙醇溶解,边搅拌边加入100 mL 85%的磷酸,稀释定容至1 L,摇匀,过滤,配置成考马斯亮蓝G-250溶液,贮存于棕色试剂瓶中备用。
分 别 准 确 量 取 0、0.2、0.4、0.6、0.8、1.0 mL 的BSA标准液于刻度试管,分别补加蒸馏水至1.0 mL,均加入5 mL考马斯亮蓝G-250溶液,每加完一支,立即振荡,静置2~5 min后,在595 nm波长下测定吸光值。可溶性蛋白质量分数y与吸光值x之间的关系为 y=6.488x+0.099 8,R2=0.998 2。
取2种浓缩汁各1 g,记录称取的质量,去离子水定容至100 mL,分别取溶液1 mL于试管中,按照标准曲线制作方法,以空白溶液作为参比液,在595 nm波长下测定吸光度。
1.3.4 黄酮的测定 亚硝酸钠-硝酸铝法[12],精确称取105℃烘干至恒重的芦丁25 mg至50 mL容量瓶中,加入30%乙醇溶解,超声波处理至芦丁完全溶解,冷却、定容。精密量取20 mL芦丁溶液至50 mL容量瓶,30%乙醇定容,摇匀,配制成0.2 mg/mL的芦丁溶液。准确配制5%亚硝酸钠溶液、10%硝酸铝溶液、1 moL/L氢氧化钠溶液。
分别精确量取 0、1、2、3、4、5、6 mL、0.2 mg/mL的芦丁溶液于25 mL试管中,30%乙醇补足至8 mL,5%亚硝酸钠1 mL,振荡,静置6 min。分别加入10%硝酸铝1 mL,振荡,静置6 min。再分别加入1 moL/L氢氧化钠溶液 10 mL,30%乙醇定容至 25 mL,静置15 min后,采用分光光度计在510 nm处测定吸光值。所得标准曲线方程y=0.468 7x+0.004 2,R2=0.999 6。
取2种浓缩汁各3 g,记录称取的质量,稀释定容至50 mL,分别取溶液5 mL于25 mL离心管,按标准曲线方法,以空白溶液作为参比液,在510 nm波长下测定吸光度。
1.3.5 还原糖的测定 3,5-二硝基水杨酸法[13],精确称取100 mg分析纯葡萄糖(预先80℃烘干至恒重),少量蒸馏水溶解后转移到100 mL容量瓶中,定容至刻度,摇匀,配制葡萄糖标准溶液。取3,5二硝基水杨酸6.3 g、氢氧化钠21.0 g充分溶解于500 mL蒸馏水中(蒸馏水先煮沸10 min后冷却)。再加入酒石酸钾钠182.0 g,苯酚(在50℃水中融化)5.0 g,亚硫酸钠5.0 g,搅拌至全溶,定容至1 000 mL,配制成3,5-二硝基水杨酸溶液(DNS),充分溶解后于棕色试剂瓶中备用。
取6支具塞刻度试管,编号,精确加入1 mg/mL的葡萄糖标准液 0、0.2、0.4、0.6、0.8、1.0 mL,分别补加蒸馏水至2 mL,均加入DNS试剂1.5 mL,摇匀,沸水加热5 min后冷却至室温,用蒸馏水定容至20 mL,加塞后颠倒混匀。540 nm波长下,以0号管作为参比调零,测显色液的吸光值。所得标准曲线y=0.701 3x-0.071 1,R2=0.998 1。
准确称取2种浓缩汁各0.3 g左右,记录称量质量,分别用蒸馏水稀释定容至100 mL,80℃恒温水浴30 min,使还原糖浸出,取出后冷却,分别取0.5 mL还原糖提取液,按与制作标准曲线相同的方法操作,测定各管中溶液的吸光值。
1.3.6 澄清度的测定 分光光度法[14-15],取正常浓缩汁用95℃以上的自来水稀释至饮用要求,静置冷却至室温,取样液,稀释3倍,以自来水作为对照,在400~750 nm波长范围内以5 nm的间隔,用分光光度计连续测定样品的吸光度,以此来确定澄清度测定的合适波长。
2 结果与分析
2.1 金属离子与化学成分分析
2.1.1 金属离子质量分数的测定 如表1所示,2个样品中的所测的金属离子含量有显著差异。产生凝聚物的浓缩洋葱汁中Fe、Zn、Ca、K的金属质量分数分别是正常浓缩汁样品中对应的金属质量分数的4.51倍、1.63倍、1.04倍、1.03倍。浓缩汁采用高温自来水稀释后形成凝聚物,可能与这些活泼金属有关。活泼金属可能在凝聚物的产生过程中起到催化剂或激活剂的作用,也可能与浓缩汁中的某些物质直接发生反应,对凝聚物的产生造成重要影响。Fang等[16]对杨梅汁的沉淀物进行化学分析,检测发现沉淀物中含有钙、镁、钾等金属矿物质;孙英[17]在对胡萝卜浓缩汁的加工研究中发现,在胡萝卜汁产品贮藏过程中会有少量白色沉淀生成,对白色沉淀进行金属含量的分析,推断出白色沉淀主要为不溶性的钙盐、镁盐和铁盐。
2.1.2 化学成分比较 2种洋葱浓缩汁化学成分的比较如表2所示。非正常浓缩汁所含的总酚、蛋白质、黄酮和还原糖质量分数均高于正常品。温度的变化会对洋葱中所含的生物活性物质有不同程度的影响[18-19]。样品在高温自来水稀释后产生凝聚物的原因可能与原样品中所含的这4种物质中的某一物质或几种物质相关。结合表1的金属含量,酚类物质可能与活泼金属相互作用,或是酚类物质与蛋白质等物质形成复合物[20-21],在一定温度下,形成凝聚物。随时间的延长,凝聚物质聚集,形态增大,最终形成沉淀。 产生凝聚物的浓缩汁中的蛋白质质量分数比正常浓缩汁多大约58.8%。而蛋白质对温度敏感,温度越高,可能导致了蛋白质变性,促进凝聚物的形成。綦菁华[22]等对苹果浓缩汁二次混浊物的形态分析,初步确定苹果浓缩汁二次混浊物的化学成分主要是蛋白质和酚类以及两者自身或相互共聚的产物。
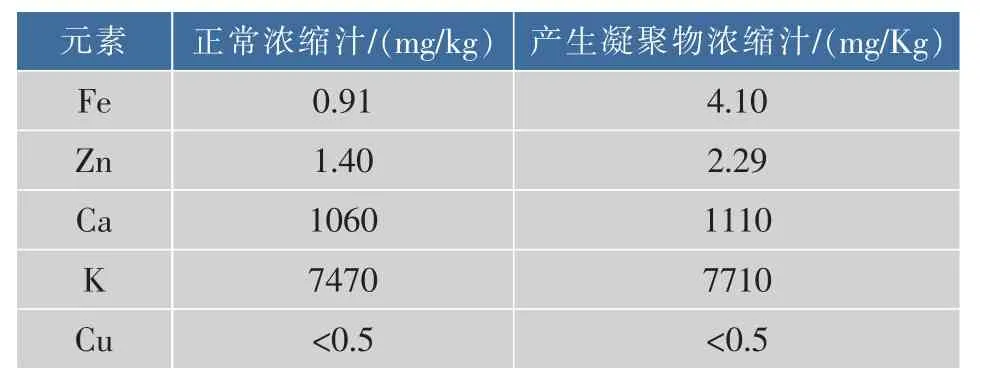
表1 正常浓缩汁和非正常浓缩汁金属质量分数的比较Table 1 Comparison of metal content between normal concentrate and abnormal concentrate
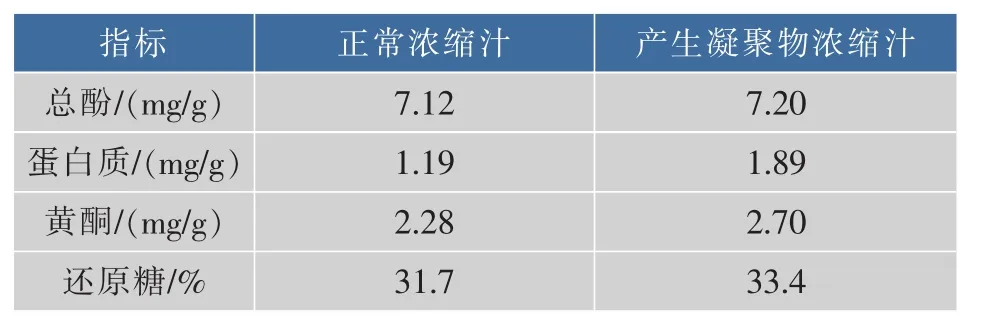
表2 正常浓缩汁和悬浮浓缩汁化学成分的比较Table 2 Comparison of chemical composition between normal concentrate and abnormal concentrate
洋葱的营养组成非常复杂,在许多国家,洋葱被认为是膳食黄酮类物质的主要来源之一[23]。洋葱原料中的黄酮类化合物可以降低不同类型的自由基,还可以作为金属离子的螯合剂[24]。非正常浓缩汁的黄酮质量分数高于正常汁,但相对于2个样品中金属离子质量分数的明显差距几乎可以忽略。不同的加热温度对不同品种洋葱所含总黄酮质量分数的影响不同[25]。加工过程中的高温以及浓缩汁中较高的金属离子质量分数会对黄酮化合物抗氧化作用有一定限制。
还原糖是指含有自由醛基和酮基的糖类。在果蔬的贮藏和加工过程中,还原糖与蛋白质会发生美拉德反应,使加工品发生非酶褐变。不同阶段发生的美拉德反应对产品的作用效果不同[26]。非正常浓缩汁比正常浓缩汁还原糖质量分数高,且加工过程中会经过高温,2组样品中均含有蛋白质,产生非正常浓缩汁高温自来水稀释后比正常浓缩汁的颜色深,这可能与还原糖的反应有关。凝聚物形成是否与还原糖和蛋白质发生反应有关,还需要进一步分析。
2.2 金属离子的添加对正常浓缩汁的影响
2.2.1 澄清度的扫描 对浓缩洋葱汁在加热稀释后的混浊程度进行量化,有利于评定控制凝聚物产生的方法对浓缩汁的影响程度。澄清度的测定首先需要确定合适的测定波长。扫描波长图1所示,在波长400~520 nm范围内,随波长的增加吸光度急剧减少,670~750 nm范围吸光度减小非常缓慢,但在695~710 nm范围内有吸光度的波动。根据Lambert-Beer定律,吸光度A越小,透光率越大,溶液澄清度就越高,混浊程度越小。选择较小且稳定的吸光度所对应的波长,有利于减少样品本身的颜色对澄清度比较所照成的误差。因此选择730 nm作为澄清度测定波长,用来比较溶液的澄清度。
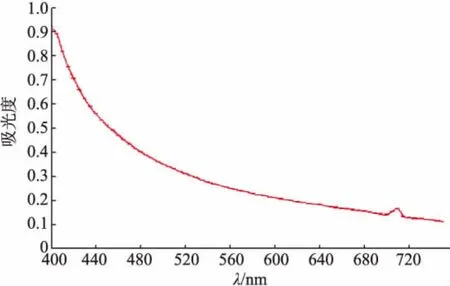
图1 洋葱浓缩汁稀释液在400~750 nm范围内的扫描曲线Fig.1 Scanning curve of the diluent of onion juice concentrate in the wavelength from 400~750 nm
2.2.2 金属离子的添加对正常浓缩汁的影响 取等量正常浓缩汁3 g,处理组7组,分别添加等质量的含 Na+、K+、Ca2+、Mg2+、Zn2+、Fe2+、Cu2+的金属无机盐,对照组为无添加的等质量正常浓缩汁。均用100 mL的95℃以上的自来水稀释,观察现象。对照组仍无凝聚物产生;添加K+、Na+、Cu2+的处理组无明显凝聚物形成;添加 Ca2+、Zn2+、Fe2+、Mg2+的处理组有明显凝聚物形成,静置后有明显沉淀。进一步研究Ca2+、Zn2+、Fe2+、Mg2+对正常浓缩汁稀释后的影响,分别向正常浓缩汁中添加不同质量分数的4种金属离子,测定溶液澄清度如图2所示。同时测定无添加的正常浓缩汁和悬浮浓缩汁稀释相同倍数后的澄清度。
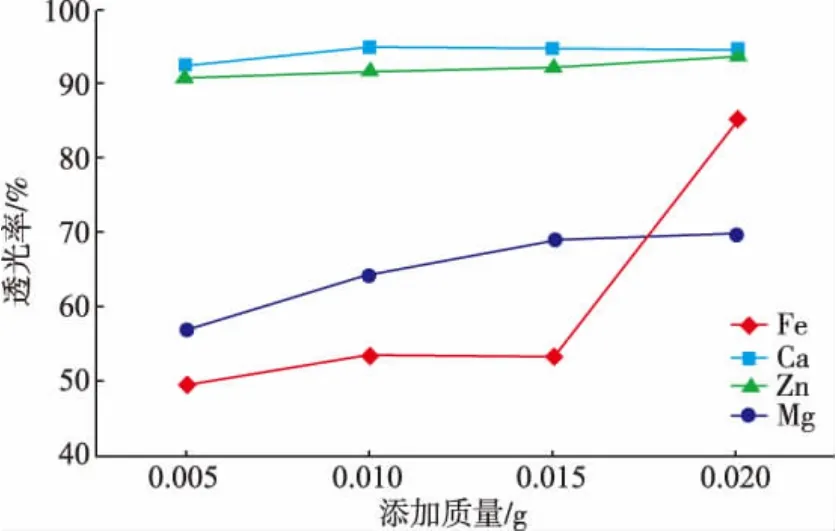
图2 Ca2+、Zn2+、Fe2+、Mg2+对正常浓缩汁稀释液澄清度影响Fig.2 Influence of calcium,zinc,iron and magnesium ions on clarification of the normal concentrate dilute solution
未添加金属离子的正常浓缩汁、悬浮浓缩汁静置至室温后,上层溶液的透光率分别为45%~50%、65%~70%,pH在5.6~5.7。产生凝聚物的浓缩汁静置后澄清度高于正常汁,原因是静置后凝聚物沉降,上层溶液变得澄清透明;正常汁始终保持稳定、均一的混浊态。由上图看出,Ca2+、Zn2+的加入使溶液澄清度明显增大,原因是加入Ca2+、Zn2+盐后,有明显凝聚物形成,静置后沉降,上层液体透光率增大,且随着添加量的增加,透光率小幅度增大,说明凝聚物沉降量增大。Mg2+加入产生的凝聚物形态明显小于Ca2+、Zn2+处理组,凝聚物相对细密,数量较少。但随着Mg2+含量的增加,凝聚物的形成更加明显,因此静置之后澄清度会增大。Fe2+的添加质量分数在0.005~0.010 g之间,有凝聚物形成,且形态更加细密,因此能够长时间不沉降,使得澄清度低于正常浓缩汁。当添加量增大到0.020 g时,明显有大量凝聚物形成,静置沉降,上部溶液的澄清度增大。由此得出金属离子是影响浓缩汁凝聚物形成的重要因素。
2.3 金属螯合剂的添加对悬浮浓缩汁的影响
处理组分4组,取3 g非正常浓缩汁,分别添加不等质量的柠檬酸、柠檬酸钠、EDTA-2Na、六偏磷酸钠。采用100 mL的95℃以上自来水稀释后,静置同样的时间,测定溶液的澄清度和pH。以不添加任何化合物的非正常浓缩汁采取同样的稀释条件作为对照组。添加质量以浓缩汁和稀释所用自来水的总质量来计,所添加的化合物在用高温自来水稀释前加入。
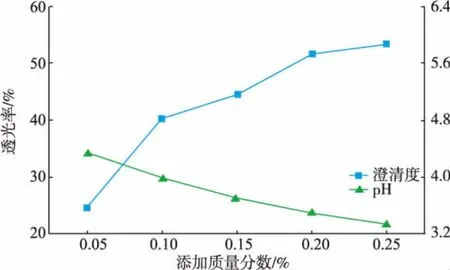
图3 柠檬酸对稀释液澄清度和pH的影响Fig.3 Influence of citric acid on the clarification and pH of dilute solution

图4 柠檬酸钠对稀释液澄清度和pH的影响Fig.4 Influence of sodium citrate on the clarification and pH of dilute solution
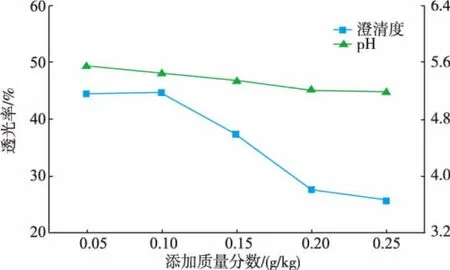
图5 乙二胺四乙酸二钠对稀释液澄清度和pH的影响Fig.5 Influenceofethylenediaminetetraaceticacid disodium on clarification and pH ofdilute solution
由图3、4、5、6比较可得,柠檬酸的添加对pH的影响最大,其次是柠檬酸钠和EDTA-2Na,随着六偏磷酸钠添加质量分数的增大,稀释液的pH变化最平缓且接近无任何添加剂的稀释液。虽然添加柠檬酸的稀释液的澄清度随着添加质量分数的增大而提高,但对凝聚物的形成没有明显抑制作用,且随着添加质量分数的增大,凝聚物沉降程度增大,使得上部溶液澄清度增大。添加柠檬酸钠的稀释液仍有较细密的凝聚物形成,静置后沉降下来的凝聚物较少,上部溶液澄清度较低。EDTA-2Na和六偏磷酸钠的加入均能明显抑制凝聚物的形成。二者虽然对凝聚物的形成均有抑制作用,随着添加量的增大,前者的澄清度降低,后者澄清度增大,原因可能是这2种物质对凝聚物的抑制机理不同。综合未添加任何物质的正常浓缩汁和悬浮浓缩汁同样处理后的澄清度与pH,保证添加质量分数尽可能小的条件下,以稀释后洋葱汁质量计,EDTA-2Na和六偏磷酸钠的最佳添加质量分数分别是0.1、3 g/kg。
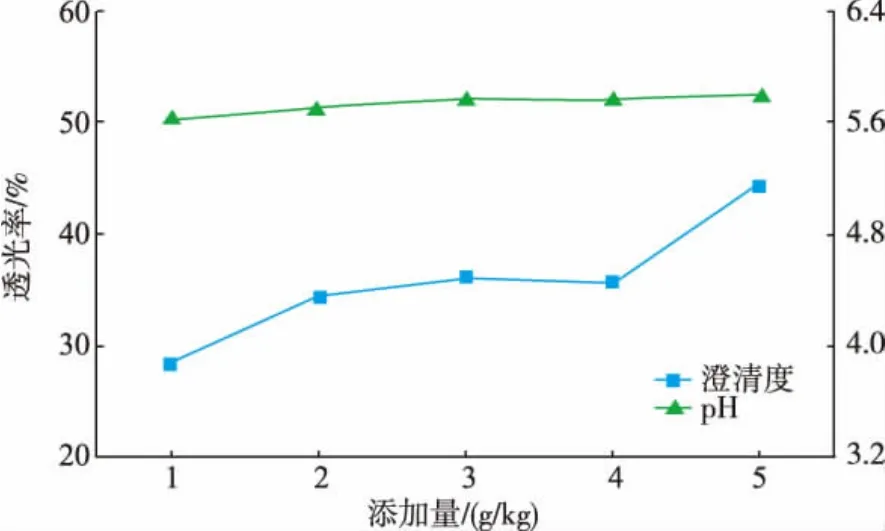
图6 六偏磷酸钠对稀释液澄清度和pH的影响Fig.6 Influence of sodium hexametaphosphate on the clarification and pH of dilute solution
EDTA-2Na、六偏磷酸钠均为金属螯合剂,且均为食品添加剂。洋葱浓缩汁样品中含有金属元素,且悬浮浓缩汁中所含的Fe、Zn、Ca、K的质量分数显著高于正常浓缩汁;向正常浓缩汁中添加选定的金属离子,高温自来水稀释后有凝聚物形成;向悬浮浓缩汁中添加金属螯合剂EDTA-2Na、六偏磷酸钠,同样稀释后均无明显的凝聚物形成。因此,可以推断洋葱浓缩汁高温稀释有凝聚物的形成与样品中所含金属离子有关。洋葱浓缩汁在加工过程中采用不锈钢与非金属设备,可以推断样品中金属元素来源于洋葱原料本身或是加工用水。
3 结 语
洋葱浓缩汁在高温稀释后会有凝聚物产生的原因与样品中所含的金属离子有关。金属螯合剂EDTA-2Na、六偏磷酸钠的添加对凝聚物的形成有一定的抑制作用。凝聚物的形成是否为金属离子与样品中的酚类物质、蛋白质、酮类化合物、还原糖等在高温下发生反应或是催化某些化学成分反应而产生的,还需要进一步验证。本研究为解决洋葱浓缩汁高温凝聚物的形成问题提供了参考。
[1]GUO Yuhua,LI Yujin,YIN Shiqiang.Advances on the research of onion food[J].China Condiment,2009,34 (11):35-37.(in Chinese)
[2]FENG Changgen,WU Wuxian,LIU Xia,etal.Research advancement of onion’s chemical ingredient and pharmaceutical action[J].Shanghai Journal of Traditional Chinese Medicine,2003,37(7):63-65.(in Chinese)
[3]CLARA C C,LUIS M,Rodriguez-Alcala,Javier Fontecha,et al.Effects of hypercholesterolemic diet enriched with onion as functional ingredient on fatty acid metabolism inWistar rats[J].Food Research International,2014,64:546-552.
[4]WANG Wenliang,WANG Shiqing,LI Xiaoling,et al.Research advancement on pharmacological effect and products development of onion[J].Food and Nutrition in China,2013,19(11):37-39.(in Chinese)
[5]SHEN Guohua,LIU Daqun,HE Shengmi,et al.Study on the technology of onion-garlic-ginger cream-like condiment[J].China Condiment,2007,7(7):52-56.(in Chinese)
[6]MU Jianlou,YUAN Sheqiang,LI Jiangqiang,et al.Study on processing technology of onion paste[J].China Condiment,2007,7(7):52-56.(in Chinese)
[7]JIANG Chengying,GUO Hongwen,JIANG Jie,et al.Study on fermentation technology of onion and glutinous rice wine[J].China Condiment,2008(8):65-66.(in Chinese)
[8]GE Yiqiang,YI Yuanying,ZHANG Zhenhua,et al.Research and development of three traditional flavourings of ginger,garlic and onion[J].Food and Fermentation Industries,2003,29(7):59-64.(in Chinese)
[9]HUANG Fenghua,YU Zeyuan,LI Xingguo,et al.A summary of the common quality problems in the apple syrup[J].China Fruit&Vegetable,2005(5):41-42.(in Chinese)
[10]XU Huiyan,SUN Xiaodong,ZHANG Peijun,et al.Determination of total polyphenols of Chinese jujube juice by folin-ciocaileu method[J].Food Research and Development,2009,30(3):126-128.(in Chinese)
[11]WANG Zhenbin,MA Haile,ZHONG Huihui,et al.Mechanism of the haze formation of clarified compound juice of strawberry and carrot[J].Transactions of the CSAE,2007,23(6):246-251.(in Chinese)
[12]YUN Haili,LEI Ni,LU Min.Spectrophotometric determination of total flavones in root of kudzu vine[J].PTCA(PARTB:CHEM.ANAL),2014,50(1):80-82.(in Chinese)
[13]曹建康,姜微波,赵玉梅.果蔬采后生理生化实验指导[M].北京:中国轻工业出版社,2007:60-62.
[14]Ahemaitijiang Ahaiti,XING Jun,LIU Jun,et al.Inprovement in processing technology of pomegranate drink—Determination on the clarity of pomegranate drink by spectrophotometry[J].Journal of Xinjiang University (Natural Science Edition),2004(1):411-413.(in Chinese)
[15]唐滢.蜂蜜非酒精发酵饮料的研制[D].福州:福建农林大学,2012:59-60.
[16]FANG Zhongxiang,ZHANG Min,TAO Guangjun,et al.Chemical composition of clarified bayberry(Myrica rubra Sieb.et Zucc.)juice sediment[J].Journal of Agricultural and Food Chemistry,2006,54:7710-7716.
[17]孙英.优质胡萝卜浓缩汁加工关键技术研究[D].北京:中国农业大学,2005:41-42.
[18]BOUBA A A,NJINTANG N Y,NKOUAM G B,et al.Desorption isotherms,net isosteric heat and the effect of temperature and water activity on the antioxidant activity of two varieties of onion (Allium cepa L)[J].International Journal of Food Science and Technology,2014,49:444-452.
[19]MYANG H I,YONG S P,HANNA L,et al.The thermostability,bioactive compounds and antioxidant activity of some vegetables subjected to different durations of boiling:Investigation in vitro[J].LWT-Food Science and Technology,2011,44(1):92-99.
[20]NAGEL B.Continuous production of high quality natural cloudy apple juice[J].Fruit Processing,1992,1:2.
[21]BECERIDGE T,HARRISON J E.Detectionof filter media derived haze in apple juice concentrate[J].Food Research International,1996,5:577-583.
[22]QI Qinghua,CAI Tongyi,WANG Fang,et al.Morphological analysis of the second haze in concentrated apple juice[J].Transactions of the CSAE,2007,23(12):247-250.(in Chinese)
[23]EDUVIGIS R,CONCEPCION S M,BEGONA de Ancos,et al.Characterisation of onion (Allium cepa L.) by-products as food ingredients with antioxidant and antibrowning properties[J].Food Chemistry,2008,108(3):907-916.
[24]LI Jinwei,WANG Liang,FAN Liuping.Study on nutritional composition of three cultivars of onion[J].Science and Technology of Food Industry,2010,31(5):345-347.(in Chinese)
[25]KAVITA S,EUN Y K,AWRARIS D A,et al.Temperature-dependent studies on the total phenolics,flavonoids,antioxidant activities,and sugar content in six onion varieties[J].Journal of Food and Drug Analysis,2015,23(2):243-252.
[26]F.JavierMoreno,Marta Corzo-Martinze,M.Dolores del Castillo,et al.Changes in antioxidant activity of dehydrated onion and garlic during storage[J].Food Research International,2006,39(8):891-897.

