离子液体环境下淀粉的酶法疏水化改性
袁久刚 , 向中林 , 范雪荣 , 王 强 , 姚金龙 , 唐文君 , 于拥军
(1.江苏联发纺织股份有限公司,江苏 海安226600;2.江苏省生态染整技术重点实验室,江苏 海安 226600;3.江南大学 纺织服装学院,江苏 无锡214122)
淀粉是一种来源丰富、生物可降解的天然高分子多聚物。但是原淀粉只具有单一的亲水性,在用作某些特殊工业材料,如合成纤维上浆剂、食品稳定剂、污水吸附剂以及包装材料时,原淀粉这种亲水性过强的缺点就暴露无疑,大大限制了其应用。因此,要想提高其应用性能,仍然需要对其进行疏水化改性。目前淀粉的改性主要是在淀粉主链上引入一些具有疏水性质的基团,如长链烷基脂肪酸[1]、烯基琥珀酸基团[2]以及一些可降解的环状内酯单体,如己内酯[3],从而使淀粉具有乳化、增溶、吸附以及可塑性等优良性能。
采用脂肪酶进行生物催化淀粉接枝是目前国内外研究的一个新方向。与普通化学法相比,脂肪酶催化接枝具有效率高、反应条件温和以及无重金属离子残留等优点;此外,脂肪酶在催化过程中还可以避免酸试剂加入对淀粉大分子降解的影响[4-6]。但是,采用脂肪酶进行淀粉催化酯化反应需在无水以及微水环境中进行,例如:2008年,赵秀娟等[7]用脂肪酶Lipozyme TLIM在无溶剂体系中催化合成硬脂酸大米淀粉酯,并优化工艺条件,获得取代度最大为0.218 8。Rajan等[8]在DMSO/DMF有机溶剂的反应体系中,以脂肪酶为催化剂催化了木薯淀粉和棕榈酸的合成反应,通过皂化法测得取代度为1.05。陈凤[9]在有机溶剂DMSO中,用Novozym 435催化羟乙基淀粉接枝丙交酯,研究了不同反应条件下的接枝质量比,得到最大值为52%。随着酶在多种不同溶剂体系中的研究进展,研究者们发现了很多问题,比如有机溶剂造成的环境污染,以及如何做到既能很好的溶解底物又能保持较高的酶活性等。所以,寻找一种新型的绿色反应介质来替代传统挥发性有机溶剂,逐渐成为研究者关注的新方向。
早在2003年Sheldon[10]及其同事就对离子液体中的脂肪酶催化进行了研究,结果表明脂肪酶在某些离子液体,如1-丁基-3-甲基咪唑六氟磷酸盐([BMIM]PF6)和1-乙基-3-甲基咪唑四氟硼酸盐([EMIM]BF4)中具有与在有机溶剂中一样的催化活性。Chen Z G等[11]研究表明,脂肪酶在离子液体中催化魔芋甘聚糖酰化反应时比在叔丁醇中的活性和稳定性还高;此外,Lu X X等[12]还发现部分混合离子液体对淀粉具有更好的溶解能力,可以显著提高淀粉的接枝率。与有机溶剂相比,离子液体是完全由离子组成的室温熔融盐,还具有无毒、蒸汽压低,不易燃,耐高温、化学性质稳定以及回收方便等特点[13],因此,这使其成为生物酶催化的理想非水反应介质。
本课题拟以离子液体为反应介质,通过非水相体系下的脂肪酶催化酯化反应,将月桂酸接枝到淀粉大分子上,从而实现对淀粉的疏水化改性,改善淀粉的应用性能。
1 材料与方法
1.1 实验材料
普通玉米淀粉(食品级),大庆展华生化科技有限公司产品;脂肪酶Novozym 435(工业级,酶活:16 000 NHU/g),诺维信有限公司产品;月桂酸(分析纯),国药集团化学试剂有限公司产品;离子液体(工业级),河南丽华制药有限公司产品;其他化学试剂均购自国药集团化学试剂有限公司,分析纯级。
1.2 实验仪器
Rapid振荡水浴锅,厦门瑞比公司产品;DZF-6050真空干燥箱,郑州南北仪器设备有限公司产品;NDJ-79旋转粘度计,上海昌吉地质仪器有限公司产品;NICOLET iS10 FT-IR傅立叶红外分析仪,Thermo Fisher公司产品;SU1510扫描电子显微镜,日本日立株式会社产品;Q200差示扫描量热仪,美国TA仪器公司产品。
1.3 实验方法
1.3.1 再生淀粉的制备 称取1 g烘干淀粉,在120℃恒温加热搅拌下,分批加入到1-丁基-3-甲基咪唑氯盐([BMIM]Cl)中,直至完全溶解,待溶液冷却后加入无水乙醇进行离心,沉淀于40℃真空干燥,得到再生淀粉。
1.3.2 月桂酸淀粉酯的制备 将再生淀粉与离子液体([BMIM]BF4或者[BMIM]PF6)混合均匀后,依次加入月桂酸 (月桂酸/AGU摩尔比3∶1)、脂肪酶200 mg,充氮气后密封,于60℃条件下,恒温反应4 h。反应结束后,先加入甲醇过滤去除酶,再利用10倍甲醇多次洗涤、离心,去除上清液,得到的沉淀在40℃下真空干燥。
1.3.3 取代度测定 采用酸碱滴定方法进行测定,具体操作方法按照参考文献[12]所述步骤进行。
1.3.4 红外测试 称取约2 mg样品与KBr粉末混匀后放置在压片机上,制成透明薄片。先采集背景,然后测试,扫描次数32次,扫描范围500~4 000 cm-1,分辨率8 cm-1。
1.3.5 电镜分析 将淀粉颗粒用双面胶固定在塑料薄膜上,表面喷金后,采用SU1510扫描电镜进行测试,电压5 kV,放大倍数1 000~2 000倍。
1.3.6 粘度、透光率的测定 分别称取一定量的淀粉样品,配制质量浓度为10 g/L的溶液,于95℃加热搅拌使其完全糊化,然后在该温度下利用粘度仪测其粘度,冷却至室温后,于波长580 nm处测定透光率。
1.3.7 接触角测量 称取1 g淀粉样品,在压片机上压制成膜,然后放在载玻片上,利用接触角测量仪上进行水滴接触角测量,每个样品测试5次,最后取平均值。
1.3.8 DSC分析 称取5 mg干燥样品放入坩埚中,加盖后卷边压紧,设置温度为20~200℃,升温速率10℃/min,开始升温测试。
2 结果与讨论
2.1 溶剂体系对月桂酸淀粉酯取代度的影响
脂肪酶催化酯类的合成通常需要无水或微水环境,溶剂的亲疏水性质、脂肪酶以及底物在不同的溶剂体系中溶解或分散状态都会直接影响酶的催化活性。本文中分别选取了常见的几种非水介质:无溶剂、丙酮以及2种离子液体[BMIM]BF4和[BMIM]PF6用于脂肪酶催化反应。对不同反应体系得到的接枝淀粉进行取代度测试,结果如图1所示。
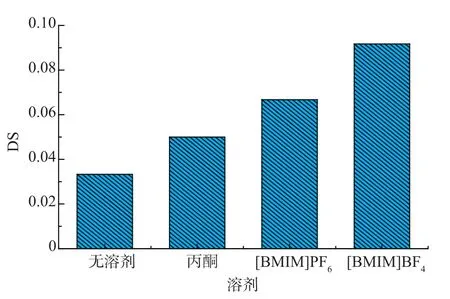
图1 溶剂体系对月桂酸淀粉酯取代度的影响Fig.1 Effect of solvent systems on DS values of laurate starch
如图1所示,在所选的4种非水相体系中,脂肪酶均能催化月桂酸对淀粉进行接枝。其中,在离子液体中表现出最好的催化能力,其产物取代度最高。这是因为离子液体对底物的溶解性比丙酮以及无溶剂系统都要好,而且亲水性的[BMIM]BF4离子液体又比疏水性的 [BMIM]PF6离子液体效果更显著。通过以上对比,可以看出对淀粉有一定溶解能力的 [BMIM]BF4离子液体比较适合作为Novozym 435脂肪酶催化月桂酸接枝淀粉的反应介质。
2.2 红外分析
对原淀粉、再生淀粉以及在 [BMIM]BF4和[BMIM]PF6中合成的月桂酸淀粉酯分别进行红外分析,结果如图2所示。

图2 红外光谱分析Fig.2 IR analysis
从图2可以看出再生淀粉(b)与原淀粉(a)红外吸收峰基本相同,其中位于3 398 cm-1和2 927 cm-1处分别对应的是-OH以及-CH的伸缩振动峰。另外,在1 083、1 058 cm-1和1 021 cm-1指纹区出现的吸收峰为淀粉颗粒中葡萄糖苷基AGU的C-O伸缩振动吸收峰。与原淀粉相比,月桂酸接枝淀粉除了具有淀粉葡萄糖苷基AGU的结构特征峰外,还在1 726 cm-1出现了明显的C=O伸缩振动吸收峰,这是酯键的特征吸收峰,这充分表明淀粉分子链中的葡萄糖苷基AGU上部分-OH发生了取代反应,通过脂肪酶的酯化在其羟基上成功引入了月桂酸酯基团。
2.3 接枝淀粉的疏水性能
对原淀粉、再生淀粉和不同取代度接枝淀粉的水滴润湿接触角分别进行测定,结果如表1所示。
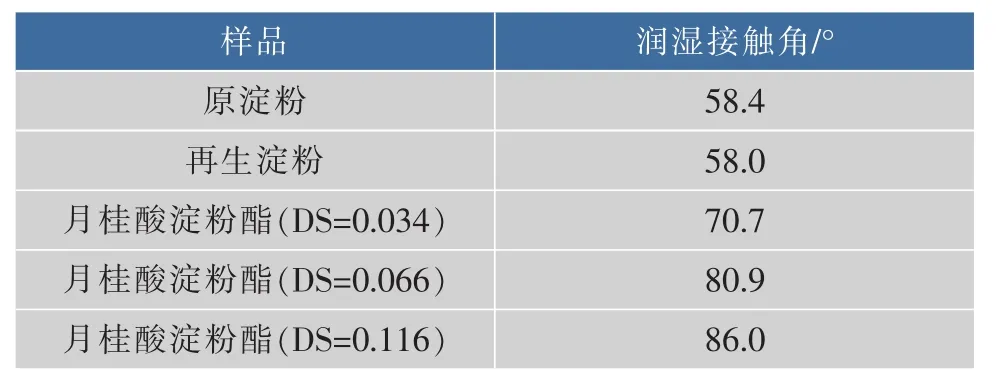
表1 水滴润湿接触角分析Table 1 Water contact angle analysis
从表1可以看出,与原淀粉相比,再生淀粉的水滴润湿接触角略有降低,这是因为经过溶解后淀粉颗粒遭到破坏,其亲水性变好。经月桂酸接枝改性后的淀粉,其水滴润湿接触角明显增大,而且随着取代度的增加,接触角增加越显著。这说明淀粉分子上的羟基被长碳链脂肪酸单体取代越多,接枝淀粉的疏水性就越高。
2.4 接枝淀粉的耐热性能
分别对原淀粉、再生淀粉和接枝淀粉进行DSC测试,结果如图3所示。
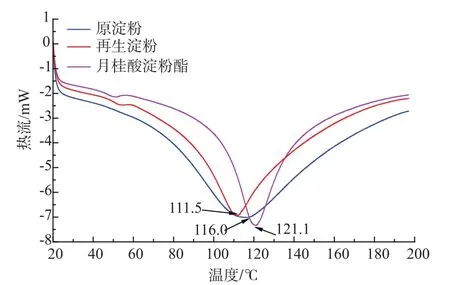
图3DSC分析Fig.3 DSC analysis of starch, regenerated starch,laurate starch
从图3可以看出,3种样品均在110~125℃出现了一个熔融吸热峰,这是升温过程中,淀粉颗粒转变为糊化状态所引起。相对于原淀粉,再生淀粉的吸热峰温度降低,这是因为淀粉颗粒在溶解过程中遭到了破坏(见图4),而接枝淀粉的吸热峰值温度升高,这是由于接枝过程中疏水性基团的引入,使得淀粉大分子链上的羟基被取代,淀粉的吸水性能降低所致。
2.5 接枝淀粉粘度和透光率变化
对原淀粉和接枝淀粉分别糊化后的粘度和透光率进行测定,结果如表2所示。
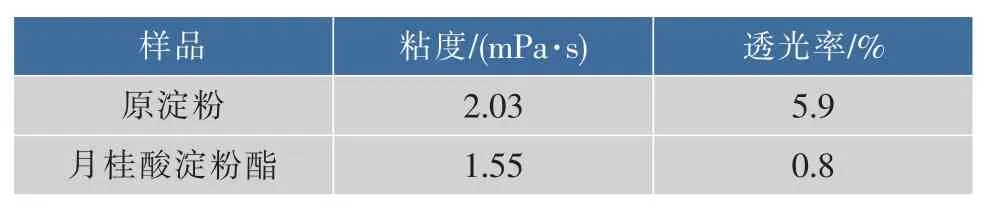
表2 原淀粉和改性淀粉粘度、透光率Table2 Viscosity and transmittanceofstarch and modified starch
从表2可以看出:经糊化后的接枝淀粉,其粘度和透光率都比原淀粉有所降低,这是因为,月桂酸的引入会使原来淀粉分子之间较强的氢键作用减弱,淀粉大分子链变得松弛,因此,糊化后粘度会降低。此外,由于接枝淀粉的疏水性增强,导致淀粉分子和水结合比较困难,光线在经过时反射和透射强度均减弱,从而导致接枝淀粉的透光率降低。
2.6 接枝淀粉的表观形貌
分别对原淀粉、再生淀粉和接枝淀粉进行扫描电镜测试,结果如图4所示。

图4 原淀粉,再生淀粉和接枝淀粉的扫描电镜图Fig.4 SEM photos of starch,regenerated starch and modified starch
从图4中可以看出,原淀粉是由许多光滑的球形颗粒组成,大小不同但形状规则。而经过[BMIM]Cl溶解之后得到的再生淀粉,其颗粒形状已经被完全破坏,这是由于淀粉分子经过溶解再生,其晶区被破坏,所以分子之间变得松散。接枝淀粉的形貌与再生淀粉相似,但接枝淀粉由于疏水性基团的引入使其分子间变得更为松散,呈现出不规则片状结构。
3 结 语
根据以上研究可以看出,相比于传统的非水相体系,脂肪酶在离子液体中具有更高的催化活性,而且在亲水性的[BMIM]BF4离子液体中得到产物取代度更高。当淀粉上的羟基被月桂酸取代后,其疏水性快速增加,导致淀粉糊化变难,但是由于月桂酸的引入,使得大分子间的氢键作用减弱,因此糊化后淀粉粘度下降。同时,月桂酸的引入也导致大分子链变得松弛,淀粉颗粒呈现出不规则的片状结构。
[1]WANG Yan,XIN Jiaying,WU Wenlong.The properties of enzymatic synthesis medium-long chain fatty acid esterification of starch[J].Journal of the Chinese Cereals and Oils Association,2015,30(4):11-17.(in Chinese)
[2]WANG X Y,LI X X,CHEN L,et al.Preparation and characterization of octenyl succinate starch as a delivery carrier for bioactive food components[J].Food Chemistry,2011,126(3):1218-1225.
[3]XU Ling,YANG Cheng,DUAN Bin,JIANG Chao.Synthesis of starch-grafted-polycaprolactone copolymer with lipase as catalyze[J].Polymer Materials Science and Engineering,2009,25(7):34-37.(in Chinese)
[4]QIAO L,GU Q M,CHENG H N.Enzyme-catalyzed synthesis of hydrophobically modified starch[J].Carbohydrate Polymers,2006,66(1):135-140.
[5]XU J,ZHOU C W,WANG R Z,et al.Lipase-coupling esterification of starch with octenyl succinic anhydride[J].Carbohydrate Polymers,2012,87(3):2137-2144.
[6]HORCHANI H,CHAABOUNI M,GARGOURI Y,et al.Solvent-free lipase-catalyzed synthesis of long-chain starch esters using microwave heating:optimization by response surface methodology[J].Carbohydrate Polymers,2010,79(2):466-474.
[7]ZHAO Xiujuan,YU Guoping.Study on synthesis of stearate starch by using immobilized lipase[J].Journal of Northeast Agricultural University,2008,39(10):89-93.(in Chinese)
[8]RAJAN A,SUDHA J D,ABRAHAM T E.Enzymatic modification of cassava starch by fungal lipase[J].Industrial Crops and Products,2008,27(1):50-59.
[9]CHEN Feng,YANG Cheng.Synthesis of hydroxyethyl starch lactide graft polymer by enzyme catalysis[J].Applied Chemical Industry,2009,38(8):1109-1111.(in Chinese)
[10]RANTWIJK F V,LAU R M,SHELDON R A.Biocatalytic transformations in ionic liquids[J].Trends in Biotechnology,2003,21(3):131-138.
[11]CHEN Z G,ZONG M H,LI G J.Lipase-catalyzed acylation of konjacglucomannan in ionic liquids[J].Journal of Chemical Technology and Biotechnology,2006(81):1225-1231.
[12]LU X X,LUO Z G,YU S J,et al.Lipase-catalyzed synthesis of starch palmitate in mixed ionic liquids[J].Journal of Agricultural and Food Chemistry,2012,60(36):9273-9279.
[13]HOLBERY J D,SEDDON K R.Ionic liquids[J].Clean Products and Processes,1999,1(4):223-236.

