新型环氧化物水解酶AuEH1的表达及酶学性质
李兴倩, 胡 蝶, 黄博梅, 李雪婷, 康雁君, 邬敏辰*
(1.江南大学 药学院,江苏 无锡 214122;2.江南大学 生物工程学院,江苏 无锡 214122;3.江南大学 无锡医学院,江苏 无锡 214122)
对映纯环氧化物是一类合成手性终产物的砌块,在医药、农药和香料等领域有重要的应用价值[1]。 如手性苯基-2,3-环氧酸乙酯和 (S)-芳基缩水甘油醚可分别用于紫杉醇和阿替洛尔的合成[2];(S)-环氧苯乙烷 (styrene oxide,SO)可用于抗艾滋病药物 (-)-hyperolactone C和左咪唑 (Levamisole,一种杀线虫和抗癌药物)的合成[3-4]。与化学法相比,生物法制备手性环氧化物具有对映选择性高、反应条件温和及对环境友好等特点[5],它又可分为合成法和拆分法,前者采用氧化还原酶不对称环氧化前手性烯烃,而后者利用环氧化物水解酶拆分外消旋环氧化物。两者相比,生物拆分法不需要金属离子和辅酶,工艺较简单[6]。
环氧化物水解酶 (epoxide hydrolase,EH,EC 3.3.2.3)能特异性水解环氧化物生成相应的邻二醇及保留某一对映体[7]。从微生物获取EHs,不仅来源广泛、易通过发酵法大量获得,且具有底物谱广、对映选择性高等特点[8-10]。近年来利用微生物EHs水解拆分外消旋环氧化物以获取环氧化物或邻二醇单一对映体已成为研究热点。Lee等[11]克隆和表达了粘红酵母 (Rhodotorula glutinis)EH编码基因,并利用在胞内表达RgEH的重组毕赤酵母细胞水解拆分 (R,S)-SO,所获 (S)-SO 的产率和对映体过量 (enantiomeric excess,e.e.)值分别为 36%和>98%。Woo等[12]将源自 Novosphingobium aromaticivorans的EH基因在大肠杆菌中表达并纯化了表达产物NEH,利用 NEH优先水解 (R)-SO的特性,拆分(R,S)-SO制备 (S)-SO, 其产率和e.e.值分别为11.7%和>99%。本文作者选取实验室保藏的A.usamii E001作为Aueh1供体菌株,RT-PCR扩增Aueh1,将其在大肠杆菌BL21中表达。分析重组AuEH1(reAuEH1)的酶学性质并利用其水解拆分 (R,S)-SO制备手性化合物 (S)-SO。
1 材料与方法
1.1 菌株、质粒和培养基
宇佐美曲霉 (A.usamii)E001菌株由作者所在实验室保藏;大肠杆菌 (E.coli)JM109、BL21(DE3)和表达质粒 pET-28a(+),购自 Novagen公司;克隆质粒pUCm-T,购自上海Sangon公司。A.usamii培养基:10 g/L胰蛋白胨、5 g/L酵母提取物、20 g/L葡萄糖、5 g/L (NH4)2SO4和 1 g/L (R,S)-SO,pH 6.0;LB培养基:10 g/L胰蛋白胨、5 g/L酵母提取物和10 g/L NaCl,pH 7.2。
1.2 主要试剂和仪器
总RNA抽提试剂盒和DNA胶回收试剂盒,购自上海Sangon公司;RNA PCR试剂盒、rTaq DNA聚合酶、DNA Marker、限制性内切酶、T4 DNA连接酶和蛋白质Marker均购自大连TaKaRa公司;(R,S)-SO和 (S)-SO, 购自上海萨恩化学技术公司。GC-2010气相色谱仪,日本Shimadzu公司产品;CYCLOSIL-B手性气相色谱柱 (30 m×0.25 mm×0.25 μm),美国 Agilent科技公司产品。
1.3 PCR引物的设计
A.usamii属于黑曲霉 (Aspergillus niger)的一个变种,它们有高度一致的基因组序列,如β-甘露聚糖酶基因的同源性>99%[13-14]。据此,参照NCBI公布的A.niger M200 EH编码基因序列,设计一对扩增Aueh1的PCR引物。
Aueh1-F:5′-CATATGTCTGCTCCGTTCGGCAA G-3′,下划线部分为NdeⅠ酶切位点;
Aueh1-R:5′-GCGGCCGCCTACTTCTGCCACA CCTGCTC-3′,下划线部分为NotⅠ酶切位点。
1.4 AuEH1编码基因Aueh1的克隆
挑取A.usamii单菌落接种于30 mL培养基中,30℃、220 r/min培养36 h,离心收集菌体,按照总RNA抽提试剂盒说明书提取A.usamii总RNA。以RNA为模板、Oligo dT-Adaptor Primer为引物,逆转录合成cDNA第一链;以该链为模板、Aueh1-F和M13 Primer M4为引物,进行第一轮PCR:94℃3 min,30 个循环 (94 ℃ 30 s,51 ℃ 30 s,72 ℃ 90 s),72℃10 min;以第一轮PCR产物为模板、Aueh1-F和Aueh1-R为引物,进行第二轮PCR:94℃ 3 min,30 个循环 (94 ℃ 30 s,56 ℃ 30 s,72 ℃ 75 s),72 ℃10 min。PCR产物经琼脂糖凝胶电泳分析、割胶回收目的条带,与pUCm-T连接,转化E.coli JM109。经蓝白斑筛选和酶切鉴定正确后,送上海Sangon公司测序。测序正确的重组质粒命名为pUCm-T-Aueh1。
1.5 Aueh1在大肠杆菌中的表达
选用 NdeⅠ和 NotⅠ双酶切 pUCm-T-Aueh1,割胶回收Aueh1,与经同样酶切的pET-28a(+)连接,获重组表达质粒pET-28a-Aueh1,转化E.coli BL21(DE3)。卡那霉素LB平板筛选阳性转化子,送上海Sangon公司测序。测序正确的转化子 (即基因工程菌)命名为E.coli/Aueh1,不含目的基因的pET-28a(+)转化子命名为E.coli/pET(空白对照)。参照余涛等[15]的方法,在IPTG终浓度0.15 mmol/L、18℃诱导表达reAuEH1。100 mL诱导发酵液经8 000 r/min离心收集菌体,用10 mL磷酸钾缓冲液(20 mmol/L,pH 6.8) 悬浮,超声波破碎细胞,收集上清作为reAuEH1酶液。采用SDS-PAGE分析重组表达产物。
1.6 气相色谱分析及计算
样品分析采用气相色谱仪GC-2010、手性气相色谱柱CYCLOSIL-B和氢火焰离子化检测器。进样口和检测器温度均为250℃;初始柱温100℃,以5℃/min升温至210℃;载气氮气,流量3.0 mL/min,分流比1∶50。 在此检测条件下,正己醇、(R)-SO 和(S)-SO 的 保 留 时 间 分 别 为 3.837、6.433 min 和6.553 min。
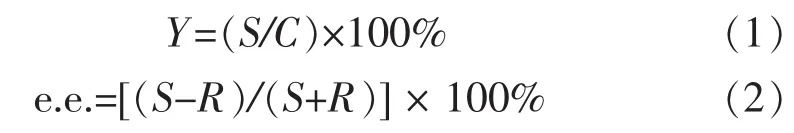
其中:Y代表 (S)-SO的摩尔产率,S和R分别代表(S)-SO 和 (R)-SO 的最终摩尔浓度,C 代表 (R,S)-SO的初始摩尔浓度。
1.7 EH活性的测定
在 1.5 mL EP 管中加入 100 μL (R,S)-SO 溶液 (200 mmol/L)和 800 μL磷酸钾缓冲液 (50 mmol/L,pH 6.8),35 ℃预热 5 min; 加入 100 μL 适当稀释的reAuEH1酶液,准确反应10 min。取400 μL反应液加入800 μL乙酸乙酯 (含5 mmol/L正己醇作内标),激烈振荡,8 000 r/min离心5 min,吸取上层有机相,无水MgSO4干燥,过0.22 μm有机膜,按1.6方法进行气相色谱分析。在上述测定条件下,每分钟水解 1 μmol(R,S)-SO 所需的酶量定义为1个EH活性单位 (U)。
1.8 reAuEH1酶学性质的分析
1.8.1 温度对酶活性的影响 在20~50℃下按1.7方法测定酶活性。最适温度定义为最高酶活性(100%相对酶活性)所对应的温度。将酶液置于20~45℃下保温1.0 h,按1.7方法测定残余酶活性。以未保温酶液 (100%相对酶活性)为对照,残余酶活性在85%以上定义为热稳定。
1.8.2 pH对酶活性的影响 在pH 6~9下按1.7方法测定酶活性。最适pH定义为最高酶活性所对应的pH值。将酶液在 pH 3~10、25℃处理1.0 h,按1.7方法测定残余酶活性。残余酶活性在85%以上定义为pH稳定。
1.8.3 金属离子和EDTA对酶活性的影响 将酶液分别与不同金属离子及EDTA溶液 (终浓度1.0 mmol/L)混合,25℃处理1.0 h,按1.7方法测定残余酶活性。对照以缓冲液取代金属离子或EDTA。
1.9 reAuEH1水解拆分 (R,S)-SO 在 10 mL EP管中分别加入 0.6 mL (R,S)-SO (200 mmol/L)、4.8 mL磷酸钾缓冲液 (50 mmol/L,pH 6.5)和 4.8 U reAuEH1(终体积6 mL),35℃进行水解拆分反应,分别在 20、40、50、60 min 和 80 min 取样。 反应液按1.7方法进行处理,并按1.6方法进行色谱分析及计算 (S)-SO摩尔产率和e.e.值。
2 结果与分析
2.1 AuEH1编码基因Aueh1的克隆及分析
以A.usamii总RNA逆转录合成的第一链cDNA为模板,第一轮PCR获得约1 400 bp的产物(图1泳道1);再以纯化的第一轮PCR产物为模板,第二轮PCR获得约1 200 bp的目的基因Aueh1(图1泳道2)。将Aueh1与pUCm-T连接,获重组质粒pUCm-T-Aueh1。测序结果显示,Aueh1全长1 197 bp,编码398个氨基酸,所获Aueh1序列递交至GenBank数据库,登录号为KP249712。BLAST server同源序列搜寻 (http://www.ncbi.nlm.nih.gov/)和DNAMAN 6.0同源序列比对结果显示,Aueh1与A.niger (DQ458230)、A.niger (AJ238460)、A.oryzae RIB40 (XM_001818259)、A.flavus NRRL3357(XM_002373494) 和 A.clavatus NRRL (XM_00127 0913)EHs编码基因的序列同源性分别为 87.6、87.4、64.8、64.7和63.6%,表明本研究克隆的Aueh1是一种新型的EH编码基因。
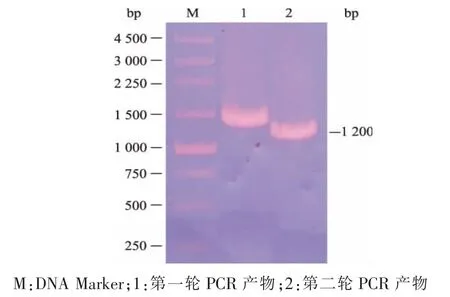
图1 PCR产物的琼脂糖凝胶电泳分析Fig.1 Analysis of the PCR products by agarose gel electrophoresis
2.2 Aueh1在E.coli BL21(DE3)中的表达
将E.coli/Aueh1和E.coli/pET按1.5方法进行诱导表达。SDS-PAGE分析结果显示,E.coli/Aueh1全细胞及其破碎上清液约在44.3×103处有特异性目的条带 (图2泳道2—3),E.coli/pET在该处无特异性条带 (图2泳道1)。另外,E.coli/Aueh1细胞破碎沉淀在该处也无条带 (图 2泳道 4),表明reAuEH1在E.coli BL21胞内实现了可溶性表达。按1.7方法测得reAuEH1酶液的活性为8.12 U/mL。
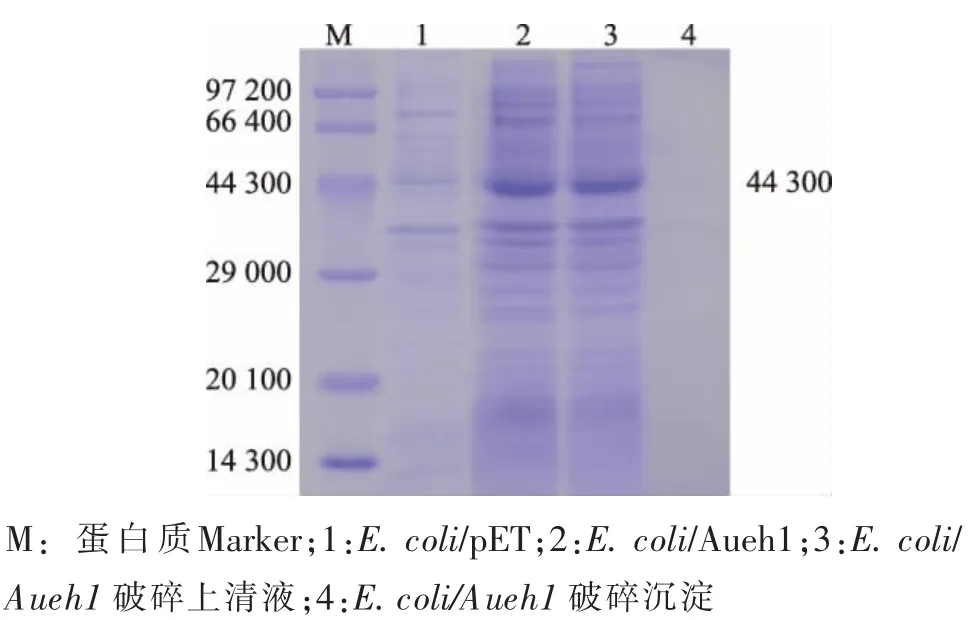
图2 重组大肠杆菌表达产物的SDS-PAGE分析Fig.2 Analysis of the products expressed in recombinant E.coli by SDS-PAGE
2.3 reAuEH1酶学性质的分析
2.3.1 最适温度及温度稳定性 按1.8.1方法分析了温度对reAuEH1活性的影响 (图3)。该酶的最适温度为40℃,在30~45℃范围内催化活性较高,20℃和50℃的相对酶活性分别为64%和55%。同时,reAuEH1在20~40℃保温1.0 h,残余酶活性均在85%以上,当温度超过40℃,酶活性快速下降,表明reAuEH1属于中温酶。
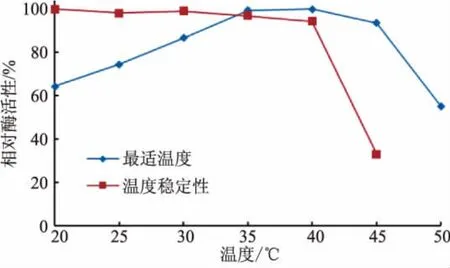
图3 reAuEH1的最适温度及温度稳定性Fig.3 Temperature optimum and stability of reAuEH1
2.3.2 最适pH及pH稳定性 按1.8.2方法分析了pH对reAuEH1活性的影响 (图4)。该酶的最适pH为6.5,pH 9.0的相对酶活性仅为19%,表明该酶属于中性酶。同时,reAuEH1在pH 5~9处理1.0 h,残余酶活性均在85%以上。
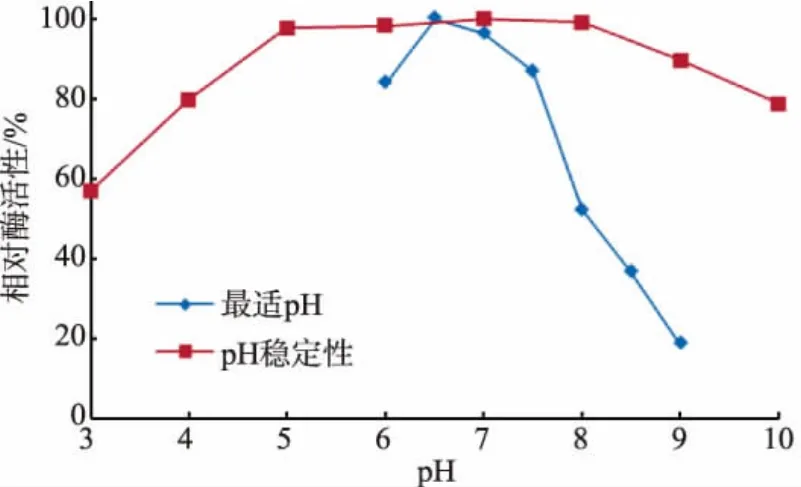
图4reAuEH1的最适pH及pH稳定性Fig.4 pH optimum and stability of reAuEH1
2.3.3 金属离子及EDTA的影响 按1.8.3方法测定了金属离子及EDTA对reAuEH1活性的影响(图5)。Ag+和Cu2+对该酶活性的抑制作用较大,残余酶活性分别仅为54%和44%,其它金属离子及EDTA对酶活性的影响不大。
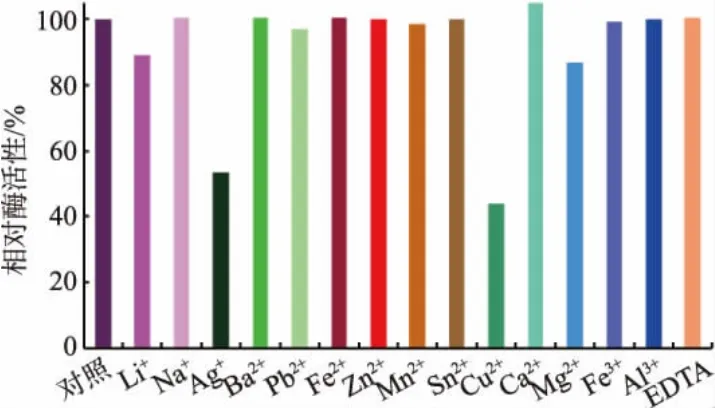
图5 金属离子及EDTA对reAuEH1活性的影响Fig.5 Effects of various metal ions and EDTA on the activity of reAuEH1
2.4 reAuEH1 水解拆分 (R,S)-SO
按1.9方法提供的反应条件,利用reAuEH1对(R,S)-SO 进行对映选择性拆分制备 (S)-SO,并按1.6方法分析及计算 (S)-SO的产率和e.e.值随反应时间的变化值 (图6)。reAuEH1优先水解 (R)-SO,在20 min内 (R)-SO的摩尔浓度迅速下降,(S)-SO 的 e.e.值快速上升;当反应至 50 min,(S)-SO的产率为30.8%、e.e.值>99%;延长反应时间,(S)-SO摩尔浓度缓慢降低,导致 (S)-SO的产率下降。Lee等[11]利用在胞内表达粘红酵母EH(RgEH)的重组毕赤酵母细胞拆分 (R,S)-SO,所获 (S)-SO的产率为 36%、e.e.值>98%。Woo等[16]利用 Gordonia sp.H37 全细胞水解 (R,S)-SO,所获 (S)-SO 的产率为 23.9%、e.e.值>99.9%。
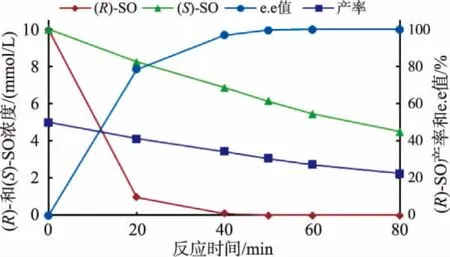
图6 反应时间对reAuEH1水解拆分 (R,S)-SO的影响Fig.6 Effect of reaction time on the hydrolytic resolution of(R,S)-SO by reAuEH1
3 结语
本研究运用RT-PCR技术从A.usamii E001中克隆了一种新型EH的编码基因Aueh1,并将该基因在E.coli BL21(DE3)中进行了表达。酶学性质分析表明,reAuEH1具有较高的催化活性、温和的反应条件、良好的温度和pH稳定性以及较高的对映选择性,且大多数金属离子及EDTA对该酶活性影响不大,所有这些特性使reAuEH1在水解拆分外消旋环氧化物制备高纯度手性环氧化物或邻二醇等方面有潜在的应用价值。本文作者利用reAuEH1拆分 (R,S)-SO 制备了 (S)-SO,其摩尔产率和 e.e.值分别为30.8%和>99%,但其底物谱和对映选择性机理等还有待于进一步研究。
[1]ZHAO Shuling,GU Yaohua,XUE Ping.Recent progress on chemo-enzymatic synthesis of chiral compounds with high stereoselectivity[J].Chemical Research and Application,2014,26(4):473-482.(in Chinese)
[2]ZHUANG Xiaojian,JIN Huoxi,HU Zhongce,et al.Research progress of microbial epoxide hydrolase[J].Biotechnology,2010,20(1):91-94.(in Chinese)
[3]HODGSON D M,MAN S.Synthesis of the anti-HIV agent(-)-hyperolactone C by using oxonium ylide formation-rearrangement[J].Chemistry:A European Journal,2011,17(35):9731-9737.
[4]LIU Z,MICHEL J,WANG Z,et al.Enantioselective hydrolysis of styrene oxide with the epoxide hydrolase of Sphingomonas sp.HXN-200[J].Tetrahedron:Asymmetry,2006,17(1):47-52.
[5]KOTIK M,STEPANEK V,KYSLIK P,et al.Cloning of an epoxide hydrolase-encoding gene from Aspergillus niger M200,overexpression in E.coli,and modification of activity and enantioselectivity of the enzyme by protein engineering[J].Journal of Biotechnology,2007,132:8-15.
[6]CHEN Lin,SHEN Honglei,ZHU Qing.Application of bioconvergence hydrolysis of epoxide hydrolase[J].Food and Fermentation Technology,2012,48(4):67-70.(in Chinese)
[7]WEIJERS C A G M,DE BONT J A M.Epoxide hydrolases from yeasts and other sources:versatile tools in biocatalysis[J].Journal of Molecular Catalysis B:Enzymatic,1999,6:199-214.
[8]BELOTI L L,COSTA B Z,TOLEDO M A S,et al.A novel and enantioselective epoxide hydrolase from Aspergillus brasiliensis CCT 1435:purification and characterization[J].Protein Expression and Purification,2013,91:175-183.
[9]JIN H X,LIU Z Q,HU Z C,et al.Production of(R)-epichlorohydrin from 1,3-dichloro-2-propanol by two-step biocatalysis using haloalcohol dehalogenase and epoxide hydrolase in two-phase system[J].Biochemical Engineering Journal,2013,74:1-7.
[10]NAUNDORF A,MELZER G,ARCHELAS A,et al.Influence of pH on the expression of a recombinant epoxide hydrolase in Aspergillus niger[J].Biotechnology Journal,2009,4:756-765.
[11]LEE E Y,YOO S S,KIM H S,et al.Production of(S)-styrene oxide by recombinant Pichia pastoris containing epoxide hydrolase from Rhodotorula glutinis[J].Enzyme and Microbial Technology,2004,35:624-631.
[12]WOO J H,KANG J H,KANG S G,et al.Cloning and characterization of an epoxide hydrolase from Novosphingobium aromaticivorans[J].Applied Microbiology and Biotechnology,2009,82(5):873-881.
[13]TANG C,GUO J,WU M,et al.Cloning and bioinformatics analysis of a novel acidophilic β-mannanase gene,Auman5A,from Aspergillus usamii YL-01-78[J].World Journal of Microbiology and Biotechnology,2011,27(12):2921-2929.
[14]LI J F,ZHAO S G,TANG C D,et al.Cloning and functional expression of an acidophilic β-mannanase gene (Anman5A) from Aspergillus niger LW-1 in Pichia pastoris[J].Journal of Agricultural and Food Chemistry,2012,60(3):765-773.
[15]YU Tao,HU Die,WU Minchen,et al.Enzymatic characterization and coenzyme regeneration of a recombinant glucose 1-dehydrogenase[J].Journal of Food Science and Biotechnology,2014,33(9):910-916.(in Chinese)
[16]WOO J H,KWON T H,KIM J T,et al.Identification and characterization of epoxide hydrolase activity of polycyclic aromatic hydrocarbon-degradingbacteriaforbiocatalyticresolutionofracemicstyreneoxideandstyreneoxidederivatives[J].Biotechnology Letters,2013,35:599-606.

