基于子宫瘢痕妊娠分型的治疗方案探讨
柯 玲 李志英 潘 敏 陈雪梅 邱 雁
广东省茂名市人民医院(52500)
基于子宫瘢痕妊娠分型的治疗方案探讨
柯 玲 李志英 潘 敏 陈雪梅 邱 雁
广东省茂名市人民医院(52500)
子宫瘢痕妊娠(CSP)是一种罕见且危险的异位妊娠,早期妊娠囊种植于原剖宫产子宫切口瘢痕处,孕囊周围被肌层和瘢痕组织所包围。CSP患者面临着子宫破裂、大出血、子宫切除的高风险,以及生育能力的丧失,甚至危及生命。据报道,剖宫产后CSP的发生率为6%左右,近年更有上升的趋势[1-2]。虽然2012年中华医学会发表了《剖宫产瘢痕妊娠诊断与治疗共识》[3],但尚无统一临床诊疗标准,而且具体诊疗方案仍需个体化,因此对医疗工作者提出了更多更高的要求。目前治疗CSP的方法主要分为药物治疗、腔镜术、介入手术和清宫术。本研究以本院收治的子宫瘢痕妊娠患者为研究对象,根据CSP分型,回顾性分析不同治疗方案的治疗效果。
1 对象与方法
1.1 研究对象
选取2014年1月-2015年12月本院收治的20例CSP患者为研究对象。一般资料如下:年龄24~43(37.6±4.8)岁;剖宫产史1.4±2.6(1~3)次;停经时间55.1±11.9(36~61)d,治疗前血清β?hCG水平为14 772±121(1713~19 964)U/L。纳入标准:所有入选对象均为诊断为CSP;均无严重精神类疾病;生命特征正常、血常规、凝血和肝肾功能正常;本研究经本院医学伦理委员会批准,所有患者均签署知情同意书。
1.2 诊断和分型标准
1.2.1 CSP诊断标准有停经、剖宫产史;宫颈正常、宫体增大与妊娠时间相一致;血清β?hCG阳性;子宫肌层肌线分界不清楚,孕囊或者包块与子宫下段肌层之间连续性中断,孕囊处于子宫前壁下段。1.2.2Alder分级标准按 Adler的半定量法[4]根据超声分级,0级,病灶内无血流;I级,少量血流,病灶内1~2点状或细棒状血管;II级,中量血流,可见3~4个点状血管或1条重要血管,其长度可接近或超过病灶半径;III级,丰富血流,见5个以上点状血管或2条较长血管。
1.2.3 CSP超声声像图特征分型标准[4]孕囊部分突入型:超声表现为宫腔下段见孕囊,孕囊下缘部分深入子宫下段前壁瘢痕处,此处前壁宫壁连续性消失。孕囊前肌层厚度为2.0~6.5mm;孕囊完全突入型:宫腔下段见孕囊,孕囊下缘部分深入子宫下段前壁瘢痕处,此处前壁宫壁连续性消失。孕囊前肌层厚度为0~5mm,甚至浆膜层向膀胱方向凸起;混合团块型:位于子宫下段瘢痕处的混合回声(呈囊实性)包块,有时呈类实性;包块向膀胱方向隆起,包块与膀胱间子宫肌层明显变薄甚至缺失,肌层厚度为0~5mm。
1.2.4分型步骤所有患者根据CSP的超声声像图特征[5]分为:孕囊部分突入型、孕囊完全突入型、混合团块型。一旦发现孕囊部分突入型,应经阴道超声检查仔细观察孕囊位置、肌层厚度及周边血供给。再依据Alder分级:0~I级为少量血流;II~III级为血流丰富,进一步划分为孕囊富血流型,孕囊乏血流型,包块富血流型和包块乏血流型[6]。
1.3 治疗方法
1.3.1 药物治疗联合清宫术给予肌肉注射甲氨蝶呤(MTX)治疗,第1天注射50mg,3d后再次注射50mg,10d后行宫腔镜清宫手术。
1.3.2子宫动脉栓塞术(UAE) 患者行 UAE后宫腔镜治疗,患者取平卧位,局部麻醉,右侧股动脉进行穿刺,行双侧UAE。UAE术后,对手术部分进行加压包扎。观察患者出血状况,如果术后12~24h后出血情况消失行宫腔镜清宫手术。
1.3.3瘢痕妊娠物清除术经保守治疗血hCG下降不明显和(或)B超提示CSP包块增大明显距离子宫前壁浆膜层距离≤1mm,甚至突破浆膜层伴盆腔积血,患者腹痛加重甚至休克,需行瘢痕妊娠物清除术。具体方法:开腹,在保证血源的前提下,于子宫下段瘢痕妊娠物附着处做横切口,清除瘢痕妊娠物后,修剪切口边缘,I号可吸收线重新连续交锁缝合切口,注意不留间隙。
1.4 观察指标
观察记录住院时间、血清β?hCG恢复正常时间,病灶消失时间,恢复月经时间,副反应(腹痛、发热)。
1.5 统计学处理
数据采用SPSS 15.0软件进行描述性统计学,计量资料采用±s)表示,患者的一般资料采用单因素方差分析,患者治疗后的临床指标采用独立样本t检验,P<0.05表示差异具有统计学意义。
2 结果
2.1 CSP患者一般情况
4组CSP患者年龄、停经时间、治疗前血β?hCG差异均无统计学意义。见表1。
2.2 CSP患者治疗后临床指标比较
在血流丰富型(含孕囊和包块型)行UAE的患者(10例)中,出现腹痛2例、发热2例,在乏血流型(含孕囊和包块型)行MTX+清宫(9例),瘢痕妊娠物清除术(1例)中,出现腹痛3例、发热1例。4组患者血清β?hCG恢复时间和住院时间差别有统计学意义。见表2。
表1 不同血流型CSP患者一般情况±s)
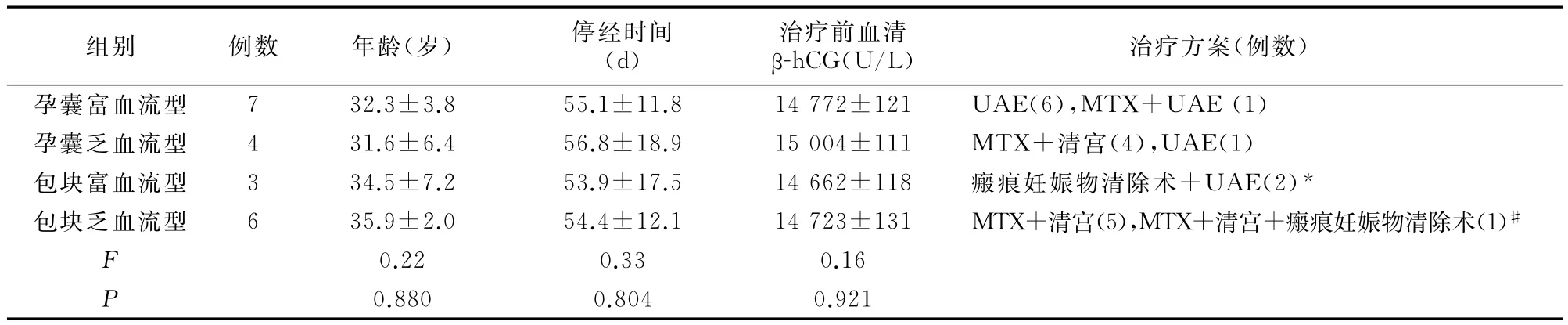
表1 不同血流型CSP患者一般情况±s)
*此2位CSP患者行瘢痕妊娠物清除术中发现大出血,后转为UAE #此患者经保守治疗血hCG下降不明显,再行瘢痕妊娠物清除术
组别 例数 年龄(岁) 停经时间(d)治疗前血清β?hCG(U/L) 治疗方案(例数)孕囊富血流型 7 32.3±3.8 55.1±11.8 14 772±121 UAE(6),MTX+UAE(1)孕囊乏血流型 4 31.6±6.4 56.8±18.9 15 004±111 MTX+清宫(4),UAE(1)包块富血流型 3 34.5±7.2 53.9±17.5 14 662±118 瘢痕妊娠物清除术+UAE(2)*包块乏血流型 6 35.9±2.0 54.4±12.1 14 723±131 MTX+清宫(5),MTX+清宫+瘢痕妊娠物清除术(1)#F 0.22 0.33 0.16 P 0.880 0.804 0.921
表2不同血流型CSP患者治疗后临床指标的比较(d±s)
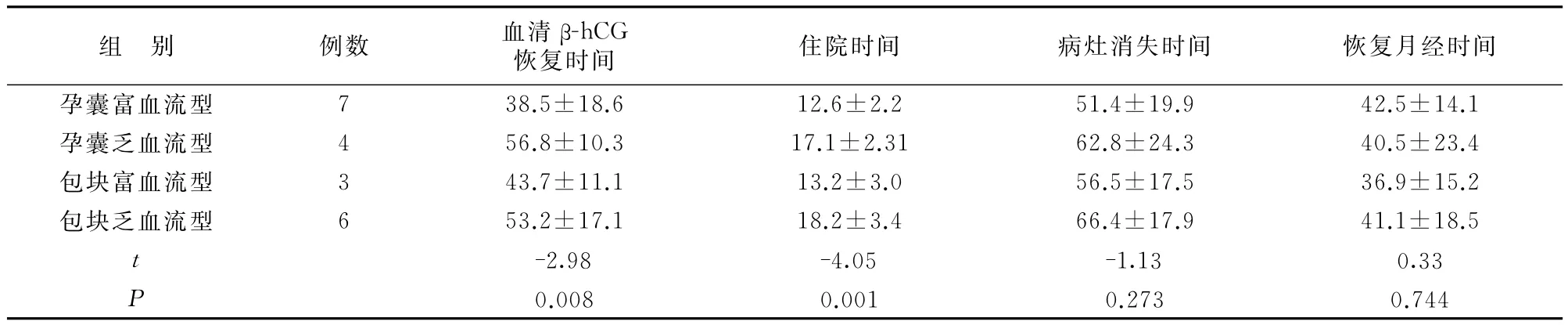
表2不同血流型CSP患者治疗后临床指标的比较(d±s)
组 别 例数 血清β?hCG恢复时间 住院时间 病灶消失时间 恢复月经时间孕囊富血流型 7 38.5±18.6 12.6±2.2 51.4±19.9 42.5±14.1孕囊乏血流型 4 56.8±10.3 17.1±2.31 62.8±24.3 40.5±23.4包块富血流型 3 43.7±11.1 13.2±3.0 56.5±17.5 36.9±15.2包块乏血流型 6 53.2±17.1 18.2±3.4 66.4±17.9 41.1±18.5 t-2.98 -4.05 -1.13 0.33 P 0.008 0.001 0.273 0.744
3 讨论
由于国情和社会因素的影响,导致我国剖宫产发生率增加,同时造成了 CSP发病率的增加[7-8]。CSP是一种特殊类型的异位妊娠,虽然CSP的治疗尚缺乏统一标准,但是尽早去除胚胎,减少出血,尽可能保留患者的生育功能,是基本的治疗原则。目前CSP患者的分型主要参考超声检查,主要诊断依据参考文献[5]:但此超声分型方法仅着重孕囊或者团块的位置,与子宫肌层的层次关系。在临床工作中,病灶周围的血供情况也是判断分型和指导治疗的重要依据之一,CSP的分型与患者的预后密切相关。目前有学者分型采用国际上通用CSP分型[9],但是该标准虽然涉及病灶周围是否出现胎血管搏动,却未考虑病灶周围者总体血供情况。万虹[10]等人对CSP分型进行了改良,强调病灶部位、病灶平均直径和子宫肌层的厚度,是较简单、经济的分型方式。因此,本文采用Alder分型方法,该法基于彩色多普勒血流显像(CDFI)探测病灶周边的血流信号情况[6]。将20例CSF患者分为孕囊富血流型,孕囊乏血流型,包块富血流型和包块乏血流型4个类型,各类型CSP患者的一般资料没有明显差异,与文献报道是一致的[9,11]。再次证明了通过影像学手段,确立分型和及早发现CSP的高危因素的重要性。
目前临床上对CSP主要采用药物治疗、UAE(UEA)结合清宫术和病灶切除术等技术。药物治疗中主要采用MTX,但MTX由于治疗时间较长,不良反应较多,而限制了其在临床的使用情况。盲目进行清宫术容易导致大出血,而且因其单独使用仅仅限于早期治疗。UAE是当前临床治疗CSP的常用技术手段,具有明显减少患者出血量、降低大出血机率及保留产妇生育能力的优点。鉴于此,本文针对病灶血流丰富CSP患者采用UAE联合清宫术。
行UAE+清宫术治疗的病灶血流丰富患者(含孕囊型和包块型),其血清β?hCG恢复正常时间明显优于非UAE+清宫术组。在治疗过程中,都出现不同程度的副反应,如腹疼,发热。通过服用解热、镇痛类药物,症状很快缓解。两组均未出现明显的肾功能异常等严重并发症和副反应。究其原因,行UAE+清宫术治疗能够极大的减少术中出血的危险。
尽量保留患者生育能力是CSP治疗的基本原则之一,特别是患者有生育需求的时候。是否出现生殖系统并发症,如闭经、子宫严重感染导致子宫切除,是衡量UAE治疗效果重要指标之一。本文所涉及的20例CSP患者其恢复月经的时间无统计学差异,但本文尚缺乏对所涉及CSP患者远期生育情况的长期跟踪调查,因此在临床中必须密切注意,如果术后早期出现停经则需提高警惕,必要时可行宫腔镜检查,对继发宫腔粘连的患者进行治疗,减少永久性子宫性闭经的发生。
综上所述,采用Alder分型方法,针对血流丰富型(含孕囊,包块)型CSP患者实施UAE+清宫术治疗是一种可靠临床选择。但是由于本次研究例数较少,随访时间较短,考察指标相对不足,有待进一步扩大样本研究。
[1] Sun YY,Xi XW,Yan Q,et al.Management of type II unruptured cesarean scar pregnancy:Comparison of gestational mass excision and uterine artery embolization combined with methotrexate[J].Taiwanese Journal of Obstetrics & Gynecology,2015,54(5):681-686.
[2] 徐跃勋,陈桂桂.宫腹腔镜联合与子宫动脉栓塞治疗瘢痕部位妊娠对比分析[J].临床医学,2015,35(6):24-25.
[3] 中华医学会计划生育学分会.剖宫产瘢痕妊娠诊断与治疗共识[J].中华医学杂志,2012,92(25):1731-1733.
[4] 刘月洁,张颖,付钰,等.彩色多普勒超声鉴定良恶性乳腺肿物的应用[J].中国超声医学杂志,2006,22(6):420-422.
[5] 赵雪婷,漆洪波.经腹超声和经阴道超声对剖宫产瘢痕超声妊娠分型的诊断价值[J].中国实用妇科与产科杂志,2013,29(11):887-890.
[6] 蒋瑜,杨太珠,罗红等.剖宫产瘢痕部位妊娠的超声分型与治疗方案选择的比较[J].中国超声医学杂志,2016,32(7):635-638.
[7] 吴逢霞,周新娥.瘢痕子宫再次妊娠不同分娩方式的研究[J].现代临床医学,2014,12(3):183-184.
[8] 袁晓瑞,孔红霞,陈雁南,等.剖宫产瘢痕部妊娠53例临床分析[J].当代医学,2014,20(5):52-53.
[9] 宋永红,常青,陈诚,等.高危型剖宫产瘢痕妊娠相关因素分析[J].第三军医大学学报,2016,38(10):1133-1135.
[10] 万虹,陈德新,庄琳.剖宫产后子宫瘢痕妊娠的改良分型对治疗的指导意义[J].实用医院临床杂志,2015,12(4):107-109.
[11] 蒋英,王淑珍.再次剖宫产时对原子宫切口愈合情况相关因素分析[J].实用妇产科杂志,2006,22(7):430-432.
10.3969/j.issn.1004-8189.2017.09.014
广东省科技计划项目(2013B022000007);茂名市科技计划项目(20140333)
2016-12-20
2017-03-08
王丽娜]

