基于交流阻抗技术的可再生型核酸适配体电化学传感器的研究
卢 莹,刘晶晶,杨 恪,韩 祺,田 燕
(安徽农业大学 理学院应用化学系,安徽 合肥 230036)
生物传感技术在疾病的早期诊断、基因测试和法医鉴定等领域发挥着越来越重要的作用[1,2]。一些与生理和病理过程相关的生物活性分子在人体内含量低、易降解、检测困难,因此开发和寻找特异性好、灵敏度高的识别元件一直是生物分析工作者们关注的热点[3-6]。核酸适配体作为一种选择性高、亲和力强、制备成本低、稳定性好的生物传感识别元件,已成为当今生物学、医学领域的研究热点[7-11]。
据文献报道,很多核酸适配体电化学传感器将核酸适配体固定在电极表面作为靶标的识别元件,通过将核酸适配体识别靶标的过程转化为电化学响应信号来实现对于靶标的测定[12-15]。由于适配体和靶标之间的结合力很强,使得这类传感器的再生非常困难,需要采用剧烈的实验条件将适配体和靶标解离,而剧烈的操作条件难免不会对核酸本身造成伤害,从而降低传感器的使用寿命。因此发展可再生型的核酸适配体电化学传感器成为了科研工作者研究的目标之一。
三磷酸腺苷(ATP)是生物体内组织细胞生命活动所需能量的直接来源。ATP在生物体液中的浓度很低,通常为10-9~ 10-8mol·L-1,建立选择性高、灵敏度好的ATP检测方法是一项具有挑战性的工作[16-18]。电化学方法具有灵敏度高、检测限低的优点,核酸适配体作为识别元件具有良好的选择性,利用核酸适配体电化学传感器检测ATP已成为当前的研究热点之一[19-21]。
本研究在ATP的核酸适配体互补链的5’端标记巯基,然后使该互补链与核酸适配体杂交。将杂交后形成的双链DNA寡核苷酸固定在电极表面。在电解液中加入[Fe(CN)6]3-/4-作为探针分子。由于DNA磷酸骨架带负电荷,可以阻碍阴离型探针[Fe(CN)6]3-/4-与电极之间的电荷转移。当没有ATP存在时,双链DNA寡核苷酸修饰的金电极阻抗值较高。当引入ATP后,由于核酸适配体会与ATP结合而从电极表面解离,使得电极表面所带的负电荷的量减少,对[Fe(CN)6]3-/4-与电极表面的电荷传递的阻碍作用降低,测得的电化学阻抗值降低。通过检测阻抗值的变化可以实现对于ATP的测定。与以往文献报道的传感器相比,该方法具有更广泛的普适性,该传感器无需在DNA寡核苷酸上标记电活性基团,使得传感器的制备较为简便,且降低了制备成本。并且该传感器的再生仅需将电极表面固定的互补链与未标记的核酸适配体重新杂交即可实现,再生操作简单、成本低廉。
1 实验部分
1.1 仪器和试剂
CHI660B电化学工作站购自上海辰华仪器公司。电化学测定采用三电极体系:DNA修饰的金电极(直径为2 mm)为工作电极, Ag/AgCl电极为参比电极,Pt丝为对电极。27个碱基的ATP的核酸适配体(5’-ACCTGGGGGAGTATTGCGGAGGAAGGT- 3’)和5’端标记巯基并且除去3’端最后四个碱基的该核酸适配体的互补链(5’-SH-(CH2)6-ACCTTCCTCCGCAATACTCCCCC-3’, cDNA)由上海英骏生命技术有限公司合成和纯化;CTP、UTP、GTP和ATP购自Merck公司;三羟甲基氨基甲烷(Tris)由Amresco公司提供;3-巯基丙酸(MPA)由Acros公司提供。本研究中所用试剂均为分析纯,实验用水为超纯水。
1.2 双链 DNA(ds-DNA)寡核苷酸的制备和标记
用超纯水将ATP的核酸适配体及其互补链分别配成100 μM溶液。分别取核酸适配体和其互补链的溶液30 μL和15 μL,混合后向该混合液中加入5 μL退火缓冲液(annealing buffer: 100mM Tris, 1 M NaCl, 0.5 M EDTA, pH 7.4)。将混合溶液加热到95°C,在95 °C 维持10 min,然后使溶液温度以每分钟1 °C的速率缓慢降至20 °C即可得到双链DNA寡核苷酸(ds-DNA)溶液。所得的ds-DNA溶液用3KD的超滤管以3000 r·min-1的速率超滤20 min,以除去未杂交的单链DNA寡核苷酸。
1.3 电极的制备和再生
金电极在抛光布上依次用直径为0.3 μm和0.05 μm的Al2O3粉悬浊液抛光,然后依次用丙酮和超纯水超声清洗5 min。清洗过的电极在0.5 M的硫酸溶液中以0.5 V·s-1的扫速在-0.2 V~ +1.6 V的电位范围内扫描,直至得到典型的清洁的金电极特征循环伏安图。将该电极用超纯水冲洗,除去表面剩余的硫酸溶液,然后将电极表面用氮气吹干。将50 μL 5 μM的巯基标记的ds-DNA溶液滴涂在电极表面使其反应2小时,使ds-DNA通过自组装的方式固定在电极表面。当自组装反应结束后,用超纯水冲洗电极表面,以除去电极表面残余的ds-DNA溶液。然后将电极浸入1 mM的MPA溶液中反应10 min,以除去电极表面未结合牢固的ds-DNA。使用20 mM的Tris缓冲液(20 mM Tris, 140 mM NaCl, pH 7.6)和超纯水充分清洗电极,以除去电极表面残余的MPA溶液。 将制备好的电极在100 μL不同浓度的靶分子或干扰物的Tris缓冲溶液(20 mM Tris, pH 7.6)中浸泡10 min,反应温度为室温。10 min后将电极从溶液中取出, 使用20 mM的Tris缓冲液(pH 7.6)和超纯水充分清洗电极,清洗过的电极即可用于电化学测定。测定靶分子后的电极使用Tris缓冲液和超纯水充分冲洗。将清洗过的电极浸入300 μL 10 μM的核酸适配体溶液中,溶液中加入30 μL的退火缓冲液。将体系升温至95 °C,在95 °C维持10 min,然后使体系温度以每分钟1 °C的速率缓慢降至20 °C。使用Tris缓冲液和超纯水充分清洗电极以除去电极表面残余的核酸适配体溶液。通过该方法使得电极得以再生。
1.4 电化学测定
电化学检测在含有20 mM的亚铁氰化钠(Na4[Fe(CN)6])的Tris缓冲液(20 mM Tris, 140 mM NaCl, pH 7.6)中检测,交流阻抗(electrochemical impedance spectroscopy, EIS)电化学检测条件为: 测定电位,开路电位(open circuit potential);交变电位,5 mV;频率范围,2×104Hz ~ 0.1 Hz。
2 结果与讨论
2.1 传感器的设计方案
本研究构建的ATP适配体交流阻抗电化学传感器的传感机理见图1,首先将ATP的核酸适配体互补链的5’端标记巯基,然后使该互补链与核酸适配体杂交。将杂交后形成的双链DNA寡核苷酸固定在电极表面。在电解液中加入[Fe(CN)6]3-/4-作为探针分子。 由于DNA的磷酸骨架带负电荷,可以阻碍阴离子型探针[Fe(CN)6]3-/4-与电极之间的电荷转移。当没有ATP存在时,双链DNA寡核苷酸修饰的金电极阻抗值较高。当引入ATP后,由于核酸适配体会与ATP结合而从电极表面解离,使得电极表面所带的负电荷的量减少,对[Fe(CN)6]3-/4-与电极表面的电荷传递的阻碍作用降低,测得的电化学阻抗值降低。通过检测阻抗值的变化测定ATP。当使用该传感器检测靶标过后,将无标记的ATP的核酸适配体与电极表面固定的互补链再次杂交,传感器即可得到再生。
图1 基于交流阻抗技术的可再生型ATP适配体电化学传感器检测机理
2.2 ds-DNA 在电极表面的固定
图2中(●)和(■)分别表示裸金电极和ds-DNA修饰的金电极在含有140 nM NaCl和20 nM Na4[Fe(CN)6]的20 mM Tris缓冲液中的交流阻抗图谱。从图可以看出,裸金电极的交流阻抗图谱中半圆部分的半径值非常小,当电极表面修饰了DNA后,对应于电荷转移电阻的交流阻抗谱图中半圆部分的半径明显增大。这是因为DNA的磷酸骨架带负电荷,会对阴离子型探针[Fe(CN)6]3-/4-与电极表面之间的电荷转移产生阻碍,导致电荷转移电阻增大。通过这一对比,证明ds-DNA被成功地修饰到电极表面。
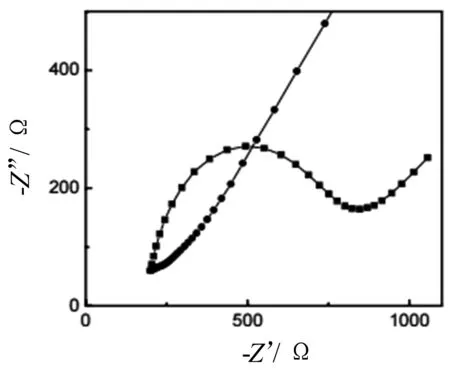
图2 裸金电极(●)和ds-DNA修饰的金电极(■)在含有140 nM NaCl和20 nM Na4[Fe(CN)6]的20 mM Tris缓冲液中的交流阻抗图谱
2.3 传感器对ATP的响应
图3给出了使用该传感器对于不同浓度的ATP 的交流阻抗响应信号。其中空心圆符号(○)表示裸金电极的交流阻抗谱图。实心符号所代表的交流阻抗信号由外至内分别代表将该电极在不同浓度的ATP的Tris溶液中浸泡10 min后在电极上得到的交流阻抗谱图,其对应ATP的浓度分别为0、10、20、40、60、80、100 nM。其中对应10 nM和20 nM 的ATP的谱图和检测ATP之前的电极上得到的谱图几乎重合。 由图中可以看出随着ATP浓度的升高,电极的电荷转移电阻值不断减小。
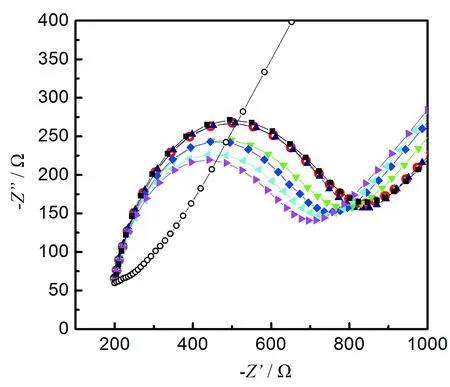
图 3 裸金电极(○)和ds-DNA修饰的金电极检测不同浓度的ATP后在含有140 nM NaCl和20 nM Na4[Fe(CN)6]的20 mM Tris缓冲液中的交流阻抗图谱
根据交流阻抗图中电极的电荷转移电阻值, 我们绘制了阻抗值随ATP的浓度变化的关系图,如图4所示。由图4可以看出,ATP的浓度在20~100 nM之间时, Anson曲线上电荷转移电阻值与ATP浓度成正比(ΔRet/ Ω = 1.6 CATP/nM-27.40, R = 0.998)。传感器的检出限为10 nM (S / N= 3)
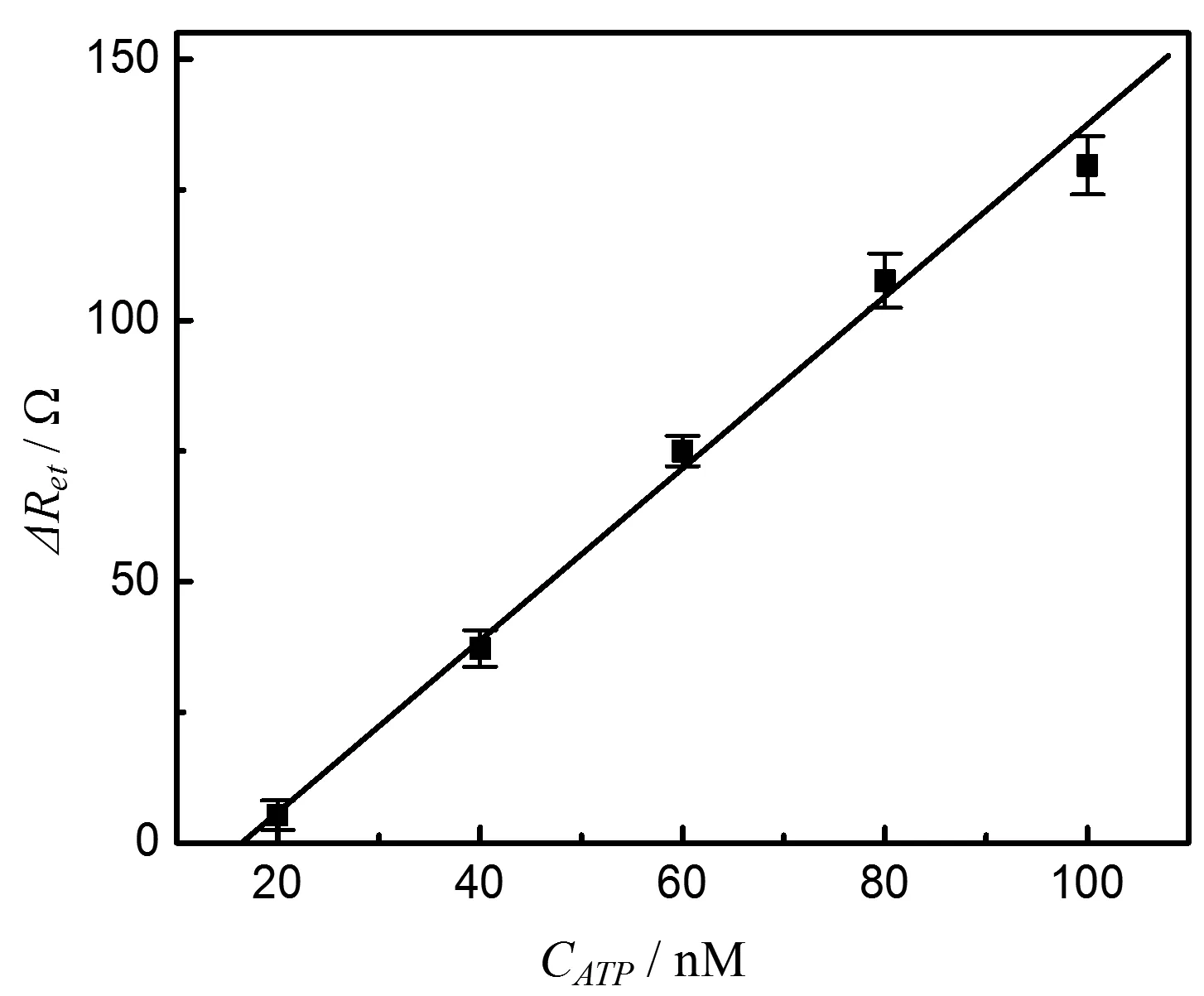
图4 电极的电荷转移电阻值随检测ATP的浓度变化的关系图
我们运用循环伏安技术作为辅证来检验该传感器对于ATP的响应,结果如图5所示。图5中虚线部分是ds-DNA修饰的金电极在含有20 mM [Fe(CN)6]3-/4-的Tris缓冲液中的循环伏安图,实线部分是使用该电极检测100 nM的ATP后的循环伏安图。由该图可以看出当ds-DNA修饰的电极与ATP作用后 [Fe(CN)6]3-/4-的峰电位差降低,峰电流增加。该实验证明,在检测ATP后,[Fe(CN)6]3-/4-和电极表面的电荷转移得到了促进,验证了传感器设计的合理性。
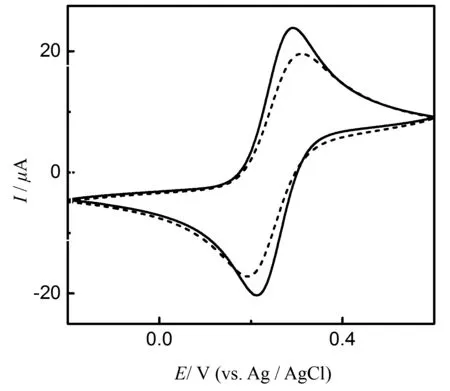
图5 ds-DNA修饰的金电极检测100 nM ATP前(虚线)后(实线),在含有140 nM NaCl和20 mM [Fe(CN)6]3-/4-的20 mM Tris缓冲液中的循环伏安图
2.4 传感器的选择性
我们研究了传感器对ATP类似物CTP、UTP和GTP的响应,结果如图6所示。选用的CTP、UTP、GTP和ATP浓度均为100 nM。由图6结果可以看出,采用本传感器检测100 nM ATP的响应信号ΔRet为检测100 nM CTP、UTP和GTP响应信号20倍以上,检测100 nM的CTP、UTP和GTP的响应信号分别相当于20.2、20.5和20.6 nMATP的响应信号。该结果证明所构建的核酸适配体传感器检测ATP具有良好的选择性。
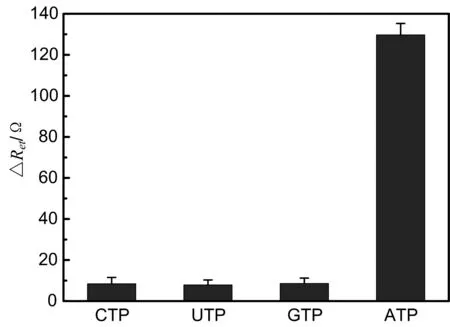
图6 传感器的选择性
2.5 传感器的再生
本研究所构建的传感器是将cDNA固定在电极表面,核酸适配体通过杂交的方式与cDNA结合。 在检测ATP样品后, 核酸适配体从电极的表面解离下来,因此传感器的再生仅需将检测后的传感器与无标记的核酸适配体杂交即可实现。图7显示了新制备的传感器以及经过六次再生的传感器检测100 nM ATP前后的电化学响应信号。经过六次再生后电极对于ATP的响应仍能达到电极初始响应的90%以上。该结果证明本传感器能够反复再生使用,可有效降低检测成本。
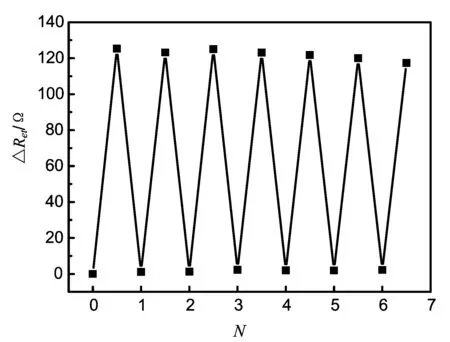
图7 传感器的再生
3 结论
本文构建了一种可再生的ATP核酸适配体交流阻抗型电化学传感器。该传感器将ATP的核酸适配体互补链的5’端标记巯基,再与ATP核酸适配体杂交,通过自组装法将杂交后的双链DNA固定在金电极表面。当使用该传感器检测靶分子时,靶分子与核酸适配体结合,[Fe(CN)6]3-/4-与电极表面的电荷传递的阻碍作用降低,电化学阻抗值降低。本传感器具有普适、简单的特点,电极易于再生,再生成本低廉。
[1] Wang J. Self-propelled affinity biosensors: moving the receptor around the sample [J]. Biosens Bioelectron, 2016, 76: 234-242.
[2] Orozco J, Pan G, Sattayasamitsathit S, et al. Micromotors to capture and destroy anthrax simulant spores [J]. Analyst, 2015, 140: 1421-1427.
[3] Chen J, Li Z, Ge J, et al. An aptamer-based signal-on bio-assay for sensitive and selective detection of kanamycin A by using gold nanoparticles [J]. Talanta, 2015, 139: 226-232.
[4] Zhang D, Shen H, Li G, et al. Specific and sensitive fluorescence anisotropy sensing of guanine-quadruplex structures via a photoinduced electron transfer mechanism [J]. Anal Chem, 2012, 84: 8088-8094.
[5] Wong N Y, Xing H, Tan L H, et al. Nano-encrypted morse code: a versatile approach to programmable and reversible nanoscale assembly and disassembly [J]. J Am Chem Soc, 2013, 135: 2931-2934.
[6] 文晓棠,李华,邓乐. 适配体传感器在微生物检测中的应用[J]. 生命科学研究, 2011, 15: 455-459.
[7] 卢莹,田燕,王莉等. 基于计时库仑技术的可再生型三磷酸腺苷适配体电化学传感器的研究[J]. 分析化学, 2017, 45: 721-726.
[8] Bard A J, Faulkner L R. Electrochemical methods: fundamentals and applications 2nd edition [M]. Wiley, 2001.
[9] Kumar P, Lambadi P R, Navani N K. Non-enzymatic detection of urea using unmodified gold nanoparticles based aptasensor [J]. Biosens Bioelectron, 2015, 72: 340-347.
[10] Majidi M R, Omidi Y, Karami P, et al. Reusable potentiometric screen-printed sensor and label-free aptasensor with pseudo-reference electrode for determination of tryptophan in the presence of tyrosine [J]. Talanta, 2016, 150: 425-433.
[11] Bai H Y, Del Campo F J, Tsai Y C. Sensitive electrochemical thrombin aptasensor based on gold disk microelectrode arrays [J]. Biosens Bioelectron, 2013, 42: 17-22.
[12] Shen L, Chen Z, LI Y, et al. A chronocoulometric aptamer sensor for adenosine monophosphate [J]. Chem Commun, 2007, 21, 2169-2171.
[13] Zayats M, Huang Y, Gill R, et al. Label-free and reagentless aptamer-based sensors for small molecules [J]. J Am Chem Soc, 2006, 128: 13666-13667.
[14] Lu Y, Zhu N, Yu P, et al. Aptamer-based electrochemical sensors that are not based on the target binding-induced conformational change of aptamers [J]. Analyst, 2008, 133: 1256-1260.
[15] Xiao Y, Lubin A A,. Heeger A J, et al. Label-free electronic detection of thrombin in blood serum by using an aptamer-based sensor [J]. Angew Chem Int Ed, 2005, 44: 5456-5459.
[16] Lu Y, Li X, Zhang L, et al. Aptamer-based electrochemical sensors with aptamer-complementary DNA oligonucleotides as probe [J]. Anal Chem, 2008, 80: 1883-1890.
[17] Yu P, He X, Zhang L, et al. Dual recognition unit strategy improves the specificity of the adenosine triphosphate (ATP) aptamer biosensor for cerebral ATP assay [J]. Anal Chem, 2015, 87: 1373-1380.
[18] 姜利英,王芬芬,胡杰等. 基于共面薄膜金电极的三磷酸腺苷适体传感器[J]. 分析化学, 2014, 42: 666-671.
[19] Steel A B, Herne T M, Tarlov M J. Electrochemical quantitation of DNA immobilized on gold [J]. Anal Chem, 1998, 70: 4670-4677.
[20] Li W, Nie Z, Xu X, et al. A sensitive, label free electrochemical aptasensor for ATP detection [J]. Talanta, 2009, 78: 954-958.
[21] 于寒松,隋佳辰,代佳宇等. 核酸适配体技术在食品重金属检测中的应用研究进展[J]. 食品科学, 2015, 36: 228-233.

