一种改良复苏法对人肝星状细胞复苏效果的实验研究
杨 丹,谢林浚,胡 庆,罗德兰,邓明明
伴随生物实验技术发展,细胞体外培养成功与否以及细胞生物学特性的好坏,直接关系到实验的成败。为阻断退变,保存种子细胞,减少细胞被污染必须及时冻存细胞。但是由于不同细胞对复苏条件要求不同,常规复苏方法不可能适用于所有细胞,从而导致复苏成功率低,严重时甚至导致实验无法进行。因此,需要对肝星状细胞(Hepatic Stellate Cell, HSC)培养过程基础且关键的复苏进行探讨,选择合适条件使冻存后复苏的HSC获得最佳生物学特性,以确保后期实验的顺利进行。
1 材料与方法
1.1 材料 细胞:人HSC(LX-2)购自西南医科大学附属医院分子生物学中心实验室。选取10代以内的代数相近,冻存前细胞均处于对数期且密度相近,均采用10%DMSO+90%胎牛血清(FBS)作为冻存液,都保存在液氮当中的细胞作为种子细胞。主要试剂和仪器:FBS、DMEM高糖培养基、PBS购自GIBCO公司;双抗、胰酶、DMSO购自BestBio公司;CCK-8试剂盒、细胞周期与细胞凋亡检测试剂盒购自碧云天公司。
1.2 HSC复温方法 传统复温法:取出冻存细胞后立即于37 ℃ 水浴快速解冻,1分钟内全部融化。改良复温法:取出冻存细胞后立即于40 ℃水浴中迅速融化至冰晶消失,再转入 37 ℃水浴中快速解冻。
1.3 培养基选择 传统培养基法:10%FBS+89%DMEM+1%双抗(100U/ml 青霉素+l00ug/ml 链霉素)。改良培养基法:先使用20%FBS+79%DMEM+1%双抗培养8h,贴壁后改用10%FBS+89%DMEM+1%双抗。培养基在使用之前均先置于37 ℃ 水浴箱复温。
1.4 离心法 传统离心法:离心前不加培养基,1000r/min离心5min。改良离心法:离心加培养基,800r/min离心3min。
1.5 实验分组 A组采用传统复温+传统培养基+传统离心,B组采用改良复温+改良培养基+改良离心。A组和B组细胞均置于37 ℃,5% CO2,湿度100%的同一孵箱内培养。
1.6 实验方法 按照实验分组复苏细胞。于0h、8h、24h、48h、72h在倒置相差显微镜下观察各组HSC细胞形态及生长情况,观察内容包括细胞形态、是否贴壁、生长分裂是否旺盛、是否达到融合等。待各组细胞生长至70%~80%融合时,将细胞接种于96孔板,培养72h后,用CCK-8法检测细胞活性,流式细胞术检测细胞周期。
1.7 统计学分析 所有数据处理均应用SPSS18.0软件统计,结果以均数±标准差/(x±S)表示。两个样本均数比较用t检验,多个样本均数比较行完全随机设计单因素方差分析,以P<0.05为差异有统计学意义。
2 结 果
0h时各组细胞呈圆球形,在光镜下胞质透亮,培养基清亮。8h时两组细胞均开始贴壁,但是A组贴壁差,细胞呈多角形或梭型,B组贴壁良好,胞体呈卵圆形或不规则形,常伸出数个星状突起,核仁1-2个。72h时A组生长生长分裂低下,尚未达到融合,B组生长分裂旺盛,达到融合, 生长密集单层, 可传下一代(如图1所示)。CCK-8法检测细胞活性时发现B组OD值显著高于A组(P<0.01,如表1所示)。流式细胞术检测细胞周期发现B组处于S期的细胞显著多于A组(P<0.05,如图2所示)。
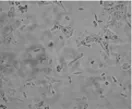
A组

B组

A组

B组

表1 CCK-8检测HSC增殖活性(χ±S)
3 讨 论
细胞复苏的关键在于复温速率[1]。复温速度过慢时,细胞内往往重新形成较大冰晶而造成细胞损伤。且复温时造成的细胞损伤非常快,往往在极短时间内发生。故复苏的原则是快速解冻,使细胞迅速通过最易受损的-5~0 ℃,避免冰晶重新结晶而对细胞造成伤害,细胞仍能继续生长,活力受损不大[2]。本实验采取40℃先溶解冻存细胞后再维持37℃恒温复苏方法,大大加快了冻存细胞的解冻,故复苏后存活率及活化率明显高于只采取37℃复苏的传统方法。
血清是细胞培养基中的重要组成部分,其含有大量生物活性物质及生长因子[3]。不同细胞株对血清含量的要求各有不同。血清浓度过高可能影响培养基的酸碱度,促使细胞过早分化,且浪费资源[4]。但是血清浓度过低,细胞可能因缺乏必要生长因子导致复苏率低。因此细胞刚接种时血清浓度需较高,稳定生长时应降低。改良培养基法根据HSC细胞学特性以及复苏过程中不同阶段的特点采用初始高浓度血清以提高细胞复苏率,稳定生长阶段降低培养基血清浓度防止细胞过早分化,试验证实改良培养基法使冻存后复苏的HSC获得最佳生物学特性。
冻存液多使用DMSO,DMSO作为冻存保护剂在4℃以上时就具有细胞毒性,复苏后若不及时清除可能会影响细胞生长[5,6]。改良离心法即在复苏HSC前离心,并在离心前滴加培养基有助于细胞尽早接触培养基环境,减少细胞外环境变化过速所致的细胞破裂。我们经过实验证实离心前缓慢滴加培养基同时轻轻晃动离心管较不离心去除冷冻保护剂和离心前不加入培养基有更高的细胞复活率。但是在离心过程中细胞即使有血清保护,仍可能受到机械剪切伤害。离心机械剪切伤害与离心转速和时间关系最为密切[7]。传统方法将细胞悬液经1000r/min离心5min,可能并不适用于HSC。HSC虽然是经过处理后的人HSC,其基因表型较原代HSC已有变化,能够多次传代,但是其相对于肿瘤细胞而言仍是极为娇弱,对外界抵抗力更差。本实验采取改良离心法即在离心前缓慢滴加培养基同时轻轻晃动离心管,800r/min离心3min。试验结果同样证实了降低离心速率、离心时间可减少对HSC的破坏,提高细胞存活率。
本研究通过改良复温方法、离心方法、培养基这三个因素对细胞复苏存活率及细胞生物活性影响的分析与探究, 建立了一种简单可行、稳定性高、复苏存活率高、可保持细胞最佳生物学特性、适用于体外实验研究的新方法。
[1]韩华, 赵静, 赵红伟, 等. 冻存复苏对脐带间充质干细胞生物学特性的影响[J]. 现代中西医结合杂志, 2016, 25(23):2512-2514.
[2]金晶, 朱玲, 高军, 等. 三种DNA抽提方法对新鲜血细胞及冻血细胞DNA抽提效能的比较[J]. 第二军医大学学报, 2014, 35(1):101-105.
[3]李朦, 刘宏伟,LIMeng, 等. 不同保存方法对“临床即用型”脂肪源性干细胞活性影响的评估[J]. 中国美容医学杂志, 2016, 25(4):100-103.
[4]周尚谦, 沈朗, 李雪媛, 等. 血清限制对人滋养细胞株HTR-8/SVneo细胞胰岛素样生长因子-1表达及细胞侵袭力的影响[J]. 南方医科大学学报, 2017, 37(6):774-779.
[5]李中文, 吴涛, 付应霄, 等. 低浓度二甲基亚砜保护SSMC7721细胞冻存后活力[J]. 中国组织化学与细胞化学杂志, 2016, 25(1):70-74.
[6]刘莉, 唐世刚. 促肝细胞生长素联合不同DMSO浓度冻存小鼠肝细胞的质量研究[J]. 肝脏, 2015, 20(11):879-882.
[7]段峰, 关键, 杨红岩, 等. 机械离心力对成骨细胞骨形态发生蛋白信号通路中Runx-2mRNA的影响[J]. 中国组织工程研究, 2014, 18(33):5305-5309.

