高温高湿环境对Wistar大鼠生理病理的影响研究
刘诗颖,陈 杰,李赓觅,黄伍蓉,简 燚,呼永河,吴丽娟
我国西南地区气候环境复杂,每年夏季都会出现持续的高温高湿天气,平均每年有30天日平均气温高于33℃,最高可达41℃以上,并且全年湿度偏高,在梅雨季节期间常常持续20天以上湿度接近100%[1]。高温高湿环境作为一种特殊的外界因素严重扰乱机体内环境稳定,导致重要器官如脑、心、肺、肝、肾等的功能紊乱,甚至引起衰竭并危及生命[2-4]。既往研究主要集中在讨论高温高湿环境对创伤[5-7]或某一特定脏器及细胞免疫功能[8-9]的影响,本研究旨在通过检测极端高温高湿环境下Wistar大鼠血生化及病理指标的改变,从生理和病理的整体水平上探究高温高湿环境急性伤害对Wistar大鼠的影响,为下步深入探讨高温高温急性伤害的机理研究提供前期实验基础。
1 材 料
1.1 实验动物
SPF级Wistar大鼠,雄性,170-190g,购自成都达硕生物科技有限公司[实验动物许可证号scxk(川)2008-24]。在试验过程中,按试验动物使用的“3R”原则给以实验鼠人道主义关怀。本研究获得我院伦理委员会批准。
1.2 主要仪器
多段编程人工气候箱,型号RXZ-1000A,购自中国宁波江南仪器;全自动生化仪,型号AU5800,购自BECKMAN公司。
2 方 法
2.1 极端高湿环境下适宜研究温度的筛选
将人工气候箱条件设置为RH =(95±2)%,T分别设置为(30±0.5)℃、(32±0.5)℃、(34±0.5)℃、(36±0.5)℃。将12只Wistar大鼠放入不同温度条件的人工气候箱中饲养72h,要求实验鼠每天置于箱内24小时。观察并记录动物死亡情况,根据死亡情况筛选适宜的研究条件。
2.2 高温高湿环境暴露对Wistar大鼠生化和病理指标的影响
按照“极端高湿环境下适宜研究温度的筛选”方案,将人工气候箱条件设置为[RH=(95±2)%,T=(34±0.5)℃]。将13只Wistar大鼠暴露于人工气候箱中,要求实验鼠每天置于箱内24小时,实时观察记录死亡情况,当超过半数动物死亡时停止实验,剩余存活的大鼠经10%水合氯醛麻醉后,进行腹主动脉取血,离心收集血清进行生化指标测定。同时收集存活大鼠的心、肺、肾、脑、肠及肌肉组织置于4%多聚甲醛中固定,进行病理检测。另外,实验设置常温常湿组[T=(25±0.5)℃,RH=50±2%]作为对照。
2.3 指标测定
钾(K)、钠(NA)、氯(CL)、尿素氮(BUN)、肌酐(CREA)、总胆红素(TBIL)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、r-谷氨酰转移酶(GGT)、碱性磷酸酶(ALP)、缺血修饰白蛋白(IMA)、肌酸激酶(CK)、超敏C反应蛋白(Hs-CRP)试剂盒均购自北京九强生物技术有限公司。所有指标均在BECKMAN COULTER AU5800 全自动生化仪上检测。
2.4 统计学方法
3 结 果
3.1 极端高湿环境下适宜研究温度的筛选
在极端高湿(RH=95%)条件下,Wistar大鼠暴露于30℃及32℃环境72 h未出现死亡;34℃条件下暴露24 h开始出现死亡,且死亡率随着暴露时间的延长而上升,暴露72 h后死亡率达到83%,显著高于30℃和32℃组(P<0. 05);36℃条件下暴露12 h死亡率突然跃升到92%,72 h时死亡率已经达到100%,显著高于30℃和32℃组(P<0. 05),而与34℃组无显著性差异(P>0. 05)。

*与30℃和32℃组比,P<0. 05
3.2 高温高湿环境对Wistar大鼠血生化指标的影响
将13只Wistar大鼠暴露于[RH=(95±2)% / T=(34±0.5)℃]环境中,到46 h时死亡7只,取剩余6只存活大鼠血液进行生化指标的检测(见表1)。生化结果显示,与常温常湿对照组相比,高温高湿环境下暴露46 h后Wistar大鼠血钾(K+)和缺血修饰白蛋白(IMA)水平均显著降低(P<0. 05),而总胆红素(TBIL) 和肌酐(CREA)水平均显著升高(P<0. 05),其它生化指标无显著差异(P>0. 05)。

表1 Wistar大鼠生化指标检测结果
3.3 高温高湿环境对Wistar大鼠病理指标的影响
Wistar大鼠在高温高湿环境[RH=(95±2)% /T=(34±0.5)℃]中暴露46h后,解剖发现大多数死亡动物存在肺部充血、胃肠肿胀、肝脏淤肿现象(见图2)。经病理检测后发现心脏组织心肌间质水肿,伴有炎性细胞浸润,部分心肌细胞发生退变,肌纤维溶解;肺组织间质结构增宽,间质内有大量炎性细胞浸润;肾组织间质出血明显;肠组织在粘膜层可见嗜酸性粒细胞和大量浆细胞、淋巴细胞浸润,间质水肿、出血;而脑和肌肉组织均未见明显病理学改变(见图3)。

A:心;B:肺;C:肾;D:脑;E:肠;F:肌肉;G:脾;H:肝
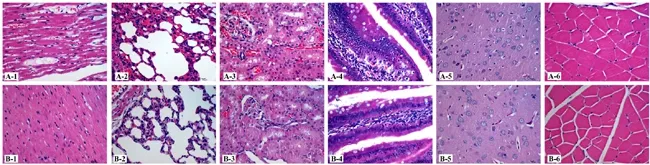
A:高温高湿组;B:常温常湿组;
4 讨 论
高温高湿环境会对人体健康产生不良影响,其根本原因是环境温度超过了体表温度,导致机体不仅无法进行正常的散热,还会从热环境中获得能量使人体免疫功能减退,同时大量水汽使体表汗液蒸发困难,加重机体对温度的敏感性。
有研究发现[10],当环境温度大于30℃时,相对湿度每增加10%,对机体带来的热影响,相当于环境温度增加1~1.5℃。30℃的环境温度便可使安静状态下的人体体温升高,35℃时这种影响非常显著,故认为高湿度对生理产生不良影响的温度界限是35℃。本研究发现在高湿环境中(RH=95%),30℃和32℃的研究温度作用过于温和,36℃作用过于猛烈,均不适宜开展高温高湿急性伤害研究;34℃的研究温度既能在短时间内对大鼠造成损伤,死亡又不会过于迅速,便于采集标本,因此本研究选择[RH=(95±2)% /T=(34±0.5)℃]的实验条件较为合适。
本研究发现湿热环境暴露46h后K+离子浓度显著下降,这可能是由于在高温高湿环境下大鼠呼吸频率加快,血中CO2的排出量增多,血液中H+、HCO3-浓度下降,pH值升高,为了保持内环境稳定,机体通过泌尿作用排出Na+、K+等碱性离子,而伴随着血浆渗透压下降和动物大量饮水,醛固酮的保钠排钾作用使K+浓度进一步下降,Na+浓度总体变化不大。血肌酐的浓度变化主要由肾小球的滤过能力来决定,我们推测高温高湿环境暴露可能对肾脏造成了损伤使滤过率下降,导致血肌酐浓度显著升高,在病理检测中我们也发现肾脏出现了明显的间质出血现象。同样,总胆红素水平的升高也提示了高温高湿环境对肝脏的伤害。缺血修饰白蛋白(IschemiaModifiedAlbumin,IMA)是指示心肌缺血的灵敏指标,IMA的形成与血液中游离的Cu2+含量有关,在湿热环境中血液PH值升高,导致Cu2+无法从循环蛋白的金属结合位点释放,从而阻碍了IMA的生成,同时热应激还能诱发释放多种内源性活性物质抵抗心肌缺血损伤[11],如腺苷[12]、一氧化氮[13]等。
研究还发现高温高湿环境暴露46h后心脏、肺及肠道存在明显的炎性细胞侵润,我们推测这可能是由于湿热环境暴露导致全身血流重新分配,胃肠道血流量下降,使其发生缺血缺氧性损害,最终造成肠道屏障作用减弱,通透性增加,致使肠道内的细菌和内毒素能够自由地进入循环系统,移位至血液内的细菌和内毒素可以激活机体免疫系统,诱导单核细胞、中性细胞分泌活性细胞因子如TNF-α,TNF-α可以刺激其他细胞因子如IL-4,IL-6等的释放,扩大其生物学效应,介导出现全身性炎症反应综合征(SIRS),进而引起多器官功能障碍综合征(MODS)[14]。
多数研究者认为发生热应激时机体会产生大量的自由基,使细胞膜多不饱和脂肪酸发生过氧化反应,膜结构遭到破坏导致其通透性增高,各组织细胞分泌的酶释放进入血液,成为细胞受损的标志物。然而本研究中包括CK、ALT、AST等在内的酶类并没有显著性的改变,与韩喜彬[15]等的研究结果相差较大,这可能是由于温湿度差异或者热暴露时间的不同引起的,不同的温度也可以直接影响酶的含量或活性。这说明我们的研究还存在有待完善的地方,接下来的研究中我们希望通过延长环境暴露时间并动态检测各时间点大鼠血生化和病理指标的改变,找到变化最显著的时间点,更进一步地从转录组水平探讨高温高湿急性伤害的分子机制,从而为高温高湿急性伤害研究奠定理论基础。
[1]郑敏,翁庙成,刘方,等.高温高湿环境对家兔血液流变特性与生化指标的影响[J].中南大学学报(自然科学版),2012,43(7): 2883-2888.
[2]李国建.高温高湿低氧环境下人体热耐受性研究[D].天津大学,2008: 2-5.
[3]岳海燕,申双和.呼吸道和心脑血管疾病与气象条件关系的研究进展[J].气象与环境学报,2009,25(2): 57-61.
[4]李庆滨,盛丽,何燕,等.气象因素对急性心肌梗死发病的影响及因时护理措施[J].中华护理杂志,1997,32(11): 621-624.
[5]马晓东,李扬,梁永平.高温高湿环境对大鼠创伤性脑水肿的影响[J].军医进修学院学报,2012,33(1): 66-70.
[6]郭燕舞,张世忠,朱红胜,等.高温高湿环境下颅脑损伤动物创腔及周围组织细菌生长的特点[J].中国临床康复,2006,10(12): 187-189.
[7]裴国献.重视热带地区战创伤救治研究[J].解放军医学杂志,2003,28(4): 285-288.
[8]汪晓.高温高湿条件下运动致大鼠多脏器损伤及其机制研究[D].福建医科大学,2013: 23-28.
[9]SHEPHARDRJ,SHEKPN.Immunedysfunctionasafactorinheatillness[J].CritRevImmunol, 1999, 19(4): 285-302.
[10]于永中,李天麟,刘尊永,等.高温环境中湿度的某些生理作用[J].中华劳动卫生职业病杂志,1984,(1): 31-33.
[11]陶卫国.热应激对心肌缺血耐受性影响的机制[J].心脏杂志,2004,16(4): 384-386.
[12]RICHARDV,LAUDEK,ARTIGUESC.Heatstressincreasesendothelium-dependentrelaxationsandpreventsreperfusion-inducedendothelialdysfunction[J].ClinExpPharmacolPhysiol, 2002, 29(11): 956-962.
[13]JOYEUXM,ARNAUDC,GODIN-RIBUOTD.Endocannabinoidsareimplicatedintheinfarctsize-reducingeffectconferredbyheatstresspreconditioninginisolatedrathearts[J].CardiovascRes, 2002, 55(3): 619-625.
[14]LIUZ.,SUNX,TANGJ,etal.Intestinalinflammationandtissueinjuryinresponsetoheatstressandcoolingtreatmentinmice[J].MolMedRep, 2011, 4(3): 437-443.
[15]韩喜彬,巴彩凤.SD大鼠热应激模型的制作及平价[J].中国农学通报,2014,30(17): 31-34.

