掺硼α-FeOOH催化降解甲基橙研究
周华锋, 李 涛
(沈阳化工大学 应用化学学院, 辽宁 沈阳 110142)
随着科技的日新月异,人们的生活水平逐渐提高,更多种类与数量的合成有机化学品进入人们的生活.美国在2001年至2012年的第二轮国家水质评价计划中对42个地下水盆地和地表水流域的研究结构表明,上述水系主要污染物由无机污染转向有机污染[1].国内外的研究表明,常规的物理水处理工艺对大量有机物特别是溶解态有机物的去除率只能到达20 %~30 %[2].将有机污染物氧化成CO2和水的Fenton反应已成为业内研究热点,然而在染料废水处理中的应用却受到很大限制,作为均相催化剂的铁离子与反应介质的分离较难,容易流失而引起二次污染[3-4].因此有机污染物的非均相催化氧化降解技术逐渐成为研究的热点,它不仅能克服以上缺点,还能高效的循环利用多次.
铁是地球富产元素,铁氧化物主要包含铁的氢氧化合物和氧化物,其在催化领域、磁性材料、传感器、颜料和环境污染治理等方面有广泛的用途[5-9].由于α-FeOOH结构中存在可以容纳或吸附金属离子的通道,因此有关于掺杂金属离子α-FeOOH的合成和性质方面的研究在环境控制、矿物勘察、催化剂改性等领域具有重要的实际意义[10-13],掺杂离子不仅可以修饰α-FeOOH本身的结构参数,而且可以有效影响其粒子形貌和物理、化学性质,但对于掺硼的α-FeOOH的制备与应用研究只有胡珊[14]等少数人报道.
基于以上原因,本文以NaOH碱性溶液为介质,FeSO4为起始原料,加入四硼酸钠用空气氧化法合成出掺硼α-FeOOH.并以其为非均相Fenton反应催化剂,研究自然光条件下对含MO有机废水的降解作用.
1 实 验
1.1 实验试剂与仪器
七水合硫酸亚铁(分析纯),天津市大茂化学试剂厂;氢氧化钠(分析纯),天津市大茂化学试剂厂;甲基橙,国药集团化学试剂有限公司;过氧化氢(H2O2,质量分数30 %),国药集团化学试剂有限公司.所用水均为去离子水.
DF-101S集热式恒温水浴锅,郑州长城科工贸有限公司;循环水式多用真空泵,郑州长城科工贸有限公司;PHS-25数显pH计,上海精密科学仪器有限公司;DHG-9030 型电热恒温鼓风干燥箱,上海精宏实验设备有限公司;D8 Advance型X射线衍射仪,德国布鲁克公司;UV-2450/2550紫外-可见分光光度计,岛津国际贸易上海有限公司;722N型可见分光光度计,上海精密科学仪器有限公司.
1.2 实验方法
1.2.1 催化剂的制备
取一定量的七水合硫酸亚铁溶于蒸馏水中,磁力搅拌下,逐滴加入1 mol/L的氢氧化钠溶液及一定浓度的四硼酸钠溶液,室温下反应8 h,过滤,恒温干燥12 h,制得掺硼α-FeOOH.
1.2.2 甲基橙降解
取一定量的甲基橙配成50 mg/L的储备液备用,实验用H2O2以质量分数30 %的H2O2配制而成,以0.01 mol/L高锰酸钾溶液标定.称取一定量羟基氧化铁置于烧杯中,加入一定量的甲基橙溶液,一定浓度的H2O2,调节溶液pH,密封,在一定温度下定时反应,定时取样,于甲基橙最大吸收波长463 nm处测其吸光度,计算甲基橙的降解率.
1.2.3 溶铁量测量
以本实验选取的最佳条件下进行溶铁实验.以邻菲罗啉分光光度法测量反应后溶液中铁浓度.
1.3 掺硼α-FeOOH催化剂表征
产品的X射线分析采用德国布鲁克公司D8型X射线衍射仪;在扫描电镜(SEM)下观察掺硼α-FeOOH的形貌;用722N型分光光度计在波长463 nm处测定t时刻溶液中MO的吸光度;用UV-2450/2550紫外-可见分光光度计观察催化降解过程;FT-IR测定催化剂表面官能团.
1.4 掺硼α-FeOOH催化活性评价方法
按一定比例将掺硼α-FeOOH和H2O2混合,在一定温度下测定t时刻反应体系中MO的吸光度,根据稀溶液MO的吸光度与其浓度成正比的关系计算t时刻MO的浓度.MO降解率计算公式如下:
ηD=(ρ0-ρt)/ρ0×100 %
(1)
式中:ηD为甲基橙降解率,%;ρ0为甲基橙的初始质量浓度,mg/L;ρt催化降解tmin后甲基橙质量浓度,mg/L.
2 结果与讨论
2.1 掺硼α-FeOOH催化剂表征
2.1.1 X射线衍射分析
样品的晶型及物相特征采用 X 射线衍射仪(XRD)测定.管电压 45 kV,管电流 150 mA,步长 0.02,扫描范围 10°~90°,速率5°/min.
图1为α-FeOOH和掺硼α-FeOOH的XRD图谱.从图1(b)可知:掺硼的α-FeOOH在21.23°,33.23°,36.23°,41.635°,53.78°和78.87o处有明显的吸收峰,对应的晶面指数为(110),(130),(111),(140),(221)和(151).与图1(a)α-FeOOH的图谱对比,掺硼后吸收峰的位置基本不变,无明显新增吸收峰,但(111)衍射峰强度增加,可见掺硼后并未明显改变α-FeOOH的晶型.


图1 α-FeOOH和掺硼α-FeOOH的XRD图谱
2.1.2 电子扫描显微镜分析(SEM)
无掺杂和掺硼α-FeOOH[m(B)/m(Fe)=0.02]样品的SEM照片如图2所示.

图2 α-FeOOH和掺硼α-FeOOH的SEM照片
由图2可看出:无掺杂α-FeOOH产物为棒状或近棒状,直径约为35~50 nm,长径长度约为400~500 nm,分散度高,粒度较均一.而硼掺杂的α-FeOOH产物为纺锤形,直径约为30~40 nm,多数微粒长径长度约为300~450 nm,小于100 nm的微粒占了一定比例,粒度范围较宽.分散度较高、粒度均一.
2.1.3 傅里叶变换红外光谱分析
样品表面的官能团采用傅里叶变换红外光谱仪(FT-IR)进行分析.样品处理采用溴化钾压片法,将样品与 KBr 按一定比例在红外灯下混合研磨至均匀,12.5 MPa 压力下保持 1 min 左右压制成透明薄片,供测试用.对无掺杂α-FeOOH和掺硼的α-FeOOH进行对比分析,两种样品的红外谱图如图3所示.
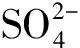
2.2 影响MO催化活性的因素及机理探讨
2.2.1 不同掺硼量的α-FeOOH催化性能对比
称取0.2 g自制的不同掺硼比的羟基氧化铁置于烧杯(标注1~6)中,加入15 mL(50 mg/L)的MO,20 mL(3.2 mol/L)的H2O2溶液,20 mL去离子水,调节溶液pH=2.45左右,密封,在80 ℃下反应,每隔5 min取样,测MO的吸光度,根据吸光度计算其降解率.
由图4可知,掺杂硼的α-FeOOH的催化活性明显优于无掺杂的α-FeOOH.在同等条件下用不改性的α-FeOOH作为催化剂降解甲基橙,降解率仅为73.4 %.随着硼铁比的增加,降解率有所提高.掺杂了硼的各个样品催化性能的对比显示,硼铁的质量比为0.02时催化剂的催化活性最高,甲基橙的降解率达97.5 %.

图4 不同掺硼量的掺硼α-FeOOH降解甲基橙对比
2.2.2 温度的影响
将一定量的掺硼α-FeOOH加入盛有50 mg/L的MO的小烧杯中使催化剂质量浓度为3.665 g/L,加入的H2O2浓度为3.2 mol/L,封口后分别置于20、35、50、65、80、95 ℃水浴锅中,溶液pH为2.43,边搅拌边降解,考察不同时间MO降解情况,结果见图5.由图5可知温度对MO降解率有较大影响.随着温度的由低到高MO的降解率逐渐升高,当温度到达80 ℃时,经过25 min MO降解率高达99.6 %.这主要有两方面的原因:一方面高温能促进·OH产生;另一方面,升高温度,反应物分子的运动速度加快,提高反应物之间的碰撞频率和不同相间的传质速率,从而提高了MO降解率.但温度升高到95 ℃时MO降解率没有明显提高.综合考虑,适宜温度为80 ℃.
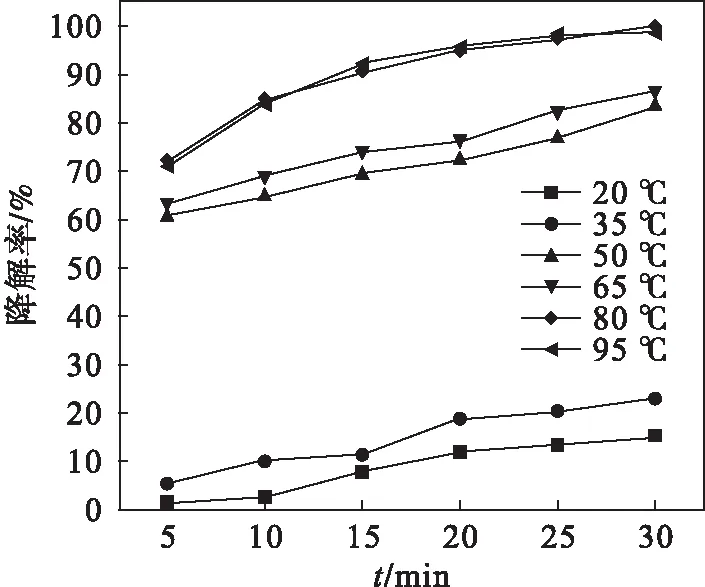
图5 降解率与温度的关系
2.2.3 催化剂用量的影响
图6为催化剂投入量对MO降解率的影响.其他条件为降解最佳条件:温度80 ℃,pH=2.43,H2O2浓度3.2 mol/L.从图6可以看出:掺硼后的催化剂的降解率基本都高于无掺杂的羟基氧化铁.当催化剂的投入量小于3.665 g/L时,随着投入量的增加MO降解率增大;而当催化剂的质量浓度高于3.665 g/L时,随着催化剂量的增加MO降解率减小.催化剂的加入是催化产生自由基的必要条件,在无催化剂条件下,H2O2难以分解产生自由基,当催化剂的质量浓度过低时,自由基的产生量和产生速度都很小,降解过程受到抑制;当催化剂用量高于一定时,由于催化剂的表面吸附作用,降解反应中的一些物质吸附在催化剂表面,阻碍了催化剂与H2O2作用,影响羟基自由基的产生,使MO降解率下降.因此投入适量的催化剂有利于反应的进行,从而提高降解效率.

图6 催化剂用量与降解率的关系
2.2.4 pH值的影响
当讨论pH的影响时,其他条件为降解最佳条件:温度80 ℃,催化剂质量浓度3.665 g/L,H2O2浓度3.2 mol/L.MO在不同pH值下的降解结果见图7.

图7 溶液pH值与降解率的关系
Fenton试剂在酸性条件下才能发生作用,在中性或碱性环境中一些自由基清除剂的浓度较高,导致催化产生的·OH被清除,从而影响了降解率;而且由于甲基橙的酸式结构呈对醌式结构,较易于降解,其碱式结构为偶氮苯结构,较稳定.而当溶液呈酸性时,溶液中H+质量浓度较高,自由基溶液稳定性较差,随着pH值的增加,溶液中OH-的质量浓度增加,容易引发链反应,促进自由基的自分解,同时碱度增加时,自由基自分解速度也加快,从而限制了甲基橙的进一步降解.当pH值为2.43时,反应25 min,MO的降解率达99.6 %,因此pH值为2.43最适宜.
2.2.5 H2O2浓度的影响
讨论H2O2浓度时其他反应条件为降解最佳条件:温度80 ℃,催化剂质量浓度3.665 g/L,pH=2.43.随着H2O2浓度的增加,MO的降解率逐步提高,当浓度达到3.2 mol/L时,25 min后降解率达到了99.6 %.继续增加其浓度,降解率反而降低,结果如图8所示.当H2O2浓度继续加大时降解率有所下降有两方面因素:一方面过量的H2O2是MO降解活性微粒·OH的捕获剂;另一方面H2O2浓度过高导致其与MO在催化剂表明形成竞争吸附反应式,如反应式(2)和(3).
·OH+·OH→H2O2
(2)
·OH+H2O2→H2O+HO2·
(3)
因此本实验的H2O2最佳浓度是3.2 mol/L.

图8 H2O2用量与降解率的关系
2.3 降解效果
MO降解过程的紫外-可见光光谱如图9所示.0 min时为未降解时MO的吸收光谱,随着时间的流逝,MO在最大吸收峰505 nm处的吸收峰逐渐减弱,并最终消失,由于紫外的吸收峰的强弱与所测样品的浓度成正比例关系,说明MO发生了降解.

图9 催化过程中紫外-可见光吸收光谱
2.4 使用寿命
图10为掺硼α-FeOOH重复利用效果,催化剂在使用后,经过去离子水多次洗涤后,恒温干燥处理,循环使用考察其再利用效果.由图10可以看出催化剂的活性变化不大,由此可见掺硼的α-FeOOH催化剂具有较好的催化活性和稳定性.

图10 催化剂的循环利用效果
2.5 溶铁量的测定
为确认MO的降解是否是由于溶铁导致的Fenton反应,在最佳条件降解MO体系中,采用邻菲罗啉检测溶铁的浓度,结果如图11所示.图11实验结果表明:掺硼α-FeOOH质量浓度为3.665 g/L时,溶铁质量浓度为0.148 g/L,溶铁的量很少,对MO降解的作用很小,基本可以忽略.说明该反应中占主体作用的是非均相Fenton反应.

图11 铁标液曲线
羟基氧化铁在与空气或溶液中的水接触时,其表面会发生羟基化反应[15]
>Fe+·OH→>FeOH
(4)
(>FeOH是羟基氧化铁的表面活性位的一种)可能的反应机理是经过针铁矿颗粒表面的铁循环[16-17],即首先氢在催化剂(如氧化铁矿物)表面以Haber-Weiss机制产生羟基自由基·OH:
>FeOH+H2O2→
·OH+OH-+>FeOH+
(5)
然后吸附于催化剂表面的有机化合物被羟基自由基氧化:
>FeOH+MO+·OH→产物
(6)
式中:>FeOH是指氧化铁矿物表面羟基.
3 结 论
(1) 采用空气氧化法制备掺硼α-FeOOH,具有较好的纺锤体结构.掺入没有明显改变α-FeOOH 的晶相,明显改变了α-FeOOH的微观形貌.
(2) MO的降解率受催化剂用量、H2O2浓度、反应的pH值和温度影响.在催化剂质量浓度为3.665 g/L,H2O2浓度为3.2 mol/L,pH=2.43,温度为80 ℃时,在反应25 min后降解率高达99.6 %.
(3) 掺硼α-FeOOH可多次使用,重复5次后甲基橙降解率在98 %以上,使用次数对其催化能力的影响不大,掺硼α-FeOOH具有重复利用的可能性.
[1] 汪珊,孙继朝,张宏达,等.我国水环境有机污染现状与防治对策[J].海洋地质动态,2005,21(10):5-10.
[2] 岳舜琳.城市供水水质问题[J].中国给水排水,1997,13(S1):35-38.
[3] PARRA S,GUASAQUILLO I,ENEA O,et al.Abatement of an Azo Dye on Structured C-Nafion/Fe-Ion Surfaces by Photo-Fenton Reactions Leading to Carboxylate Intermediates with a Remarkable Biodegradability Increase of the Treated Solution [J].J Phys Chem B,2003,107(29):7026-7035.
[4] 郑展望,雷乐成,张珍,等.非均相UV/Fe-Cu-Mn-Y/H2O2反应催化降解4BS染料废水[J].环境科学学报,2004,24(6):1032-1038.
[5] LI Y,ZHANG F S.Catalytic Oxidation of Methyl Orange by an Amorphous FeOOH Catalyst Developed from a High Iron-Containing Fly Ash [J].Chemical Engineering Journal,2010,158(2):148-153.
[6] KEENAN C R,SEDLAK D L.Factors Affecting the Yield of Oxidants from the Reaction of Nanoparticulate Zero-Valent Iron and Oxygen [J].Environ.Sci.Technol,2008,42(4):1262-1267.
[7] WU J J,MURUGANANDHAM M,YANG J S,et al.Oxidation of DMSO on Goethite Catalyst in the Presence of H2O2at Neutral pH [J].Catalysis Communications,2006,7(11):901-906.
[8] CUDENNEC Y,LECERF A.The Transformation of Ferrihydrite into Goethite or Hematite,Revisited [J].Journal of Solid State Chemistry,2006,179(3):716-722.
[9] FENG J Y,HU X J,YUE P L.Discoloration and MINERALIZATION of Orange Ⅱ Using Different Heterogeneous Catalysts Containing Fe:a Comparative Study [J].Environ.Sci.Technol.,2004,38 (21):5773-5778.
[10] 马军,张涛,陈忠林,等.水中羟基氧化铁催化臭氧分解和氧化痕量硝基苯的机理探讨[J].环境科学,2005,26(2):78-82.
[11] SIVAKUMAR M,GEDANKEN A,ZHONG W,et al.Nanophase Formation of Strontium Hexaferrite Fine Powder by the Sonochemical Method Using Fe(CO)5[J].Journal of Magnetism and Magnetic Materials,2004,268(1):95-104.
[12] FAN H L,SONG B Z,LIU J H,et al.Thermal Formation Mechanism and Size Control of Spherical Hematite Nanoparticles [J].Materials Chemistry and Physics,2005,89(2):321-325.
[13] WANG K J,XING B S.Mutual Effects of Cadmium and Phosphate on Their Adsorption and Desorption by Goethite [J].Environm Ental Pollutions,2004,127(1):13-20.
[14] 胡珊.掺硼铁氧化物性质及其对有机污染物的光催化降解效果研究[D].湖北:华中农业大学,2011:53 .
[15] 吴大清,刁桂仪,魏俊峰,等.矿物表面基团与表面作用[J].高校地质学报,2000,6(2):225-232.
[16] LI X,CHEN C,ZHAO J.Mechanism of Photodecomposition of H2O2on TiO2Surfaces under Visible Light Irradiation [J].Langmuir,2001,17(13):4118-4122.
[17] 蒋蓉,孙振亚,吴吉权.氧氢氧化铁在水处理及环境修复中的应用研究 [J].武汉理工大学学报,2007,29(8):70-74.

