中药蜣螂酶解提取工艺及抗肿瘤药效研究
曹广超 刘春雨 刘 颖 刘玉慧 李梓欣 王集会 史 磊
(山东中医药大学药学院,山东 济南 250355;*山东中医药大学实验中心,山东 济南 250355)
蜣螂是鞘翅目金龟子科昆虫屎壳螂CatharsiusmolssusLinnaeus的干燥全虫,在全世界范围分布十分广泛。蜣螂性味咸寒,有毒,归肝、胃、大肠经,被列为活血、散瘀、通肠化结、消肿解毒之品,具有定惊、破淤、通便、攻毒之功效,常用于惊痫癫狂、大便秘结、淋病、各种癌症、肝脾肿大等病症治疗[1,2]。蜣螂作为药用最早记载于《神农本草经》,而后在历代本草中多有记载。现代药理研究表明:蜣螂具有抗癌的功效[3,4],蜣螂的醇提取物对人体肝癌细胞有抑制作用,其有效成份主要分布在腿部[5]。为深入研究蜣螂粉不同酶提取物在抗肿瘤方面的抑制效果。本文以蜣螂冻干粉为底物,采用4种蛋白酶进行水解,以蜣螂粉水提取物作为对照组,采用茚三酮法测定蛋白质的水解度并利用MTT法研究水提物对肺腺癌细胞A549的抑制效果,评价4种蛋白酶对蜣螂粉的水解效果,研究蜣螂粉水提物的抗肿瘤方面的药效。
1 实验材料
1.1 仪器
半微量凯式定氮仪;UV9100B分光光度计(北京莱伯泰科仪器有限公司);Memmert CO2培养箱(北京五洲东方科技发展有限公司)。
1.2 试剂
胰蛋白酶(上海碧云天生物技术有限公司);弹性蛋白酶(上海源叶生物科技有限公司);磷酸氢二钠,磷酸二氢钾(分析纯,国药集团试剂有限公司);RPMI-1640培养基、无水乙醇(AR)、胎牛血清(赛默飞世尔生物制品北京有限公司);注射用顺铂(齐鲁制药有限公司);MTT(武汉市盖云天生物技术有限公司);茚三酮(上海源聚生物科技有限公司);磷酸氢二钠,磷酸二氢钾(分析纯,国药集团上海化学试剂有限公司)。
1.3 药材
本实验所使用的蜣螂粉,购自山东临沂市。(批号:20160701)
1.4 实验细胞
肺腺癌A549细胞株由山东省立医院提供。
2 方 法
2.1 蜣螂粉的酶解工艺
精密称取蜣螂粉5份,每份1.000 0 g,分别置100 mL具塞锥形瓶中,按料液比1∶40加入定量蒸馏水,超声提取20 min,按表1进行处理。抽滤后以3000 r/min离心10 min,定容至100 mL容量瓶得蜣螂酶解液。将酶解液平均分成两份,一份用于蛋白质水解度的测定,另一份经干燥冷冻得冻干粉,用于做抗肿瘤药理性试验。
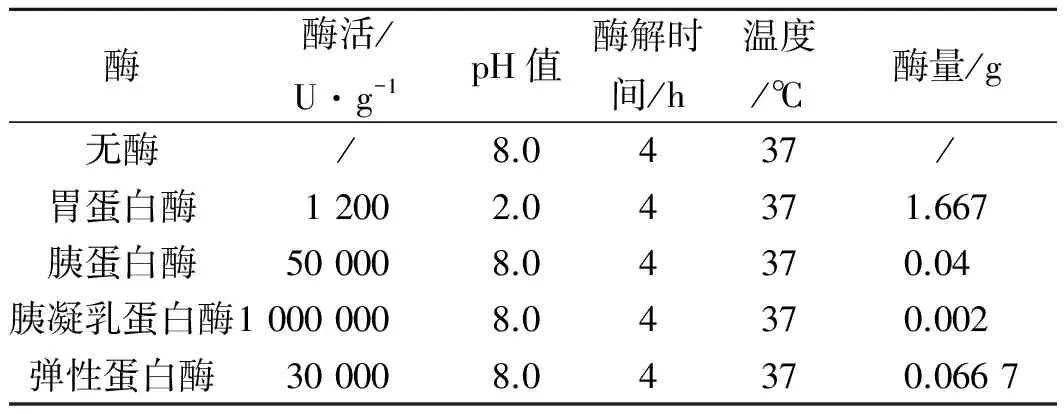
表1 四种蛋白酶的水解条件Table 1 Hydrolysis conditions of four kinds of protease
2.2 氨基肽氮含量的测定
2.2.1茚三酮显色剂的配制
精密称取茚三酮0.5 g、果糖0.3 g、磷酸二氢钾6 g、磷酸氢二钠10 g,加入适量的蒸馏水溶解,定容至100 mL容量瓶中,以做备用。
2.2.2标准曲线的绘制
精密称取0.100 0 g干燥失重过的甘氨酸为标准品,加适量蒸馏水溶解后定容至100 mL容量瓶中,然后取2 ml定容到100 mL容量瓶中,得到20 μg/mL的溶液。分别取1、2、3、4、5 mL加适量蒸馏水定容至10 mL容量瓶中,配制浓度分别为2,4,6,8,10 μg/mL的标准溶液。分别从中取2 mL标准液于具塞试管中,加入1.00 mL新配制的显色剂,同时做空白实验,混合均匀后用沸水浴加热15 min,冷水冷却后加入5mL 40%的乙醇溶液,混合均匀后放置15 min,在570 nm波长处测定吸光度A,绘制其标准曲线。
2.2.3样品含量测定
从“2.1”步骤中的5份蜣螂粉酶解液的容量瓶中,取适量定量地稀释到适宜的浓度,按照“2.2.2”步骤中的方法测定样品的吸光度A及绘制的标准曲线计算-NH2的含量,然后再乘以相应的稀释倍数,可以得水解液中总-NH2肽氮的含量。
2.3 水解度的测定
水解度[6](Degree of Hydrolysis,简称DH)是指蛋白质水解过程中被裂解的肽键数与给定蛋白质总肽键数的比值。用茚三酮法按照2.2项下测定水解液中的游离氨基肽键含量和用半微量凯氏定氮法[7]测定原料中总氮量,同时设置空白对照组,再按下式计算水解度。
水解度(DH) % =已水解的肽键数/原料中总肽键数×100%=[( B-C) / ( A-C)]×100%
A:原料中的总氮数 B:水解液中的氨基氮数 C:原料中游离的氨基氮数
2.4 MTT法测定水解物对的抑制率
2.4.1提取物溶液的配制
精密称取原药材2%的蜣螂冻干粉,溶解于10 mL 1640培养液,配成含有效成分2 mg/mL的初始浓度,在无菌条件下用0.22 μm的滤膜进行过滤,然后用已滤菌的1640培养基依次进行稀释,配成2、1、0.5、0.25、0.125 mg/mL的药物浓度梯度。
2.4.2细胞培养
①细胞复苏[8]:从超低温冰箱中取出冻存的肺腺癌细胞,迅速投入到预先加热到37 ℃的灭菌水中,等待冻存液溶化,离心,收集细胞,然后用含10%胎牛血清的1640新鲜培养基在37 ℃、5%CO2培养箱中培养。②接种:待细胞生长至80%融合时,以0.25%的胰酶细胞消化液(含0.02%EDTA)进行消化,以每孔100 μL接种于96孔培养板,预留三个调零孔,调零孔只加不含血清的1640培养基,不加细胞,在37℃、5%CO2培养箱中培养。
2.4.3MTT法测定细胞抑制率
待96孔板中的细胞长满单层后,弃掉培养基,调零组、空白对照组分别加入100 μl不含血清的1640培养基,阳性对照组加入100 μg/mL的顺铂100 μL,其他给药组每孔分别加入不同浓度的药物100 μL,每个浓度的药物重复5个孔,其中以蜣螂水提液作为对照组。然后细胞在37 ℃、5% CO2培养箱中继续培养。24 h后,每孔加入5 mg/mL MTT溶液20 μL于培养箱内避光反应4 h。吸去上清液,加入100 μl DMSO,用酶标仪在490 nm处测定OD值,按照下式计算药物对细胞的抑制率。
细胞抑制率(%)=[1-(加药组OD-调零组)/(空白组OD-调零组)]×100%
3 结 果
3.1 氨基肽氮含量的测定
3.1.1标准曲线的绘制
在测定氨基酸肽氮的含量时,茚三酮法是一种非常灵敏的常用方法,用此方法与甘氨酸标准溶液显色后,用紫外分光光度计在570 nm波长处测定一定浓度梯度的甘氨酸标准溶液的吸光度A,然后以吸光度A为横坐标,甘氨酸标准溶液的质量M1(μg)为纵坐标,绘制标准曲线回归方程为M1=22.017A+0.0452,r2=0.9993,又因甘氨酸的相对分子质量为75.07,所以以吸光度为横坐标,以-NH2的质量M2(μg)为纵坐标,其回归方程为M2=46.925A+0.0964,r2=0.9993。
3.1.2样品含量测定结果见表2

表2 水解液中氨基肽氮的含量Table 2 Content of amino nitrogen in Hydrolysate
由表2的数据可知胰蛋白酶对蜣螂粉酶解水提液中-NH2的含量最高,其次是弹性蛋白酶、胰凝乳蛋白酶,胃蛋白酶水提液-NH2的含量最少。
3.2 样品水解度的测定
采用半微量凯氏定氮法测定1.000 0 g蜣螂粉中总氮量为29.57 mg。根据2.3下的水解度测定公式计算得出四种蛋白酶的水解度如图1所示。
如图1可知胰蛋白酶的水解度最大,DH=24.98%,其次是弹性蛋白酶DH=24.03%,胰凝乳蛋白酶DH=22.16%,胃蛋白酶的水解度最小,DH=13.95%。

图1 四种蛋白丁敏的水解度Fig 1 Hydrolysis degree of four kinds of proteases
3.3 MTT法测定样品对肺腺癌细胞A549的抑制率
不同浓度梯度下5种蜣螂粉水提液对肺腺癌细胞A549的抑制率曲线如图2所示。横坐标为不同药物的浓度(mg/ml),纵坐标为水解液对A549的抑制率(%)。由图可知弹性蛋白酶、胰蛋白酶、胰凝乳蛋白酶水解液对肺腺癌A549细胞有明显的抑制作用,且抑制率曲线呈上升趋势,即抑制率随浓度的增大而增大,而且抑制率显著低于蜣螂粉水解液对照组。胃蛋白酶水提液对肺腺癌A549细胞几乎没有抑制作用。

图2 5种蜣螂水解液对乳腺癌MFC-7细胞的抑制曲线Fig 2 Inhibition curves of 5 kinds of Catharsius hydrolysate on on lung adenocarcinoma A549
4 讨 论
经研究表明,酶解提取工艺在中药领域具有广泛的应用,具有提取效果较好,周期短,反应温和等优点。本次实验利用四种不同的酶将蜣螂粉酶解,在测定水解度的基础上,进一步采用MTT法来检测抗肿瘤活性。结果表明,胰蛋白酶、弹性蛋白酶和胰凝乳蛋白酶的水解度分别为26.62%、24.99%、21.76%,在较低药物浓度下,酶解蜣螂粉对肺腺癌A549无明显抑制作用,而在较高浓度下,酶解蜣螂粉对肺腺癌A549的抑制率大小中,胰凝乳蛋白酶>弹性蛋白酶>胰蛋白酶。其次在用MTT法测定5种蜣螂提取物对肺腺癌细胞A549的抑制率试验中,酶解液对肺腺癌A549的抑制效果均低于未酶解的水提液,酶解蜣螂的药理性活性显著降低的原因可能是:发生药理活性的物质不同。与酶解其他中药虫类药物不同的是在酶解中药蜣螂时,使蜣螂的大分子蛋白降解为小分子的多肽、寡肽,使能发挥药理活性的大分子蛋白遭到破坏,进而药理活性降低。
本研究表明,水解度与抗肿瘤活性无直接相关性,因为酶解相当于在体外模仿人体胃肠道对药物的作用效果因此说明以中药蜣螂粉为有效成分的药物,经口服后在对肺腺癌A549的治疗上无显著的作用。为下一步蜣螂抗肿瘤活性成分及蜣螂加工方法的改进提供新思路,为临床用药提供新途径。
[1] 谢宗万.全国中草药汇编(上册)[M].北京:人民卫生出版社,1996:910.
[2] 黄显章,丁生晨,袁林,王旭,郝鹏飞,张景景. 蜣螂水提取物的镇痛抗炎作用[J]. 中华中医药学刊,2016,(09):2 191~2 194.
[3] Ahn MY,Hahn BS,Ryu KS,et al.Purification and characterization of a serine protease: (CPM-2) with fbrinolytic activity from thedung beetles[J].Arch Pharm Res,2005,28(7) : 816~822.
[4] 赵兴梅,朱敏,杨明,等.蜣螂抗实验性前列腺增生作用研究[J].中药药理与临床,2006,22(5) :37~38.
[5] 刘纯益.关于昆虫抗癌物质的研究概况[J].昆虫知识,1979,16(4) :182.
[6] 赵新淮,冯志彪.蛋白质水解物水解度的测定[J].食品科学,1994,(11):65~67.
[7] 中国药典2010年版.一部[S].2010:附录53~54.
[8] 司徒镇强,吴军正.细胞培养[M].西安:世界图书出版公司,1996:138.

