黑曲霉糖化酶基因克隆及在酿酒酵母中的表达
刘加爱,陈 蕾,林元山,张小鹃,邹洪彬,张学文
(湖南农业大学 生物科学技术学院,湖南 长沙 410128)
糖化酶又称葡萄糖淀粉酶或γ-淀粉酶,学名为α-1,4-葡萄糖水解酶(α-1,4-Glucanglucohydrolase),是目前最重要的工业酶制剂之一[1]。糖化酶是水解淀粉产生葡萄糖的主要酶类,作为一种外切型糖苷酶,从淀粉链的非还原性末端切开α-1,4-糖苷键连接的非还原端,水解成葡萄糖单元。因此,糖化酶被广泛地应用于食品、制酒、医药、有机酸、抗生素、氨基酸等发酵工业,是我国用量最大的酶制剂产品。
许多学者利用基因工程和分子生物学的手段对糖化酶基因进行了克隆、转化及表达的研究[2-6]。通过基因工程改造该基因、改良工程菌株等,以提高酶的发酵生产效率或改善酶的适用性[7-10]。但未见黑曲霉糖化酶分泌性表达相关的报道。本研究利用RT-PCR从黑曲霉中克隆了其glaA基因cDNA,经过改造除去了其信号肽区的编码序列后将其克隆到酵母pVT102U/α表达载体上乙醇脱氢酶(ADH1)强启动子下游[11],并与α因子信号肽αMFL融合,以实现糖化酶的高效分泌表达。α胞外信号肽能有效将蛋白质分泌到细胞外,可以更有效保证酶的向外分泌,使表达蛋白更易分离制备。
1 材料和方法
1.1 材料与试剂
1.1.1 试验材料 黑曲霉(Aspergillusniger)、受体菌大肠杆菌DH5α、酿酒酵母S78和质粒酵母表达载体pVT102U/α由湖南农业大学生物科学技术学院实验中心保存。pMD18载体和基因操作相关的酶均购自TaKaRa公司。总RNA提取试剂盒和反转录试剂盒、基因操作相关的试剂盒购自北京天根生物技术公司。其他常规化学试剂为国产分析纯产品。
1.1.2 培养基 PDA培养基:马铃薯200 g,葡萄糖20 g,琼脂15~20 g,水1000 mL;酵母完全培养基YPD:1%酵母提取物,2%胰蛋白胨,2%葡萄糖;YSD培养基:以 YNB为基础补加2%葡萄糖,再按质粒的基因标记补加营养缺陷所需的亮氨酸、腺嘌呤、肌醇、2% 琼脂;YPS筛选培养基:2%可溶性淀粉,1%酵母粉,2%蛋白胨,2%琼脂。
1.2 试验方法
1.2.1 cDNA文库的构建与筛选鉴定 TRIzol法提取黑曲霉总RNA,根据GenBank中已登录的糖化酶基因序列设计并合成引物,软件预测氨基酸序列(图1)。通过RT-PCR技术得到糖化酶基因cDNA,试剂盒纯化回收后与pMD18克隆载体16 ℃过夜连接,热激转化E.coliDH5α感受态细胞,在LB/Amp抗性平板上筛选阳性克隆。获得重组质粒并测序。
1.2.2 重组表达载体的构建 由于表达载体自身带有胞外信号肽α因子[12],根据软件预测的糖化酶基因信号肽位点和选用载体的酶切位点XbaⅠ、HindⅢ设计引物,从pMD18-glaA上扩增glaA除去信号肽后的编码序列,用XbaⅠ和Hind Ⅲ双酶切glaA和pVT102U/α,胶回收目的片段,16 ℃过夜连接后,热激转化E.coliDH5α感受态细胞,在LB/Amp抗性平板上筛选阳性克隆。试剂盒提取质粒,双酶切后电泳检测并测序。质粒构建过程见图2。
1.2.3 重组表达载体LiAc法转入酿酒酵母S78 挑取3~4 mm S78单菌落接种于5 mL YPD液体培养基,30 ℃,250 r/min过夜培养。以1∶100接种到50 mL YPD液体培养基,30 ℃,250 r/min,培养至OD值0.4~0.6。5 000 r/min,室温离心5 min,将收集的菌体用1×TE洗涤。离心,将细胞重悬于2 mL LiAc/TE缓冲液中,室温放置30 min。在EP管中混合新制备的酵母感受态细胞100 μL,10 μL carrier DNA和0.1~1.0 g pVT102U/α-glaA,700 μL 40% PEG4000,于 42 ℃热激 7 min,转化后的酵母悬浮液离心并重新悬于200 μL 1×TE缓冲液中,取50 μL涂布于YSD平板上[13]。30 ℃,培养3~4 d。

加粗字体为信号肽序列;普通字体为其编码的氨基酸序列。The bold font is a signal peptide sequence;The ordinary font is encoded by the amino acid sequence.
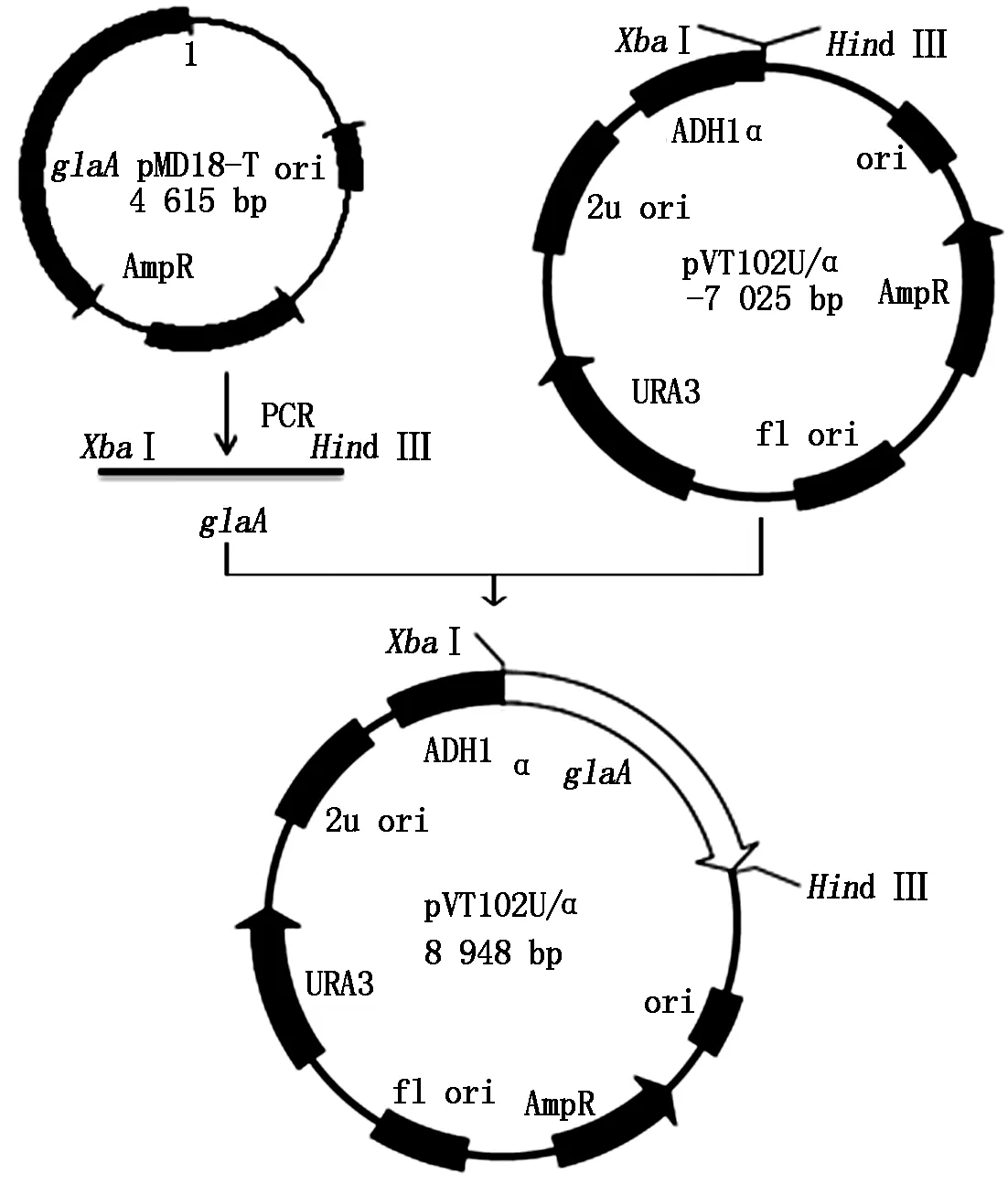
图2 重组酵母表达糖化酶质粒构建流程图Fig.2 The flow chart of yeast expression recombinant vector construction
1.2.4 S78转化子的PCR鉴定与活性筛选 挑取YSD平板上的菌落溶于20 μL去离子水中,取10 μL用反复冻融法对酵母细胞进行破壁处理后,进行PCR扩增。扩增反应体系为25 μL,包括上下游引物各1 μL,12.5 μL Mix,3.5 μL菌液,其余用水补足,以未转化的S78鉴定作对照。扩增程序:95 ℃预变性5 min;然后以94 ℃变性30 s、58 ℃退火30 s、72 ℃延伸2 min进行30个循环;72 ℃终延伸10 min,4 ℃保存。反应完成后,取20 μL反应产物进行1%琼脂糖凝胶电泳,观察结果。
用接种环挑取菌P结果正确的S78转化子点种于2%可溶性淀粉平板上,30 ℃,培养2~3 d。用碘液染色后,筛选出有透明水解圈的转化子。通过计算水解圈与菌落直径的比值挑选出比值最大的重组转化子用于后期酶活的研究。
1.2.5 重组酿酒酵母S78的表达与SDS-PAGE电泳 重组酿酒酵母S78在YPD液体培养基中培养72 h后,离心后收集上清液。取20 μL样品与5 μL 5×上样缓冲液混合,沸水浴5 min后,离心取上清全部点样。蛋白胶用考马斯亮蓝G250染色30 min,再脱色30 min[14]。
1.2.6 重组糖化酶酶活检测 以2%可溶性淀粉为底物,采用DNS法[15]测定糖化酶的活性。取0.2 mL待测酶液,加入0.8 mL 2%可溶性淀粉溶液作为反应底物(用 pH值5.6,0.1 mol/L乙酸缓冲液配制),70 ℃恒温水浴锅反应5 min。用0.5 mol/L NaOH溶液灭酶活。加入DNS试剂2 mL,沸水反应5 min后冷却定容至20 mL,测定波长540 nm处光度值。
2 结果与分析
2.1 黑曲霉糖化酶基因的克隆及检测
根据NCBI数据库中糖化酶基因的序列分析,glaA的长度为1 923 bp。提取黑曲霉总RNA后,通过RT-PCR技术,用高保真PfuDNA聚合酶扩增得到黑曲霉中糖化酶的cDNA序列约1.9 kb(图3),与理论相符。PCR产物经纯化试剂盒纯化回收后,与克隆载体pMD18相连转入大肠杆菌E.coliDH5α感受态细胞,提取阳性克隆后,送至武汉生工公司测序。测序结果表明,与数据库发表的glaA序列相似性为100%,证明已克隆得到黑曲霉糖化酶基因。
2.2 酵母重组表达载体pVT102U/α-glaA的构建与鉴定
glaA与 pVT102U/α连接转化后,在LB/Amp抗性平板上挑取单菌落于LB液体培养基中培养,提取质粒后经双酶切,得到约1.9 kb的产物(图4)。证明酵母重组表达载体pVT102U/α-glaA构建成功。

M.5.0 kb分子量标准;1.pVT102U/α-glaA双酶切;2.未酶切pVT102U/α-glaA;3.pVT102U/α空质粒。M.5.0 kb DNA Marker;1.pVT102U/α-glaA digested with Xba Ⅰand Hind Ⅲ;2 .pVT102U/α-glaA without digestion;3.pVT102U/α plasmid.
2.3 阳性克隆PCR与筛选结果
pVT102U/α-glaA通过热激法转入酿酒酵母S78菌株,YSD营养缺陷型培养基筛选。从转化平板上挑取转化子利用反复冻融法破壁后,进行Conoly PCR鉴定(图5)。同时,将转化子点种于YPS平板上,30 ℃培养3 d后,碘液染色观察(图6)。转化子菌落附近出现了大小不一的透明水解圈,证实基因成功转入酿酒酵母S78,并能分泌有生物学活性的酶。
2.4 表达产物的SDS-PAGE及电泳分析
SDS-PAGE分析可见,糖化酶分子质量大约为80 kDa。由于载体带有胞外信号肽α因子(图7),不需要进行细胞破碎,可直接取发酵液离心后的上清液进行试验。避免了破壁过程中蛋白结构的破坏,保证了外源蛋白的完整性。
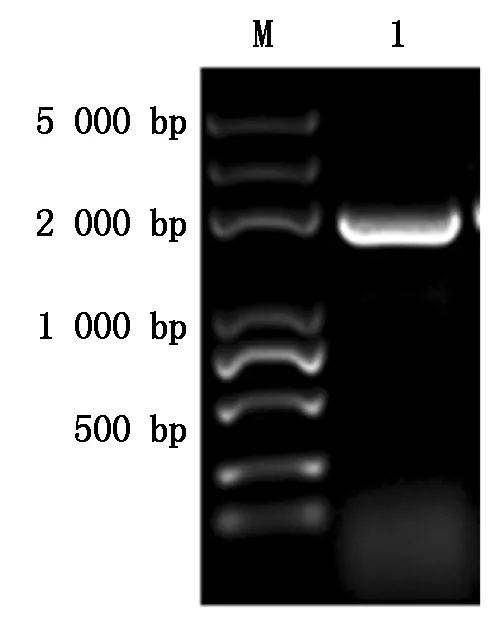
M.5.0 kb分子量标准;1.菌落PCR产物。M.5.0 kb DNA Marker;1.Yeast colony PCR product.

A.酵母S78;B.转入pVT102U/α-glaA的酵母S78。A.Yeast S78;B.Transformed yeast S78.

M.蛋白质分子质量标准;1~3.发酵24,48,72 h的粗酶液;4.空白对照。M.Protein molecular Marker ;1-3.Fermented 24,48,72 h of the crude enzyme solution respectively;4.CK.
2.5 重组酵母糖化酶活的测定
经摇瓶发酵培养,每24 h取样测定糖化酶酶活大小。如图8所示重组酿酒酵母发酵72 h,酶活达到最大值28.86 IU/mL(图8)。由图9可知,重组糖化酶在pH值6条件下,酶活力最大;由图10可知,重组糖化酶的最适反应温度为60 ℃,随着温度的升高,酶活力有所下降。
3 结论与讨论
目前,糖化酶的工业化生产仍然受到很大的制约,其最主要的原因就是虽然黑曲霉是优良的生产糖化酶的菌株,但野生黑曲霉菌株产酶水平较低,体现在淀粉水解时间比较长,发酵周期也受到其制约。杨丽娟等[16]采用基因改造的方法,将改造后的菌株与出发菌株生产糖化酶的产量及活性进行测定,发现酶活有所提高。本研究选用的pVT102U/α载体是优良的酵母分泌型表达载体,最大的一个特点就是其具有乙醇脱氢酶(ADH1)启动子,是在酵母中表达的强启动子,活性受乙醇抑制,有利于利用酵母轻发酵高效表达糖化酶基因。在本试验中,发酵时间以72 h为最佳,延长摇瓶发酵时间明显降低酶的活性,可能就是由于72 h后乙醇的产生对启动子活力的抑制引起的。这也说明在利用ADH1启动子表达蛋白时,控制发酵时间很重要。王海燕等[17]构建了ADH1启动子和终止子引导表达的载体,使α-淀粉酶基因和糖化酶基因高效共表达,与酵母表达常用的甲醇诱导启动子相比,发酵过程不需要甲醇诱导表达[18],解决了产物商业化的问题,在食品医药方面将有很好的应用。克隆除去糖化酶基因自身信号肽,并与载体上的胞外信号肽α-MFL融合,将蛋白质分泌到细胞外,可以提高目标蛋白的分泌活性,使表达蛋白更易分离制备,避免了细胞破碎分离纯化酶过程造成破坏。

图8 不同发酵时间的糖化酶酶活Fig.8 Glucoamylase activity in fermentation liquid in different fermentation time

图9 不同pH值条件下的糖化酶酶活力Fig.9 Glycosylase activity in fermentation liquid at different pH
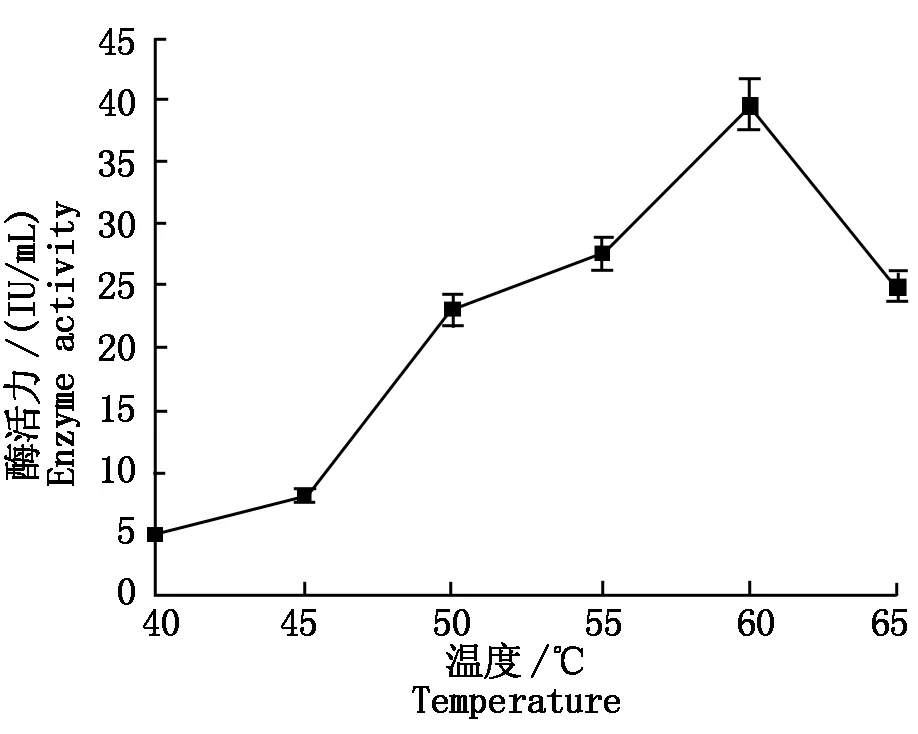
图10 不同温度条件下的糖化酶酶活力Fig.10 Glycosylase activity in fermentation liquid at different temperature
重组酿酒酵母在YPD培养基中摇瓶发酵72 h,一般发酵酶活为28.86 IU/mL。在高温(60 ℃)和最适pH值6条件下,产生的糖化酶酶活最高为39.98 IU/mL,比同类研究的酶活高出较多[19-20]。本试验采用普通摇瓶发酵,存在着通气不佳,影响了菌体的高密度生长及表达。因此,如果采用发酵罐发酵,通过调整通气量、温度、培养时间等,对重组酵母菌株的发酵条件进行进一步优化,可能进一步提高酶活和表达效率。
[1] 黎卫强.糖化酶在食品工业中的应用研究进展[J].沿海企业与科技,2010,20(4):65-66,64.
[2] Acourene S,Ammouche A.Optimization of ethanol,citric acid,and alpha-amylase production from date wastes by strains ofSaccharomycescerevisiae,Aspergillusniger,andCandidaguilliermondii[J].Journal of Industrial Microbiology & Biotechnology,2012,39(5):759-766.
[3] 郭彦言,王红蕾,左小明,等.糖化酵母糖化酶基因在酿酒酵母中的克隆与表达[J].安徽农业科学,2015,38(22):8-10.
[4] Favaro L,Jooste T,Basaglia M,et al.Codon-optimized glucoamylases GAI ofAspergillusawamoriimproves starch utilization in an industrial yeast[J].Applied Microbiology and Biotechnology,2012,95(4):957-968.
[5] 徐荣燕,张亚波,谢 晨,等.疏绵状嗜热丝孢菌糖化酶基因(gla)的克隆及在毕赤酵母中的表达[J].农业生物技术学报,2010,18(2):362-367.
[6] 姚婷婷,王衍敏,顾建龙,等.携多拷贝glaA的重组黑曲霉过量合成糖化酶的研究[J].生物工程学报,2006,22(4):9.
[7] 曹慕琛,徐健勇,罗立超,等.黑曲霉糖化酶基因的克隆及其在毕赤酵母X33中的表达[J].安徽农业科学,2011,39(14):8226-8230.
[8] 王 强,徐义兵,郭春和,等.黑曲霉糖化酶基因在毕赤酵母X33中的高效表达[J].中国畜牧兽医,2012,39(4):21-24.
[9] Sidra,Pervez,Nadir,et al.Phenotypic and molecular characterization ofAspergillusspecies for the production of starch-saccharifying amyloglucosidase[J].Annals of Microbiology,2015,65(4):2287-2291.
[10] 张水龙,陈 东,曹树威,等.黑曲霉木聚糖酶基因xynB的克隆及在酿酒酵母中的表达[J].广西科学,2013,20(2):148-151.
[11] 林志楷,叶冰莹,潘海芳,等.pVT102U/α-bgln重组真核表达质粒的构建和鉴定[J].福建师范大学学报:自然科学版,2007,23(2):17.
[12] 杜济良,赵洪亮,薛 冲,等.不同信号肽对胞外β-(1,3)-葡聚糖酶在巴斯德毕赤酵母中表达的影响[J].生物技术通讯,2010,21(6):12.
[13] 崔铁忠,卢康荣,李银霞,等.酿酒酵母遗传缺陷型菌株化学转化方法研究[J].现代生物医学进展,2016,16(8):1420-1423.
[14] 张贺迎,武金霞.耐热糖化酶的分离纯化及部分性质[J].食品研究与开发,2007,28(9):10.
[15] 林 艳,马莹莹,张宿义,等.米曲糖化酶活力测定方法的比较研究[J].酿酒科技,2015,161(6):23-27.
[16] 杨丽娟,余少文.黑曲霉高产糖化酶的分子水平研究方法概论[J].食品研究与开发,2016,37(8):204-208.
[17] 王海燕,秦浚川,王敖全,等.黑曲霉酸性α曲淀粉酶基因和糖化酶基因对工业酒精酵母的整合及其共表达[J].微生物学报,2004,44(4):483-486.
[18] 施慧琳,孙靖淳,张荣凯,等.电子嗅在线反馈控制毕赤酵母糖化酶发酵过程中甲醇浓度新方法的应用[J].中国生物工程杂志,2016,36(3):68-76.
[19] 汤 斌,钱 鹏.黑曲霉糖化酶基因在毕赤酵母中的克隆和表达[J].食品与发酵工业,2012,38(6):53-56.
[20] 唐国敏,钟丽婵,杨开宇,等.具有糖化酶活性的工业啤酒酵母菌的构建及其发酵特性[J].生物工程学报,1996,12(4):489-491.

