H2S在拟南芥响应紫外线中的作用
赵航卫,张远耕,韩 雨,李炳聪,刘志强
(山西大学 生命科学学院,山西 太原 030006)
硫化氢(Hydrogen sulfide,H2S)是一种无色、易燃、带有臭鸡蛋气味的酸性气体,浓度较高时会对生物体产生毒性。1989年,科学家检测到人脑中的内源H2S含量为0.7 μg/g,大鼠脑中达1.6 μg/g,推断H2S可能存在一定的生理作用[1]。H2S是具有亲水性和亲脂性的两性分子,能够自由穿越生物膜,现已成为第3种气体信号分子,其在生物体内的生理功能备受关注[2-3]。已有研究表明,H2S参与调节植物生长发育的多种过程,如促进种子萌发和根形态建成[4-8],增加叶绿素含量[7]和光合作用[9],延缓花的衰老[10]等。此外,H2S在植物响应各种非生物胁迫中发挥着重要作用[2]。
植物内源H2S可以是以半胱氨酸(Cys)为底物,由半胱氨酸脱巯基酶(Cysteine desulfhydrases,CDes)催化Cys降解产生[11];也可以通过叶片吸收大气中的H2S获得;或者在亚硫酸盐还原酶的作用下,将SO32-直接还原生成H2S。硫酸盐、亚硫酸盐、Cys、以羰基相连的含硫化合物和SO2均可作为H2S合成的底物[12]。目前,植物中主要研究的CDes包括以L-Cys为底物的LCD和DES及以D-Cys为底物的DCD[13],其中,LCD定位于细胞核,DCD定位于线粒体,DES定位于细胞质[14];鉴于L-Cys是植物体内Cys的主要存在形式,推测以L-Cys为底物的CDes是内源H2S生成的主要贡献者[15-16]。
紫外(UV)辐射的增强对地球生命系统有着多方面的影响,生命系统特别是植物系统,对较强的UV辐射有明显的响应[17]。较强的UV辐射会使植物的光合能力下降,农作物的植株变矮、开花延迟、产量降低,种子萌发受抑制[18-20],叶绿素和光合系统Ⅱ(PSⅡ)受损[17,21-22],植株器官的碳库分配平衡被改变[20,23-24],蛋白质含量下降等。UV辐射会引起DNA损伤和基因突变,植物受到较强UV辐射会提高相关抗性基因的表达[25]。随着臭氧层的日益破坏,环境中的紫外辐射不断增加,UV-C对植物的伤害逐渐引起人们的关注。
拟南芥经紫外胁迫及生理浓度H2S处理后,通过检测植株的丙二醛含量、叶片的叶绿素含量、光合特性相关指标以及谷胱甘肽合成基因和DNA损伤修复相关基因表达变化,研究紫外胁迫下H2S对拟南芥的损伤修复作用,旨在为H2S及其制剂在农业生产中的应用提供一定的理论依据。
1 材料和方法
1.1 材料培养及处理
试验材料为哥伦比亚野生型拟南芥Col-0(WT)以及H2S产生酶LCD基因(At3G62130)突变体lcd和DES基因(At5G28030)突变体des。野生型和突变体材料处理方式如表1所示。UV波长254 nm,强度60 μW/cm2。

表1 拟南芥紫外线与H2S处理Tab.1 Treatment with UV and H2S of Arabidopsis
1.2 生理指标的测定
1.2.1 丙二醛(MDA)含量的测定 称取鲜质量为0.75 g的样品,加入0.75 mL 5%的TCA溶液研磨,匀浆后8 000 r/min离心10 min。取0.5 mL上清,加0.5 mL 0.67%的TBA溶液,在100 ℃水浴30 min,冷却后10 000 r/min离心5 min。分别测定上清在450,532,600 nm处的吸光度值A[26]。
MDA含量(mmol/g)=(6.45×(A532-A600)- 0.56×A450) ×Vt/(Vs×W)
①
式中,Vt为提取液总体积(mL),Vs为测定用提取液体积(mL),W为样品质量(g)。
1.2.2 叶绿素含量的测定 取新鲜植物叶片,擦干净表面,剪去叶中脉,只取叶片。称取一定质量的叶片,记为W,加少量的石英砂及1 mL 95%乙醇,研磨成匀浆,8 000 r/min离心1 min。取上清稀释10~20倍,分别测定665,649 nm处的吸光度值A[27]。
叶绿素a浓度(Ca)=13.95×A665- 6.88×A649
②
叶绿素b浓度(Cb)=24.96×A649- 7.32×A665
③
叶绿素a含量=Ca×V/(1 000×W)
④
叶绿素b含量=Cb×V/(1 000×W)
⑤
总叶绿素含量=Ca×V/(1 000×W)+Cb×V/(1 000×W)
⑥
式中,V为提取液总体积(mL),W为样品质量(g)。
1.2.3 光合特性指标的测定 使用CB-1102便携式光合蒸腾仪(北京雅欣理仪科技有限公司)检测净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)和胞间二氧化碳浓度(Ci)(测定时要求光源充足且稳定,空气中CO2含量稳定[28])。
1.3 基因表达检测
1.3.1 TRIzol法提取拟南芥RNA与反转录 取0.05 g的样品于研钵中,加入1 mL TRIzol溶液,研磨成匀浆,在室温下静置5 min,离心取上清;加入0.2 mL氯仿,振荡15 s并静置2 min。在4 ℃下12 000 r/min离心15 min,取上清;加入0.4 mL异丙醇并混匀,-20 ℃静置10 min。在4 ℃下12 000 r/min离心10 min,弃上清;加入1 mL 75%乙醇,轻轻洗涤沉淀,去乙醇并晾干,加入25 μL DEPC H2O溶解[29]。以RNA为模板,以Oligod(T)为引物,建立反转录体系,反应程序为:42 ℃ 30 min,85 ℃ 5 min[30]。
1.3.2 RT-qPCR 用Bio-Rad CFX96荧光定量PCR仪进行Quantitative real-time PCR检测。数据采集与分析使用IQ5软件,以UBQ(At5G20620)为内参,采用2-ΔΔCt计算基因相对表达量[30-31]。基因表达检测引物如表2所示。

表2 RT-qPCR引物Tab.2 The list of RT-qPCR primers
2 结果与分析
2.1 紫外胁迫下H2S对拟南芥MDA含量的影响
紫外线照射会对植物造成氧化损伤,细胞膜脂质过氧化产生MDA,且MDA含量(以鲜质量计)与膜脂的过氧化程度呈正相关[32-33],其可作为衡量氧化损伤的指标。本试验测量MDA含量来探究紫外线对拟南芥的损伤以及H2S的修复作用。UV处理20 min拟南芥体内的MDA含量升高,自然光培养24 h后MDA含量下降,但黑暗条件培养的植株MDA含量没有显著下降;生理浓度外源H2S处理24 h可降低MDA含量,并且在光照条件下作用更加明显。LCD+UV+L处理和LCD+UV+D处理的MDA含量间无明显差异,但二者较LCD+UV都有所降低;DES+UV+L处理和DES+UV+D处理的MDA含量较DES+UV处理降低,并且光照条件下比黑暗条件下降低;DES+UV处理的MDA含量较WT+UV处理增加,LCD+UV处理较WT+UV处理减少(图1)。
2.2 紫外胁迫下H2S对拟南芥叶片叶绿素含量的影响
叶绿素是吸收可见光谱中特定波长光的有色分子,主要吸收蓝光和红光,叶绿素分子由吸收光的卟啉环和使叶绿素固定在类囊体膜上的疏水性叶绿醇组成。叶绿素易被氧化或还原,高强度(≥180 μW/cm2)的紫外照射会破坏叶绿素,而低强度的紫外可提高叶绿素含量[19],通过测量叶绿素含量可探究H2S在拟南芥响应紫外线中的作用。

CK. 未处理的WT;UV. 紫外处理;L. 自然光;D. 黑暗处理;LCD和DES分别表示对应基因的突变体;不同小写字母表示各处理组间差异显著性(P<0.05)。图2-3同。
CK.Untreated WT; UV.Ultraviolet treatment; L.Natural light; D.Dark; LCD and DES.Respectively the corresponding mutant gene;Lowercase letters expressing the significant difference between the treatment groups(P<0.05). The same as Fig.2-3.
图1紫外胁迫下H2S在光照和黑暗下对拟南芥体内MDA含量的影响
Fig.1TheeffectsofH2SonMDAcontentsinArabidopsisunderlightordarkafterUVstress
由图2-A可知,与CK相比,UV处理后的植株叶绿素a含量都升高,其大小依次为:WT+UV+D+H2S >WT+UV+L+H2S=WT+UV+L=WT+UV+D>WT+UV;LCD+UV+D>LCD+UV+L = LCD+UV;DES+UV+L > DES+UV+D>DES+UV。
由图2-B可知,不同处理叶绿素b的含量WT+UV+D=WT+UV+D+H2S>WT+UV+L+H2S=WT+UV+L>WT+UV=CK;LCD+UV+D>LCD+UV>LCD+UV+L;DES+UV+L>DES+UV+D>DES+UV。
由图2-C可知,不同处理总叶绿素的含量:WT+UV、WT+UV+L+H2S、WT+UV+D+H2S、WT+UV+L高于CK,其中,WT+UV+D+H2S最高;LCD+UV+D>LCD+UV>LCD+UV+L;DES+UV+L和DES+UV+D较DES+UV增加。

图2 紫外胁迫下H2S在自然光和黑暗下对拟南芥叶片叶绿素的含量的影响Fig.2 The effictes of H2S on chlorophyll content of Arabidopsis leaves under light or dark after UV stress
2.3 紫外胁迫下H2S对拟南芥光合特性的影响
紫外照射可以影响植物叶片中的叶绿素含量,破坏植物叶片的栅栏组织、海绵组织及气孔的细胞结构和形态,破坏细胞的氧化还原和碳—氧平衡,进而影响植物的光合作用,所以,通过对光合作用特性参数的测定来探究紫外胁迫下H2S对拟南芥光合作用的影响。
不同处理净光合速率(Pn)的大小顺序为,CK=WT+UV=WT+UV+L=WT+UV+L+H2S>WT+UV+D+H2S = WT+UV+D;LCD+UV=LCD+UV+L>LCD+UV+D;DES+UV=DES+UV+L>DES+UV+D,说明拟南芥净光合速率在黑暗条件下比光照下低(图3-A)。
不同处理蒸腾速率(Tr)的大小顺序为,CK=WT+UV+L+H2S>WT+UV+D+H2S =WT+UV+L>WT+UV = WT+UV+D;LCD+UV=LCD+UV+L>LCD+UV+D;DES+UV=DES+UV+L=DES+UV+D,表明UV能明显降低拟南芥的蒸腾速率,光照和H2S均能缓解UV引起的蒸腾速率下降(图3-B)。
UV处理会减小拟南芥野生型和突变体材料的气孔导度(Gs),光照能增加拟南芥的气孔导度,光照和黑暗处理对外源和内源H2S均无明显影响(图3-C)。对于胞间CO2浓度(Ci),UV处理后拟南芥胞间CO2浓度升高,且突变体高于野生型(图3-D)。
2.4 紫外胁迫下H2S对GSH合成和DNA修复基因表达量的影响
紫外照射会导致植物DNA链上2个相邻嘧啶核苷酸的共价联结,形成嘧啶二聚体,直接损害DNA;还会诱导植物细胞产生活性氧自由基,间接损害DNA。谷胱甘肽(GSH)是清除活性氧的重要物质。GSH1和GSH2基因编码合成谷胱甘肽,PARP1和PARP2编码DNA损伤修复酶基因。本试验通过检测上述基因mRNA水平的变化来探究H2S对紫外胁迫的缓解作用。
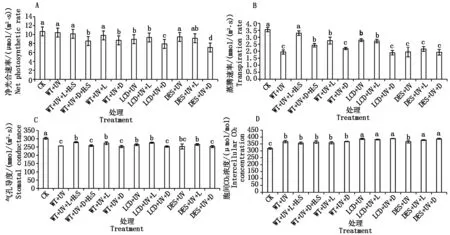
图3 在紫外胁迫下H2S对拟南芥光合特性的影响Fig.3 The effects of H2S on the photosynthetic characteristics of Arabidopsis after UV stress
拟南芥于UV处理后培养24 h,GSH1转录水平在光照或黑暗培养条件下均升高,与H2S处理无关;GSH2转录水平在黑暗条件下的升高与H2S处理无关,但是光照条件下H2S处理可诱导GSH2转录升高;PARP1只在H2S处理的黑暗培养下表达升高;而PARP2在黑暗培养下表达升高,但与H2S处理无关(图4)。

图4 紫外胁迫下H2S对相关基因表达量的影响Fig.4 The effect of H2S on related gene expression after UV stress
2.5 H2S和UV对植物的生理影响的可能机制
根据其他相关研究及本试验的结果,获得H2S和UV对植物的生理影响模式图(图5),图中实线表示紫外线的作用,虚线表示H2S的作用。

“→”和“┬”分别表示促进和抑制。“→” and “┬”represent promotion and inhibition respectively.
3 结论与讨论
本研究结果表明,60 μW/cm2的紫外(波长254 nm)照射20 min可增加拟南芥体内MDA浓度和叶绿素a的含量,对叶绿素b含量无明显影响;对净光合速率(Pn)无明显影响,会降低拟南芥的蒸腾速率(Tr)和气孔导度(Gs),提高拟南芥的胞间CO2浓度(Ci);降低GSH2基因表达。H2S可以降低紫外引起的MDA升高;在黑暗培养下增加叶绿素a、叶绿素b和总叶绿素含量;缓解紫外照射引起的蒸腾速率(Tr)下降,不影响净光合速率(Pn)、气孔导度(Gs)和胞间CO2浓度(Ci);促进GSH2和PARP1合成基因的表达量响应紫外照射。
紫外照射会增加植物体内MDA浓度,紫外照射后拟南芥光照或黑暗处理24 h,MDA浓度均下降,即植物自身可以修复紫外线对其的氧化损伤;H2S处理可进一步降低MDA浓度;试验所用lcd是H2S产生酶编码基因LCD表达下调的突变体,des是H2S产生酶编码基因DES缺失突变体[11]。des突变株经紫外照射后MDA含量均大于相同条件处理后的野生型和lcd,表明内源H2S对紫外氧化损伤有明显的缓解作用。
植物可以根据光照强度的改变来调整自身的基因选择性表达,进而改变植株内的蛋白质含量来适应光强度的改变[34-37]。小于30 min的UV-B辐射(55 μW/cm2)会提高拟南芥叶片的叶绿素含量[19],光通量密度在3 975~5 300 μW/cm2的自然光也能够增加叶绿素含量[35];用30 W的紫外灯(UV-C)处理早熟禾,小于6 h的处理可使叶绿素含量上升[38];本试验表明,适度的紫外照射能够增加叶绿素a和总叶绿素含量,黑暗下H2S可进一步提高叶绿素a和总叶绿素含量[39],对叶绿素b含量无显著影响。
H2S可以显著促进4 ℃低温处理的白菜幼苗净光合速率(Pn)[40],而本试验中,各处理后的Pn表现为:WT+UV+D+H2S=WT+UV+D>LCD+UV+D>DES+UV+D,表明内源H2S对UV引起的Pn下降有缓解作用,但外源H2S对Pn无明显影响。
本试验中,蒸腾速率(Tr)的大小顺序为:WT+UV+L+H2S>WT+UV+L=LCD+UV+L>DES+UV+L,说明若要缓解UV引起的拟南芥Tr的减少,需要有H2S的存在,H2S在此方面可能发挥着类似开关或门控的作用。
有研究表明,H2S处理诱导植物气孔孔径减小[41-43],本试验通过光合蒸腾仪检测得出,UV处理诱导拟南芥的气孔导度(Gs)下降,后续的H2S处理对Gs无明显影响,由于光合测定仪是通过采集CO2浓度、湿度、温度和光合有效辐射等数据经数据处理反应Gs,因此,本试验的结果与H2S促进气孔关闭的试验结果不一致。
甘草苗经0,10.2,15.8,21.2 μW/cm2辐射强度的UV-B处理75 d,其胞间CO2浓度(Ci)会有小幅增加[44],本试验UV-C处理20 min后拟南芥野生型和突变体的Ci都增加,H2S无明显影响。
本研究结果表明,当植物受到胁迫后,通过信号转导调节相关基因表达来响应和缓解胁迫,做出适应性改变。H2S对拟南芥AtGSH1和AtPARP2基因的转录无明显影响,诱导光照条件下AtGSH2转录升高;黑暗条件下AtPARP1升高,表明H2S对不同基因表达的调控需要不同的条件,即H2S基因表达调控的生理功能需要其他因素的协同作用,其作用机制还需要进一步的试验证据。
研究UV-B对拟南芥的损伤和H2S对拟南芥作用的报道很多,但是研究UV-C及UV-C和H2S对植物共同作用的报道却较少。本试验对H2S在拟南芥响应UV-C中的作用进行了初步探究,其结果可为H2S及其制剂在农业、园艺、林业等行业的使用提供一定的科学依据。
致谢:感谢山西大学生命科学学院裴雁曦老师及其课题组师兄师姐在试验及手稿撰写中的帮助。
[1] Goodwin L R, Francom D, Dieken F P, et al. Determination of sulfide in brain tissue by gas dialysis/ion chromatography: postmortem studies and two case reports[J]. Journal of Analytical Toxicology, 1989, 13(2): 105-109.
[2] 崔为体,沈文飚.植物中硫化氢的生理功能及其分子机理[J].生命的化学, 2012, 32(4): 385-389.
[3] Wang R. Physiological implications of hydrogen sulfide: a whiff exploration that blossomed[J]. Physiological Reviews, 2012, 92(2): 791-896.
[4] Zhang H, Dou W, Jiang C X, et al. Hydrogen sulfide stimulates β-amylase activity during early stages of wheat grain germination[J]. Plant Signaling & Behavior, 2010, 5(8): 1031-1033.
[5] 焦 浩.硫化氢调控胁迫条件下植物种子萌发及幼苗生长的信号机制[D].合肥:合肥工业大学, 2010.
[6] Zhang H, Tang J, Liu X P, et al. Hydrogen sulfide promotes root organogenesis inIpomoeabatatas,SalixmatsudanaandGlycinemax[J]. Journal of Integrative Plant Biology, 2009, 51(12): 1086-1094.
[7] 刘 颖,林 娟,周小丽,等. LED光照对拟南芥叶绿素含量和根生长发育的影响[J].复旦学报:自然科学版, 2013, 52(6): 762-767.
[8] 刘 辉,查日扬,马永周,等. H2S处理下对小麦根蛋白质组表达谱分析的研究[J].华北农学报, 2016, 31(S): 328-334.
[9] Chen J, Wu F H, Wang W H, et al. Hydrogen sulphide enhances photosynthesis through promoting chloroplast biogenesis, photosynthetic enzyme expression, and thiol redox modification inSpinaciaoleraceaseedlings[J]. Journal of Experimental Botany, 2011, 62(13): 4481-4493.
[10] Zhang H, Hu S L, Zhang Z J, et al. Hydrogen sulfide acts as a regulator of flower senescence in plants[J]. Postharvest Biology and Technology, 2011, 60(3): 251-257.
[11] Rausch T, Wachter A. Sulfur metabolism: a versatile platform for launching defence operations[J]. Trends in Plant Science, 2005, 10(10): 503-509.
[12] Papenbrock J, Riemenschneider A, Kamp A, et al. Characterization of cysteine-degrading and H2S-releasing enzymes of higher plants-from the field to the test tube and back[J]. Plant Biology, 2007, 9(5): 582-588.
[13] Alvarez C, Calo L, Romero L C, et al. An O-acetylserine(thiol)lyase homolog with L-cysteine desulfhydrase activity regulates cysteine homeostasis inArabidopsis[J]. Plant Physiology, 2010, 152(2): 656-669.
[14] Wirtz M, Droux M, Hell R. O-acetylserine (thiol) lyase: an enigmatic enzyme of plant cysteine biosynthesis revisited inArabidopsisthaliana[J]. Journal of Experimental Botany, 2004, 55(44): 1785-1798.
[15] 裴雁曦.植物中的气体信号分子硫化氢:无香而立,其臭如兰[J].中国生物化学与分子生物学报, 2016, 32(7): 721-733.
[16] 金竹萍,裴雁曦.植物H2S气体信号分子的生理功能研究进展[J].中国细胞生物学学报, 2013, 35(6): 880-886.
[17] 蔡锡安,夏汉平,彭少麟.增强UV-B辐射对植物的影响[J].生态环境, 2007, 16(3): 1044-1052.
[18] 王传海,郑有飞,万长建,等.紫外线UV-B增加对小麦开花及结实率的影响[J].农业环境保护, 2000, 19(4): 221-223.
[19] 李 元,王勋陵.紫外辐射增加对春小麦生理、产量和品质的影响[J].环境科学学报, 1998, 18(5): 504-509.
[20] 李晓阳,陈慧泽,韩 榕. UV-B辐射对拟南芥种子萌发和幼苗生长的影响[J].植物学报, 2013, 48(1): 52-58.
[21] 杨景宏,陈 拓,王勋陵.增强紫外线B辐射对小麦叶绿体膜组分和膜流动性的影响[J].植物生态学报, 2000, 24(1): 102-105.
[22] Brandle J R, Campbell W F, Sisson W B, et al. Net photosynthesis, electron transport capacity, and ultrastructure ofPisumsativumL. exposed to Ultraviolet-B radiation[J]. Plant Physiology,1977,60(1):165-169.
[23] Schumaker M A, Bassman J H, Robberecht R, et al. Growth, leaf anatomy, and physiology ofPopulusclones in response to solar ultraviolet-B radiation[J]. Tree Physiology, 1997, 17(10): 617-626.
[24] Feng H Y, An L Z, Chen T, et al. The effect of enhanced ultraviolet-B radiation on growth, photosynthesis and stable carbon isotope composition (δ13C) of two soybean cultivars (Glycinemax) under field conditions[J]. Environmental and Experimental Botany, 2003, 49(1): 1-8.
[25] 郑友飞.太阳紫外线(UV-B)对植物的影响[J].环境科学, 2000, 13(6): 341-346.
[26] 王学奎.植物生理生化实验原理和技术[M]. 2版.北京:高等教育出版社, 2006.
[27] 陈毓荃.生物化学实验方法和技术[M].北京:科学出版社, 2002.
[28] 印志同,宋海娜,孟凡凡,等.大豆光合气体交换参数的QTL分析[J].作物学报, 2010, 36(1): 92-100.
[29] 张继星,刘 鹏,黄凤兰,等.蓖麻总RNA提取[J].内蒙古民族大学学报:自然科学版, 2010, 25(1):38-39.
[30] 胡 昊,李进进,王彩云.反转录实时定量PCR在植物基因表达分析上的研究进展[J].中国农学通报, 2013, 29(15): 127-134.
[31] 袁 伟,万红建,杨悦俭.植物实时荧光定量PCR内参基因的特点及选择[J].植物学报, 2012, 47(4): 427-436.
[32] 陈忠林,马溪平,张利红,等. UV-C辐射增强对绿化树种膜质过氧化及抗氧化酶的影响[J].生态环境, 2006, 15(5): 1014-1017.
[33] 陈禹兴,付连双,王晓楠,等.低温胁迫对冬小麦恢复生长后植株细胞膜透性和丙二醛含量的影响[J].东北农业大学学报, 2010, 41(10): 10-16.
[34] 刘国顺,乔新荣,王 芳,等.光照强度对烤烟光合特性及其生长和品质的影响[J].西北植物学报, 2007, 27(9): 1833-1837.
[35] Sui X L, Mao S L, Wang L H, et al. Effect of low light on the characteristics of photosynthesis and chlorophyll a fluorescence during leaf development of sweet pepper[J]. Journal of Integrative Agriculture, 2012, 11(10): 1633-1643.
[36] 张 璐,张纪林,教忠意,等.不同光照条件下3种冬青属植物的光合特征日变化研究[J].西北植物学报, 2006, 26(3): 490-495.
[37] 郑元超,冯玉龙.西双版纳两种生态特性不同的外来草本植物对生长环境光强的适应策略[J].生态学报, 2005, 25(4): 727-732.
[38] 王 艳,张玉光,王兰兰,等.短期紫外线(UV-C)辐射对早熟禾生理特性的影响[J].草业科学, 2007, 24(2): 35-39.
[39] 岳 斌,裴雁曦,刘旦梅,等.气体信号分子H2S对拟南芥生长发育的影响[J].山西农业科学, 2017, 45(2): 178-182.
[40] 王鸿蕉,张丽萍,刘志强,等.外源硫化氢对冷胁迫下白菜幼苗生长和光合作用的影响[J].西北植物学报, 2015, 35(4): 780-786.
[41] 刘 菁,候智慧,赵方贵,等. H2S参与ABA诱导的蚕豆气孔关闭[J].西北植物学报, 2011, 31(2): 298-304.
[42] 李洪旺,车永梅,侯丽霞,等. Ca2+位于H2O2上游参与H2S诱导的拟南芥气孔关闭过程[J].植物生理学报, 2015, 51(1): 51-56.
[43] Hou Z, Wang L, Liu J, et al. Hydrogen sulfide regulates ethylene-induced stomatal closure inArabidopsisthaliana[J]. Journal of Integrative Plant Biology, 2013, 55(3): 277-289.
[44] 张 琪,王 俊,彭 励,等.中波紫外线辐射对甘草光合作用及有效成分积累的影响[J].农业科学研究, 2008, 29(1): 11-15.

