干旱胁迫对嫁接烤烟生长及生理特性的影响
谢 冰,向金友,饶在生,曹跃强,唐 明,袁继超,易 蔓
(1.四川农业大学 农学院,四川 成都 611130;2.四川省烟草公司宜宾市公司,四川 宜宾 644002;3.四川省宜宾市农业科学院,四川 宜宾 644600)
干旱是影响烟草生长发育的重要因子之一[1],其对烟株基因表达[2-4]、生理指标[5-7]、生长发育[8-9]、产量和品质[10-12]都有显著影响。前人研究发现,干旱胁迫下烤烟生长发育受阻,根系发育不良,叶片超氧化物歧化酶、过氧化氢酶活性降低,丙二醛含量升高,受干旱胁迫的烟株生长发育迟缓,株高、茎围等农艺性状变差,叶绿素含量降低,有效留叶数降低,叶片的长、宽不能得到有效生长,开片效果差,内在的烟碱、总糖、总氮等各种化学成分的协调性下降,各种致香物质发生变化,其产量和品质下降明显[6-7,13]。烤烟是我国重要的经济作物,对优化农村产业结构,增加烟农收入、推动烟区发展起到了积极作用[1],因此,开展烟草抗旱性、降低干旱对烤烟的影响研究备受重视。
围绕烟草抗旱栽培烟草科技工作者作了大量的研究工作,并获得了大批科学结论,主要集中在耕作制度的调整,元素营养合理搭配的调控,外源生化药剂的调控以及通过选用抗旱品种、蹲苗炼苗、合理密植等栽培措施的调控对烟草抗性的影响方面[1,14-15]。而嫁接作为一项传统且成熟的栽培措施,其既能同时发挥砧木和接穗的优势,又可以保持品种内在风格特点,还能提高品种抗性,因而常被用于提高作物抗性及改善花卉、果木的品质[16]。目前,关于嫁接诱导或改变烟草的抗性以及产质形成规律方面的系统研究报道还比较少[17-19],且为嫁接苗与自根苗(非嫁接苗)的对比,而关于异种嫁接与同种嫁接的对比研究报道更是鲜见报端,有鉴于此,本研究拟通过研究干旱胁迫下烤烟同种、异种嫁接的生长发育、抗性生理及干物质形成变化规律,以期为进一步完善烤烟嫁接技术研究、丰富烤烟抗逆栽培提供理论依据和技术支持。
1 材料和方法
1.1 试验地点
试验于2015-2016年在四川省宜宾市大坝烟草科技示范园区进行。采用盆栽试验,盆内径30 cm,深40 cm,每盆装干土15 kg,栽烟一株,株行距120 cm×60 cm,施肥量按75 kg/hm2纯氮,N∶P2O5∶K2O=1∶1.5∶3,施肥方式按当地优质烟叶生产技术方案执行。盆栽土为壤土,有机质28.8 g/kg,全氮1.6 g/kg,碱解氮186.3 mg/kg,全磷1.1 g/kg,速效磷21.4 mg/kg,全钾26.1 g/kg,速效钾153.6 mg/kg。
1.2 试验设计
试验品种:接穗为抗旱性弱的品种KRK26,砧木为抗旱品种K326和Anyan 2[20-22],试验品种分别由玉溪中烟种子有限责任公司和安徽农科院提供。
异根嫁接:指砧木接穗为不同品种:KRK26/K326、KRK26/Anyan 2;自根嫁接:指砧木接穗为同品种:KRK26/KRK26。
烤烟嫁接:接穗和砧木按湿润育苗技术规程育苗,接穗品种按正常的育苗时令播种,砧木比接穗早播种7 d。烤烟嫁接采用劈接法,即选取砧木,平切去顶芽,并在平切口中部向下垂直切开1.0~1.5 cm;同时选取接穗,从生长点向下3 cm左右切去,从两边切长度1 cm左右的平滑楔形,插入砧木切口内,将嫁接夹沿切口夹入,放回湿润盘内,及时遮荫保湿,嫁接苗长出1片新叶后即可移栽。
干旱处理[23]:试验采用盆栽防雨控水栽培,称重法人工控制土壤含水量。在烤烟生长的团棵期、旺长期、成熟期等几个关键生育期进行干旱处理,处理后5 d进行取样测定相关指标,共设3个处理水平:正常灌水(dr0):土壤含水率为最大田间持水量的70%~80%;轻度干旱(dr1):土壤含水率为最大田间持水量的50%~60%;严重干旱(dr2):土壤含水率为最大田间持水量的30%~40%,采用称重法进行控水处理。试验共3个品种,各品种每一处理20株,3次重复,共540株烟。4月28日移栽,5月28日进入团棵、6月12日进入旺长、7月12日进入成熟。
1.3 测定项目及方法
叶绿素相对含量采用SPAD测定仪测定,在最大叶片上随机选择5个点进行测定;分别于团棵期、旺长期和成熟期取样测定,每次每处理取样5株,将烟株根系部分放入网袋在水中浸泡18 h,去除杂质、泥土,采用WinRHIZO-2008根系分析系统分析扫描测定不同试验处理的根系形态;成熟期株高、节距、茎围等农艺性状分别用米尺和游标卡尺测定,叶片长宽用米尺测定,叶面积=长×宽×0.634 5;取最大叶片的叶肉用于各种酶活性测定,过氧化物酶活性采用愈创木酚法测定[24];过氧化氢酶活性采用紫外吸收法测定[24];超氧化物歧化酶活性采用氮蓝四唑(NBT)法测定[24];脯氨酸含量采用茚三酮比色法测定[24]。
1.4 数据处理
试验数据采用Excel 2007、SPSS statistics 20等进行整理、作图和统计分析。
2 结果与分析
2.1 干旱对嫁接烤烟根系形态的影响
2.1.1 对嫁接烤烟根系长度的影响 随着烟株的生长,根系长度增加(表1),成熟期根系的总长度是团棵期的3.18倍。干旱胁迫使烟株生长受阻,根系长度变短,干旱程度越重,根系长度越短,各嫁接组合和生育时期均表现为dr0>dr1>dr2。不过干旱胁迫下不同嫁接组合和生育时期间根系长度变短的幅度存在一定差异,如团棵期干旱胁迫,品种间嫁接组合根系总长度下降的幅度均小于自嫁苗。
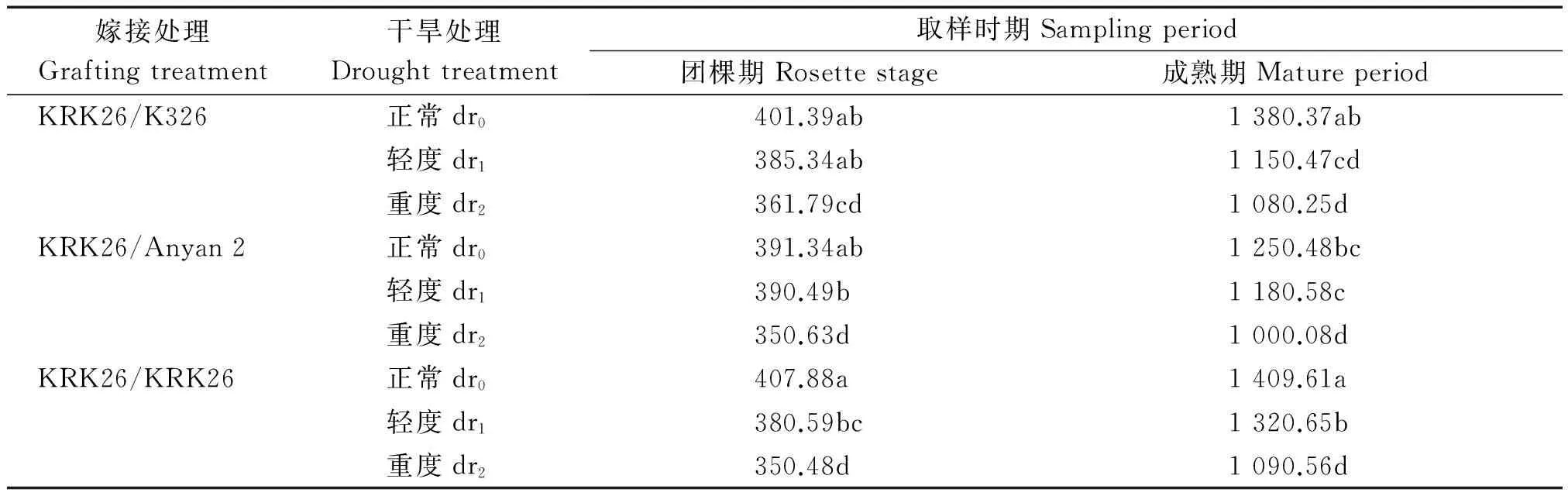
表1 干旱胁迫对嫁接烟株根系长度的影响Tab.1 Effects of drought stress on root length of grafting flued-tobacco cm
注:数字后不同字母表示数据间差异显著(P<0.05)。表2-7同。
Note:There was significant difference among the data after numbers(P<0.05).The same as Tab.2-7.
2.1.2 干旱对嫁接烤烟根系根数的影响 不同生育期干旱胁迫下,团棵期,异根嫁接KRK26/Anyan 2的根数小于自嫁苗KRK26/KRK26的,而KRK26/K326除轻度干旱根数较大外、其他均小于自嫁苗KRK26/KRK26,而成熟期,异根嫁接的根数却大于自嫁苗KRK26/KRK26(表2),这可能与生育前期异根嫁接烤烟接穗、砧木不同品种的亲和性较自根嫁接的差,其根系根数的生长发育受到限制,而随生育进程推进,砧木、接穗进一步融合,至成熟期异嫁苗遗传砧木、接穗的优势得到体现[5,18-19],导致异嫁苗根数超过自嫁苗;从干旱胁迫程度来看,各嫁接烟株根数大都以轻度干旱(dr1)胁迫下异根嫁接的最多,其次是正常灌水(dr0)处理,重度干旱(dr2)处理的最少,即轻度干旱对烟株发生新根有一定的促进作用,但重度干旱则抑制了新根的发生,导致根数降低。

表2 干旱胁迫对嫁接烤烟根数的影响Tab.2 Effects of drought stress on the number of root of grafting flued-tobacco
2.1.3 干旱对嫁接烤烟根系表面积的影响 干旱胁迫处理的烤烟根表面积变化规律与根长度的基本类似(表3)。不同生育时期,干旱胁迫处理的根系表面积均小于正常灌水处理,其中以重度干旱(dr2)处理的表面积最小,嫁接烤烟KRK26/K326、KRK26/Anyan 2的降低幅度小于自嫁烤烟KRK26/KRK26,特别是重度干旱胁迫下。在根系的3个形态指标中,以表面积受干旱胁迫的影响最大,3个嫁接组合平均,团棵期和成熟期轻度与重度干旱下根系表面积的下降幅度分别为10.3%,19.5%和11.4%,24.5%,而根数相应的平均升降幅度分别为10.2%与5.2%和9.7%与3.1%,根系总长相应的平均降幅分别为3.6%,11.4%和9.5%,21.5%。总体而言,KRK26/Anyan 2 3个根系指标受干旱胁迫程度的影响最小,自嫁苗KRK26/KRK26受影响程度最大,特别是根系表面积。
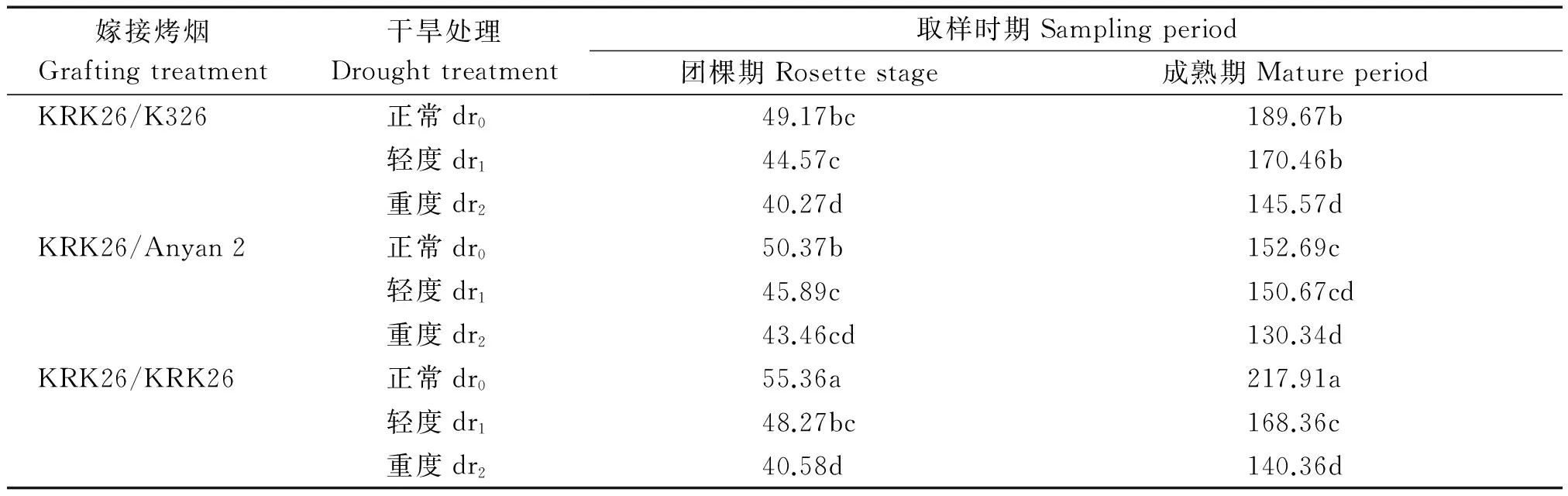
表3 干旱胁迫对嫁接烤烟根系表面积的影响Tab.3 Effects of drought stress on root surface area of grafting flued-tobacco cm2
2.2 干旱对嫁接烤烟成熟期地上部农艺性状的影响
不同干旱胁迫条件下,3个嫁接组合的有效叶数不存在显著差异,除有效叶数外,无论是异根嫁接烤烟还是自根嫁接的株高、节距、茎围、叶面积指数等性状指标均随干旱程度的加重而呈下降趋势,即干旱胁迫对植株形态的影响顺序为dr2>dr1>dr0(表4)。除叶面积指数、有效叶数外异根嫁接烤烟KRK26/K326、KRK26/Anyan 2的农艺性状指标变化幅度小于自嫁苗KRK26/KRK26,表明通过选择抗性强的品种作砧木与弱抗性品种进行异根嫁接能降低干旱胁迫对弱抗接穗品种农艺性状的影响。

表4 干旱胁迫对嫁接烤烟地上部植株农艺性状的影响Tab.4 Effects of drought stress on the agronomic shape of the upper part of grafting flued-tobacco
2.3 干旱对嫁接烟株生理指标的影响
2.3.1 干旱对叶片SPAD值的影响 烤烟叶片叶绿素含量能反映烟株营养状况和烟叶成熟度,而SPAD值是表征叶绿素含量最直接、有效的指标[25]。农业生产上,利用快捷、无损监测对象的SPAD仪可跟踪研究烤烟生长状况及判断成熟度。干旱胁迫下随着生育期的推进,烟叶SPAD值呈下降趋势(图1),而正常灌水时,SPAD值在旺长期出现峰值,到成熟期降低,呈现先升高后降低的倒马鞍形。团棵期干旱处理,叶片SPAD值有下降趋势,降低幅度小。到旺长期轻度干旱时,与正常灌水相比自嫁苗SPAD值降幅最大为28.7%,KRK26/Anyan 2降幅最低为25.8%;到成熟期严重干旱时,KRK26/K326、KRK26/Anyan 2、KRK26/KRK26分别下降了34.4%,30.5%,38.1%。在各生育期干旱胁迫条件下,异根嫁接苗的SPAD值高于自嫁苗,其中KRK26/Anyan 2最高,KRK26/K326次之。
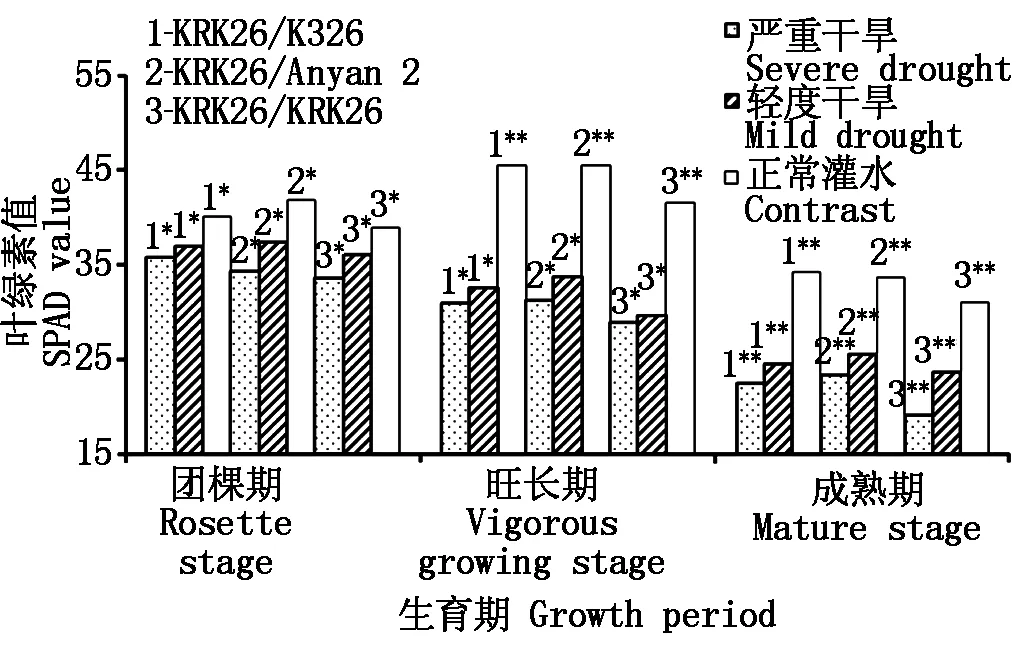
**、*.差异达极显著、显著水平。图2同。**.The difference was extremely significant level;*.The difference was significant level.The same as Fig.2.
2.3.2 干旱对叶片脯氨酸含量的影响 脯氨酸是一种重要渗透保护物质,其含量的高低反映了植物抗干旱胁迫的能力。脯氨酸能与蛋白质结合,在蛋白表面与水分子形成一层保护膜,束缚水分子向细胞外流动,减少水分散失,亲水性增强,从而增强作物的保水能力,增强其抗性[26-27]。由图2可知,在本研究中嫁接烤烟的各生育时期,脯氨酸含量随着干旱程度的加重而增加。从团棵期到成熟期,全生育期干旱处理脯氨酸含量呈增长趋势,尤其以旺长期增加幅度较大,而正常灌水增加不明显。其中,自嫁苗增加幅度明显小于其他2种嫁接苗,KRK26/Anyan 2增加幅度最大,KRK26/K326次之。成熟期严重干旱时KRK26/K326、KRK26/Anyan 2增加明显,分别较正常灌水提高6.1,6.3倍。干旱胁迫下,异根嫁接更能促进烟株脯氨酸的形成。
2.3.3 干旱对叶片SOD活性的影响 SOD是植物抵御活性氧侵害的一类重要酶,能清除超氧阴离子自由基,减少羟基自由基的形成[28]。随着烟株的生长,正常灌水的SOD活性呈抛物线变化,在旺长期达到最高值,而干旱胁迫下,其叶片的SOD活性逐渐降低,以团棵期最高,成熟期最低(表5),与自嫁苗相比,异嫁接苗的SOD活性均较高,其中以KRK26/Anyan 2提高幅度较大,与KRK26/KRK26相比,KRK26/Anyan 2在干旱处理下的SOD活性的平均提高幅度为20.9%(团棵期),36.7%(成熟期),66.2%(成熟期),而KRK26/K326相应的升幅为13.5%,27.7%,52.7%,表明与抗旱性强的品种嫁接可提高弱抗性品种对活性氧侵害的抵御能力。

图2 干旱胁迫对嫁接烟叶脯氨酸含量的影响Fig.2 Effects of drought stress on proline content of grafting flue cured-tobacco

表5 干旱胁迫对嫁接烟叶SOD活性的影响Tab.5 Effects of drought stress on SOD activity of grafting flue-cured tobacco U/(g·min)
2.3.4 干旱对叶片CAT活性的影响 CAT能清除植物体内过氧化氢,是与抗病力密切相关的酶类[29]。为此,研究该酶对阐明干旱胁迫对烟株生长发育的影响具有重要作用。在干旱胁迫时CAT活性随生长发育呈现下降的趋势(表6)。在各生育期KRK26/K326、KRK26/Anyan 2的活性均高于同品种自嫁苗,而KRK26/K326和KRK26/Anyan 2活性差异不显著。在团棵期和旺长期,CAT活性除团棵KRK26/K326的偏大外,总体表现为KRK26/Anyan 2>KRK26/K326>KRK26/KRK26;在成熟期严重干旱时,KRK26/Anyan2、KRK26/K326、KRK26/KRK26的CAT活性分别降为正常水平的70.3%,72.8%,66.5%。

表6 干旱胁迫对嫁接烤烟CAT活性的影响Tab.6 Effects of drought stress on CAT activity of grafting flue-cured tobacco U/(g·min)
2.3.5 干旱对叶片POD活性的影响 POD广泛存在于植物细胞中,在清除酚类、过氧化氢,促进醌类物质生成方面起到重要作用[30]。POD能增加细胞壁强度,进而形成一道结构屏障,增强对外界病原菌的抵抗力。从表7可以看出,在团棵期,POD活性随干旱程度的加重而增加,其中,KRK26/Anyan 2活性最高,自根苗最低,KRK26/K326居中;到旺长期时,各嫁接组合的酶活性随胁迫程度的加剧而降低。严重干旱条件下与正常灌水相比,3个嫁接组合在成熟期分别下降了14.9%,16.3%,23.3%。KRK26/K326和KRK26/Anyan 2的POD活性下降幅度较大,但其活性均高于KRK26/KRK26。
2.4 嫁接烤烟植株生长与抗旱生理指标的关系
烤烟长势、地上地下等外部形态指标作为表征内在生理特性变化的表征,干旱胁迫下,二者具有基本相同的变化趋势[31]。由表8,9可知,不同生育期,嫁接烤烟根系形态指标与SPAD值的相关性明显强于其他抗性指标,其中根系长度与SPAD值呈显著正相关,根表面积与SPAD值呈正相关关系。由表10可知,LAI与SOD、CAT呈显著正相关,与SPAD、POD呈极显著正相关,茎围、株高与SPAD呈显著或极显著正相关,而与SOD、CAT、POD相关性不显著。说明通过嫁接的烤烟地上地下形态指标与抗性指标的关系与非嫁接烤烟的变化大体一致[31]。

表7 干旱胁迫对嫁接烤烟POD活性的影响Tab.7 Effects of drought stress on POD activity of grafting flue-cured tobacco ×104U/(g·min)
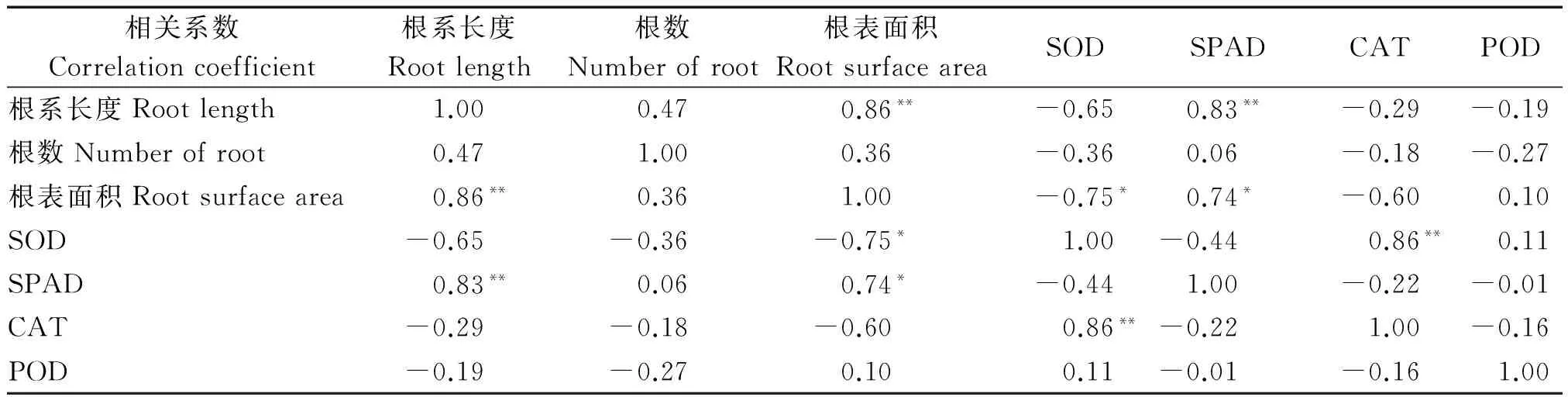
表8 嫁接烤烟团棵期根系与抗性指标相关分析Tab.8 Correlation analysis of root system and resistance index of grafting flue-cured tobacco in the rosette stage
注:**. 0.01 水平上显著相关;*.0.05 水平上显著相关。表9-10同。
Notes:**.Significant correlation at 0.01 level;*.Significant correlation at 0.05 level.The same as Tab.9-10.
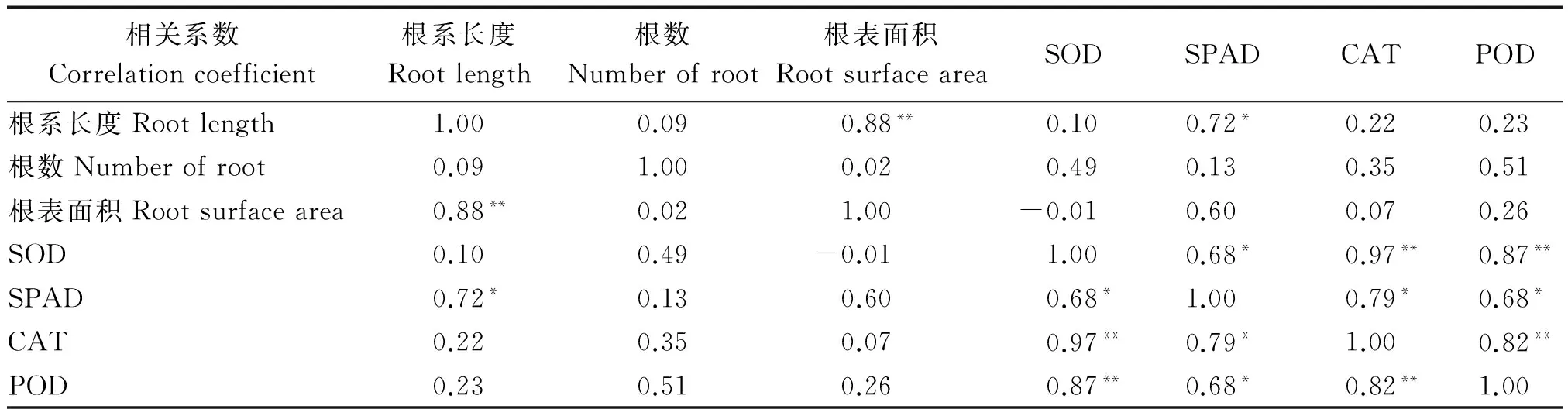
表9 嫁接烤烟成熟期根系与抗性指标相关分析Tab.9 Correlation analysis of root system and resistance index of grafting flue-cured tobacco in the mature stage
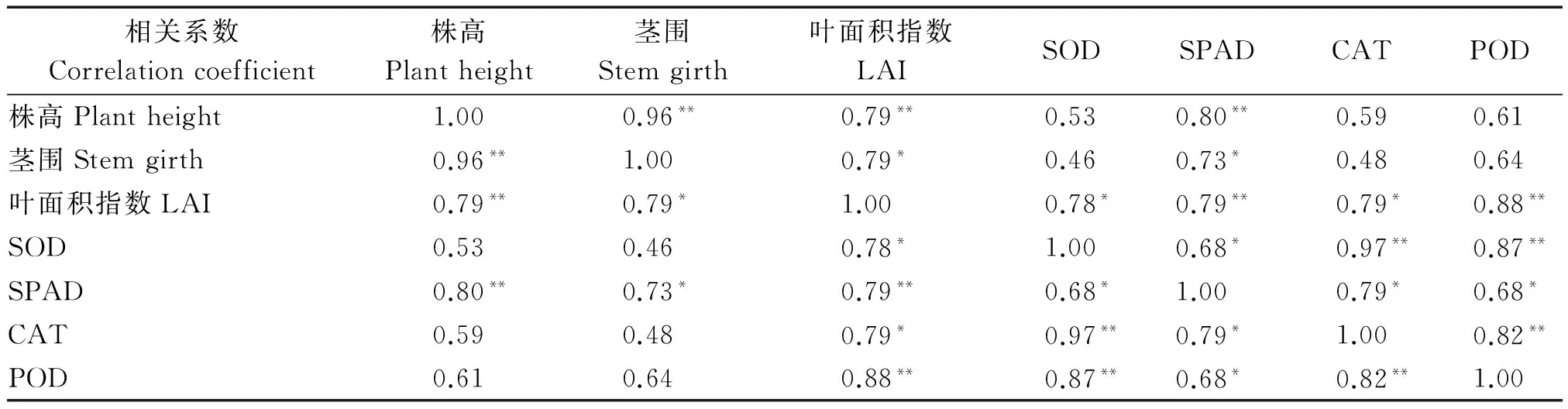
表10 嫁接烤烟形态指标与抗性指标的相关分析Tab.10 Correlation analysis of morphological indexes and resistance indexes of grafting flue-cured tobacco in the mature stage
3 讨论与结论
干旱胁迫能严重影响烤烟的生长发育,导致产质量不同程度降低,是烤烟生长过程中的重要限制因子之一,而由于不同品种烤烟抗性、胁迫方式及强度的不同,烟株生长发育过程会存在一定差异[8,13,32],本研究表明,干旱胁迫下,嫁接烤烟的形态指标、生理指标变化规律与非嫁接烤烟规律大体一致[31],但在生育前期,根系长度、根数等指标变化规律存在差异,这可能与砧木、接穗的特性不同有关,也可能与本试验处理为多次干旱胁迫,而前人抗旱研究时水分胁迫处理次数较少有关[13,19,21,32]。
烤烟根系形态变化能表征品种的抗旱性[33],本研究表明,干旱胁迫对嫁接烤烟根系长度、表面积的影响规律大体一致,均随着干旱程度的加重而呈变短、变小趋势,但变化幅度大小与嫁接组合砧木品种的抗性强弱紧密相关,嫁接烤烟的根数在适度干旱胁迫下,有增多趋势,而重度干旱胁迫下,根数又表现为降低趋势,这与前人研究结果基本相同[34-35],不同的是本研究采取的是固定灌溉设计,且在几个烤烟关键时间节点上进行水分胁迫处理,这可能是造成根数等变化差异的原因。烟株叶绿素含量的变化指示植物对胁迫的敏感性,同时影响光合产量[33]。本研究中干旱条件下嫁接烤烟烟叶SPAD值(叶绿素相对含量)呈下降趋势,这可能是由于干旱胁迫导致叶绿素合成受阻,另一方面,胁迫致使活性氧累积,造成叶绿素分解破坏。而异根嫁接的SPAD值高于自嫁苗,说明以抗性强的品种作砧木可减轻干旱胁迫导致的接穗品种叶绿素的降低程度,从而保持异根嫁接苗较高的叶绿素含量,确保植株光合作用,促进烟株株高、节距、茎围、叶片长宽等的生长发育,这与霍勇锦等[19]研究结果大体一致,但与梅芳等[5]以选择氮高效品种作砧木来提高接穗的叶绿素含量不同,表明可以通过不同的材料组合、不同的外源措施,来达到相同的目标。
Pro、SOD、CAT、POD是植物体内的重要保护性物质,在渗透调节、自由基清除、保护细胞等抗性生理中发挥着重要的作用[19,21,32,36-37]。本试验中,嫁接烟叶脯氨酸的大量积累说明在干旱胁迫下烟株能集聚渗透调节物质、改变细胞结构,进而增强吸水、保水能力。脯氨酸含量KRK26/Anyan 2>KRK26/K326>KRK26/KRK26,表明以Anyan 2、K326作砧木异根嫁接苗能提高植株脯氨酸含量,改善烟株渗透调节细胞,降低水分的流失,减轻干旱胁迫对烟株造成的伤害。有研究表明,干旱胁迫能打破植物体内自由基的产生和清除平衡,致使自由基大量积累,造成烟叶受损[21]。本试验团棵期SOD和CAT活性随着干旱程度的加剧而增加,减轻了干旱胁迫造成的影响。随着生长发育和再次干旱胁迫,SOD和CAT活性逐渐下降,表明烟株自身调节能力降低,细胞膜遭受伤害,这2种酶活性的变化趋势与前人的研究结果基本一致[38-39]。与正常灌水相比,随着生长发育,干旱胁迫下以Anyan 2和K326作砧木的嫁接苗的SOD和CAT活性降低幅度小于自根苗的降幅,说明选择抗性较强的品种做砧木进行异根嫁接较抗性弱的品种自根嫁接能更好地清除自由基和过氧化氢,保护烟叶细胞膜。此外,POD活性亦以KRK26/KRK26最低,而以Anyan 2、K326做砧木嫁接的相对较高,表明以抗性强的品种作砧木的异根嫁接能积累更多木质素、木栓质,以促进细胞壁的交联,同时降低细胞壁的伸展,以形成更强的保护屏障,从而提高其抗旱性,其外在栽培表现为对水分需求降低,但烟株体内的水分却保持一个平衡状态。本试验中Pro、SOD、CAT、POD等几种酶活性在不同组合、不同生育期产生的差异,可能与异根嫁接能充分传承砧木的优势特性,激发了砧木、接穗的潜在抗性有关,前人关于嫁接抗旱对比研究,是基于嫁接苗与非嫁接苗[17-19],而本研究不同之处是基于异种与同种嫁接的对比,处理的平台更一致,但这可能也是部分指标与前人研究存在差异的原因。
通过嫁接能将砧木的优势特性传导给接穗品种,促进接穗的生长发育、提高抗性、改善品质[5,18-19,40],嫁接植株对干旱胁迫响应规律受砧木的影响较大[35]。本研究表明,在干旱胁迫下,利用嫁接换根茎原理,抗性较强的烤烟品种作砧木的嫁接苗能形成较强大的根系,以利于吸收水分,维持较高叶绿素相对含量以保证光合作用,同时增大脯氨酸积累量,并提高SOD、CAT、POD等关键酶高活性,从而提高嫁接烤烟抗旱能力。综合评价本试验中不同嫁接组合的各种形态指标、抗性生理指标,抗旱能力从强到弱依次为KRK26/Anyan 2、KRK26/K326、自根苗KRK26/KRK26。因此,科学筛选抗旱性强的品种作砧木,可以达到改善接穗苗生理特性,可为烤烟抗旱栽培提供一定参考。
[1] 刘国顺.烟草栽培学[M].北京:中国农业出版社, 2003: 212-221.
[2] Bihmidine S, Cao M X, Kang M, et al. Expression of chlorovirus MT325 aquaglyceroporin (aqpv1) in tobacco and its role in mitigating drought stress[J]. Planta, 2014, 240(1): 209-221.
[3] Liu X, Liu S, Wu J, et al. Overexpression ofArachishypogaeaNAC3 in tobacco enhances dehydration and drought tolerance by increasing superoxide scavenging[J]. Plant physiology and Biochemistry, 2013, 70: 354-359.
[4] Zhai S M, Gao Q, Liu X X, et al. Overexpression of aZeamaysphospholipase C1 gene enhances drought tolerance in tobacco in part by maintaining stability in the membrane lipid composition[J]. Plant Cell Tissue and Organ Culture, 2013, 115(2): 253-262.
[5] 梅 芳,杨铁钊,刘剑君,等.嫁接对烤烟氮代谢关键酶活性及叶绿素含量的影响[J].西北农业学报, 2012, 21(5): 132-135.
[6] 韩锦峰,汪耀富,岳翠凌,等.干旱胁迫下烤烟光合特性和氮代谢研究[J].华北农学报, 1994, 9(2): 39-45.
[7] Xie H, Yang D H, Yao H, et al. iTRAQ-based quantitative proteomic analysis reveals proteomic changes in leaves of cultivated tobacco(Nicotianatabacum)in response to drought stress[J]. Biochemical and Biophysical Research Communications, 2016, 469(3): 768-775.
[8] 王鹏翔.干旱胁迫对烤烟形态结构,主要生理指标及化学成分的影响[D].贵阳:贵州大学, 2008: 6-23.
[9] Alameda D, Anten N P, Villar R. Soil compaction effects on growth and root traits of tobacco depend on light, water regime and mechanical stress[J]. Soil & Tillage Research, 2012, 120: 121-129.
[10] Seraji R A N, Navaey H N, Ali S O, et al. Evaluating resistance to drought stress in flue-cured tobacco varieties via stress susceptibility indexes in dry farming condition[J]. International Journal of Farming and Allied Sciences, 2014,3(4):373-376.
[11] Ahmad P, Hameed A, Abd-Allah E F, et al. Biochemical and Molecular Approaches for Drought Tolerance in Plants[M]//Physiological Mechanisms and Adaptation Strategies in Plants Under Changing Environment.New York:Springer,2014:1-29.
[12] Drake M P, Vann M C, Fisher L R. Influence of nitrogen application rate on the yield, quality, and chemical components of flue-cured tobacco, part II: Application method[J]. Tobacco Science, 2015,52: 26-34.
[13] 邓桂秀,田 飞,赵继平,等.成熟期干旱胁迫对烤烟产量和品质的影响[J].贵州农业科学, 2012, 40(9): 93-96.
[14] 张永春,黄 镇,关国经,等.不同农业生态调控措施对烟草青枯病的影响[J].中国烟草科学, 2007,28(4): 49-52.
[15] 段玉琪,陈冬梅,晋 艳,等.不同肥料对连作烟草根际土壤微生物及酶活性的影响[J].中国农业科技导报, 2012(3): 122-126.
[16] Sanchez-Rodriguez E, Romero L, Manuel Ruiz J. Role of grafting in resistance to water stress in tomato plants: ammonia production and assimilation[J]. Journal of Plant Growth Regulation, 2013, 32(4): 831-842.
[17] 梅 芳,杨铁钊,刘剑君,等.不同接穗与砧木组合对烤烟香气物质含量的影响[J].烟草科技, 2013(1): 73-76.
[18] 刘剑君,朱宝川,梅 芳,等.嫁接对烤烟烟碱和钾含量的影响[J].中国烟草学报, 2013(6): 59-64.
[19] 霍勇锦,徐紫薇,王 燃,等.干旱胁迫下嫁接对烟草抗氧化酶活性,膜脂过氧化及胁迫响应基因表达的影响[J].烟草科技, 2016(8): 14-20.
[20] 陈学军,刘 勇,肖炳光,等.巴西,津巴布韦烤烟品种综合评价[J].植物遗传资源学报, 2010, 11(4): 503-508.
[21] 任庆成,陈秀华,张生杰,等.不同烤烟品种抗旱生理特征比较研究[J].西北植物学报, 2009, 29(10): 2019-2025.
[22] Zhang X W, Feng Q F, Yang A G, et al. Analysis of tobacco(NicotianatabacumL.)germplasm distribution and utilization in China[J]. Journal of Plant Genetic Resources, 2016, 17(3): 507-516.
[23] 周宇飞,王德权,陆樟镳,等.干旱胁迫对持绿性高粱光合特性和内源激素ABA,CTK含量的影响[J].中国农业科学, 2014,47(4): 655-663.
[24] 宗学凤,王三根.植物生理研究技术[M].重庆:西南师范大学出版社, 2011.
[25] Zeng J M, Yao H, Li T F, et al. Chlorophyll content determination and its relationship with SPAD readings in flue-cured tobacco[J]. Molecular Plant Breeding, 2009, 7(1): 56-62.
[26] 王建国.干旱胁迫及海水栽培对茄子生长和生理特性的影响[D].南京:南京农业大学, 2008: 21-46.
[27] 张珂珂.嫁接黄瓜幼苗对高温,干旱的生理反应及适应性研究[D].重庆:西南大学, 2010: 12-35.
[28] Liang X, Zhang L, Natarajan S K, et al. Proline mechanisms of stress survival[J]. Antioxidants & redox signaling, 2013, 19(9): 998-1011.
[28] Liang X W, Zhang L, Natarajan S K, et al. Proline mechanisms of stress survival[J]. Antioxidants & Redox Signaling, 2013, 19(9): 998-1011.
[29] Ravet K, Pilon M. Copper and iron homeostasis in plants: the challenges of oxidative stress[J]. Antioxidants & Redox Signaling, 2013, 19(9): 919-932.
[30] Park S, Lee D E, Jang H, et al. Melatonin-rich transgenic rice plants exhibit resistance to herbicide-induced oxidative stress[J]. Journal of Pineal Research, 2013, 54(3): 258-263.
[31] Francoz E, Ranocha P, Nguyen-Kim H, et al. Roles of cell wall peroxidases in plant development[J]. Phytochemistry, 2015, 112: 15-21.
[32] Zhang X H, Cai H Y, Wang Y F, et al. Effects of drought stress on growth and resistant physiology of flue-cured tobacco[J]. Tobacco Agriculture Science, 2005, 1(2): 122-126.
[33] 王新建,何 威,杨淑红,等.干旱胁迫下4种楸树嫁接苗叶绿素含量的变化[J].经济林研究, 2008, 26(1): 20-24.
[34] 景蕊莲,胡荣海.作物抗旱性的根系研究[J].国外农学-麦类作物, 1995(3): 37-39.
[35] 綦 伟,厉恩茂,翟 衡,等.部分根区干旱对不同砧木嫁接玛瓦斯亚葡萄生长的影响[J].中国农业科学, 2007, 40(4): 794-799.
[36] 尚晓颍,刘化冰,张小全,等.干旱胁迫对不同烤烟品种根系生长和生理特性的影响[J].西北植物学报, 2010,30(2): 357-361.
[37] Cvikrova M, Gemperlova L, Martincova O, et al. Effect of drought and combined drought and heat stress on polyamine metabolism in proline-over-producing tobacco plants[J]. Plant Physiology and Biochemistry, 2013, 73: 7-15.
[38] 蒋选利,李振歧,康振生.过氧化物酶与植物抗病性研究进展[J].西北农林科技大学学报:自然科学版, 2001, 29(6): 124-129.
[39] 周冀衡,王彦亭,余佳斌,等.干旱条件下氮肥形态对烤烟叶片内源保护酶活性的影响[J].中国烟草科学, 2001, 22(2): 5-8.
[40] Gao F S,Wang L ,Xu K.Comprehensive evaluation of relationship between rootstocks and yield and quality in grafting tomato[J]. China Agriculture Science, 2014, 47(3): 605-612.

