幽门螺杆菌感染对糖尿病动脉粥样硬化临床前期病变的影响
徐 鑫
(湖北科技学院附属第二医院内科,湖北 咸宁 437100)
随着人们生活水平逐渐提高,以及生活方式的改变,使得DM患者的发病率不断上升,对人们的身体健康造成了很大的威胁[1]。有结果显示Hp感染与颈动脉粥样硬化形成有关,慢性Hp感染所造成的脑血管动脉粥样硬化加重是由于病原微生物感染后免疫介导血管损伤侵染动脉粥样硬化斑块,进而与动脉粥样硬化形成有关,能显著增加颈动脉粥样硬化的风险[2]。本研究在上述研究基础上,就本院DM患者感染Hp和动脉粥样硬化(AS)之间的关系进行了进一步探讨,现报道如下。
1 资料与方法
1.1 一般资料
选择自2015年3月至2017年3月来我院进行治疗的DM患者160例,将80例感染Hp的患者分为观察组,未感染Hp的患者分为对照组。Hp判断标准:根据临床诊断标准,下列二项中任一项阳性者,则诊断Hp阳性,否则为阴性:Hp形态学(涂片或组织学染色);尿素酶依赖性试验(RUT、13C或14C-UBT、或15N尿氨排泄试验)。对照组中男37例,女43例;年龄28~70岁,平均(51.87±11.75)岁;病程1~16年,平均(6.32±3.54)年;疾病类型:萎缩性胃炎34例,糜烂性胃炎26例,浅表性胃炎20例。观察组中男39例,女41例;年龄28~69岁,平均(51.84±11.73)岁;病程1~17年,平均(6.35±3.56)年;疾病类型:萎缩性胃炎33例,糜烂性胃炎27例,浅表性胃炎20例。两组患者在性别、年龄、病程以及合并症等一般资料方面比较,不具有显著性的差异(P>0.05),具可比性。两组患者均符合ADA(美国糖尿病协会)所颁布的诊断标准,所有患者均在知情且自愿的情况下参加此次研究治疗。
1.2 方法
检验:取患者清晨空腹静脉血5mL,送往检验,生化的项目主要包括TG(三酰甘油)、TC(总胆固醇)、CRP(C反应蛋白)、FPG(空腹血糖),TC、TG、FPG采用酶法检测,CRP则采用免疫比浊法进行检测,生化分析仪是产自日本的HITACHI7600,试剂来自上海康美生物有限公司,当日质控可保证结果有效性;用ELISA检测白介素(IL)-10、IL-8、IL-6,试剂由深圳博得有限公司研制,严格按照试剂说明书进行操作。颈动脉内膜中层厚度(IMT)检测方法:①选用美国philips 公司生产的型号为philips IE33型髙分辨率彩色多普勒超声诊断仪,探头频率2~10MHZ;②患者取平卧位,头部偏向检査对侧,充分暴露颈部,从锁骨上窝水平胸锁乳突肌处开始探査,按自下而上先纵向后横向扫査双侧颈总动脉、颈动脉分叉部及颈内、外动脉;③仔细观察其内径、血管壁内中膜的厚度及有无斑块,血流是否通畅,血管是否狭窄或闭塞等;④将颈动脉的后壁作为测量点,测量后壁由腔-内膜形成第一条离回声带至中膜-外膜形成的第二条高回声带之间的距离。每侧分别测3个心动周期,左右两侧颈动脉分别6次检测取平均值即IMT。
1.3 统计学分析
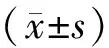
2 结 果
2.1 两组患者血脂比较
观察组TC、TG、LDL-C均高于对照组,而HDL-C较对照组有所减少,具有统计学意义(P均<0.05),见表1。

表1 两组患者血脂比较
与对照组比较,*P<0.05
2.2 两组患者血压、血糖比较
观察组患者FPG较对照组患者而言有所减少;而SBP、DBP均高于对照组,具有统计学意义(P均<0.05)。见表2。
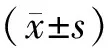
表2 两组患者血糖、血压比较
与对照组比较,*P<0.05
2.3 两组患者IMT、炎性因子比较情况
观察组患者的IMT及炎性因子CRP、IL-6、IL-8均高于对照组患者,IL-10较对照组而言明显减少,具有统计学意义(P均<0.05),见表3。
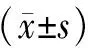
表3 两组患者IMT、炎性因子比较
与对照组比较,*P<0.05
3 讨 论
Hp感染是胃癌、胃溃疡发生的高危分子,主要致病因素是细菌霉素,例如空泡霉素类及细菌霉素的相关蛋白等均可引起患者胃上皮变性坏死[2]。DM是一种高血糖代谢疾病,相对功能不足、胰岛素分泌存在缺陷均可导致高血糖,对患者机体各器官组织进行慢性损伤。据临床研究结果显示[3],慢性Hp感染作为一个独立危险因素,可不断增加动脉粥样硬化以及颈动脉狭窄的发病风险,进而诱发脑血管疾病。进一步的研究也发现[4],急性脑卒中的中年患者中,Hp感染相当常见,且只有Cag A+菌株可能和动脉粥样硬化形成有关。目前临床医学中对于颈动脉粥样硬化斑块形成与Hp感染的相关性尚未有统一的论点和看法,国内外研究多倾向于认同Hp感染是导致颈动脉粥样硬化斑块形成的理论观点,但也有持不同看法的学者,他们采用相关技术未发现斑块局部Hp感染因子,故认为Hp感染是造成动脉粥样硬化形成的主要原因尚不充分。
Hp定植在上皮细胞,会引起DM患者体内酪氨酸磷酸化,导致机体炎性细胞对多种炎性因子进行分泌,DM患者多种并发症,例如肾病、心脑血管病、视网膜疾病、下肢血管病变等病变都基于血管粥样硬化。有学者发现[3],在DM颈动脉硬化的斑块中有Hp和炎性因子浸润,动脉粥样硬化的过程中炎性因子发挥着重要的作用,CRP是机体处于急性时的相关反应蛋白,动脉硬化程度和CRP血清水平有关,同本次研究结果类似。Hp感染会刺激多种炎性因子的产生,其中部分对动脉粥样硬化有促进作用,我们研究明确显示,Hp患者的IMT厚度较未感染患者而言有所提高,说明Hp的感染和糖尿病患者颈动脉粥样硬化之间有紧密的联系。比较Hp患者和未感染患者的血压、血脂发现,感染患者的血脂、血压代谢更为紊乱,主要原因可能是因为持续感染Hp会导致炎性因子IL及TNF-α上升[5],此类因子会刺激糖异生,促进TG合成,抑制TG水解酶和脂蛋白酶的活性,进而减少了血脂分解代谢,所以持续Hp感染是DM脂代谢紊乱恶化的重要因素。
综上,对DM患者感染Hp应加以重视,采取积极有效的治疗措施,以延缓糖尿病血管病的并发症。
[1]孙颖,单忠艳,姜雅秋.中国医科大学附属第一医院1991至2010年住院糖尿病患者死亡原因调查[J].中国医科大学学报,2011,40(10):949
[2]赵永才,李新胜,张金成,等.糖尿病患者血清炎性因子与颈动脉粥样硬化关系的研究[J].中国慢性病预防与控制,2011,19(1):55
[3]任守忠,郭建生,曾贵荣,等.安胃丸对小鼠幽门螺杆菌感染性胃炎的治疗作用[J].中国医院药学杂志,2012,32(2):117
[4]刘玲梅,罗雁,刘会领,等.幽门螺杆菌感染对动脉粥样硬化的影响[J].中华医院感染学杂志,2013,23(9):2072
[5]朱长清,石凌波,康红,等.糖化血红蛋白筛查和诊断糖尿病及糖尿病前期的切点分析[J].广东医学,2014,35(22):3564

