L-卡尼汀对大鼠脑缺血再灌注性损伤预防和治疗效果的对比研究*
但 丁,王晓丽,2,陈浩宇,2,梁 路,2,许 华,2,张常娥,2**
(1.广州医科大学蛋白质修饰与降解实验室,广东 广州 511436;2.广州医科大学病理生理学教研室)
缺血性脑血管病具有高发生率、高死亡率等特点,脑缺血超过一定时限后出现缺血性损伤,恢复缺血脑组织的血流是防止脑缺血性损伤的主要措施。因为氧反常、pH反常、钙反常等因素,再灌注会引发再灌注损伤[1],但具体机制仍未完全明了,目前尚无特效药物。左旋-卡尼汀(L-carnitine,LC)[2]又名左旋肉毒碱,是机体内脂肪氧化代谢的辅助分子,可通过提高位于线粒体膜上肉毒碱脂酰转移酶的活性,促进脂肪酸代谢提供能量。有报道[3]认为LC对心肌缺血再灌注损伤具明显保护作用,但对脑缺血再灌注性损伤是否有保护作用及其机制如何少有报道。本文采用改良Zea-Longa线栓法[4]复制大鼠右侧大脑中动脉(MCAO)局灶性脑缺血再灌注模型,探讨LC对局灶性脑缺血再灌注是否具有保护性作用及其可能的机制,以期为脑缺血再灌注性损伤的发生机理提供一定的实验基础,也为该类疾病的药物开发提供一定的理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物及分组
SPF级成年雄性SD大鼠84只,3月龄,体质量(280±20)g。由广东省实验动物中心提供,合格证号:44007200000384/440720929。随机分成4组,每组21只,即假手术组(Sham组)、脑缺血再灌注组(I/R组)、L-卡尼汀预防组(I/R+LCⅠ组)、L-卡尼汀治疗组(I/R+LCⅡ组)。所有大鼠正常饲养,保持12h光照/12h黑暗的昼夜节律。
1.1.2 药品与主要试剂
左卡尼汀购自Sigma公司,Bax抗体购自CST公司,即用型免疫组化试剂盒购自Santa Cruz公司,SOD、MDA检测试剂盒、TTC染色液(2、3、5-氯化三苯基四氮唑)购自南京建成生物工程研究所,ATP检测试剂盒购自碧云天生物技术研究所,HE(苏木精伊红)染色试剂购自南昌雨露实验器材有限公司。其它试剂均为国产化学分析纯。
1.2 方法
1.2.1 大脑中动脉缺血-再灌注损伤模型的复制
根据改良后Zea-Longa法,利用线栓复制大鼠右侧大脑中动脉脑缺血-再灌注模型。实验中采用0.26~0.28mm型号尼龙钓鱼线(日本生产),用电烙铁将线的头端烤热使之变钝,距线栓的头端10mm、18mm及(18±2)mm处分别作标记,便于观察线栓插入和拔出长度。I/R组和I/R+LC组大鼠,结扎右侧颈总动脉,线栓经由颈内动脉、大脑中动脉,直至大脑前动脉,当遇到阻力线栓长度约为(18±2)mm时,即可停止插入,结扎固定线,复制出局灶性脑缺血模型。缺血2h后,拔出线栓至10mm处,此时缺血区由对侧血液经过大脑前动脉来供应,实行大脑中动脉血流再灌注24h。I/R模型的成功率超过80%,若出现术后死亡,以同窝系大鼠配齐。Sham组插入的线栓长度约10mm,其余手术操作与I/R组同。
1.2.2 L-卡尼汀药物注射
L-卡尼汀采用生理盐水配置成20mg/mL浓度备用,所有大鼠都采用腹腔注射。Sham组与I/R组:大鼠腹腔注射1mL/100g体重生理盐水;I/R+LCⅠ组(预防组):大鼠在缺血前2h和再灌注前2h腹腔分别注射LC 200mg/kg 体重(1mL/100g体重,该剂量是根据预实验而来);I/R+LCⅡ组(治疗组):大鼠在再灌注开始后0h和2h分别腹腔注射LC 200mg/kg体重。
1.3 观测指标
1.3.1 神经行为学评分
根据改良后Longa法,分别对每组18只大鼠脑缺血再灌注术后2h、6h、12h和24h进行神经行为学评分。具体评分标准如下[5]:0分:大鼠自由运动,表现正常,无神经功能缺损;1分:大鼠左前爪不能自由伸展,右眼眼裂缩小,轻度神经功能缺损;2分:行走时,大鼠不停左转形成弯曲路线或咬尾,右眼明显变小,中度神经功能缺损;3分:大鼠运动向左倾倒,右眼不能睁开,重度神经功能缺损;4分:大鼠不能运动,神情松散,意识薄弱。缺血再灌注术后,麻醉清醒时评分为0分、4分及死亡的大鼠剔除,并用同窝系的大鼠进行补充,评分越高脑组织损伤越严重。
1.3.2 脑梗死灶体积的检测
每组随机取6只大鼠,在神经行为学评分和留取血液后取出全脑,快速放于-20℃冰箱中速冻20min左右,置于器官型脑片机上,冠状方向连续均匀的切成2mm左右厚脑组织片,共5片,将切好的脑组织切片置于1%TTC磷酸盐缓冲液中,37℃孵育浸染30min。染色完毕,取出脑组织切片,置于干净滤纸上,成列排布观察并拍照。正常脑组织染成红色,缺血区呈灰白色,境界清晰,呈梗死状。采用Image J 软件估算切片梗死面积百分比,将各脑片的梗死面积百分比与厚度乘积进行累加,获得梗死体积百分比。
1.3.3 血浆和脑组织SOD活性、MDA含量的测定
所有大鼠用10%水合氯醛麻醉后,开胸经左心脏取血,肝素抗凝,4℃,3000r/min离心10 min,分离血浆,如果有溶血现象就不纳入,所有血浆-20℃储存待测。每组取6只大鼠取血后,断头取脑,冰生理盐水漂洗,分离右侧大脑皮质,用生理盐水制成10%脑组织匀浆,4℃,12000g离心10min,取上清液,-20℃冻存待测。所有SOD和MDA的测定方法按照试剂盒说明书进行。
1.3.4 测定脑组织ATP的浓度
每组6只大鼠断头后取出脑组织,冰上分离右侧大脑皮质,用ATP试剂盒的裂解液将右侧大脑皮质制成10%的组织匀浆,4℃,12000g离心10 min,取上清,检测匀浆液中ATP的浓度。用改良的Lowry 法定量脑组织蛋白质的含量,并计算脑组织ATP的含量。具体操作方法按照试剂盒说明书进行。
1.3.5 脑组织形态学检测
每组3只大鼠灌流固定后的脑组织采用4%多聚甲醛固定24h,用Leica2000震荡切片机(德国)进行冠状切片,厚度为20μm,放于含0.05% NaN3的0.1PB中,置于4 ℃冰箱中储备。后续进行常规HE染色,拍照进行形态学分析。
1.4 统计学处理
2 结 果
2.1 大鼠的神经行为学评分
在大鼠缺血2h后再灌注2h、6h、12h、24h四个时间点,根据Longa法对每组18只大鼠进行神经行为学评分。与Sham组相比,I/R组、I/R+LCⅡ组大鼠神经行为学评分在四个时间点显著升高(P<0.05),I/R+LCⅠ组在2h、6h和12h有显著性差异(P<0.05);与I/R组相比,I/R+LCⅠ组在四个时间点神经行为学评分显著性降低(P<0.05),I/R+LCⅡ组行为学评分虽有降低,但与I/R组相比差异无显著性(P>0.05),见表1。
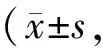
表1 神经行为学评分结果分,n=12)
与Sham组比较,*P<0.05,**P<0.01;与I/R组比较,△P<0.05
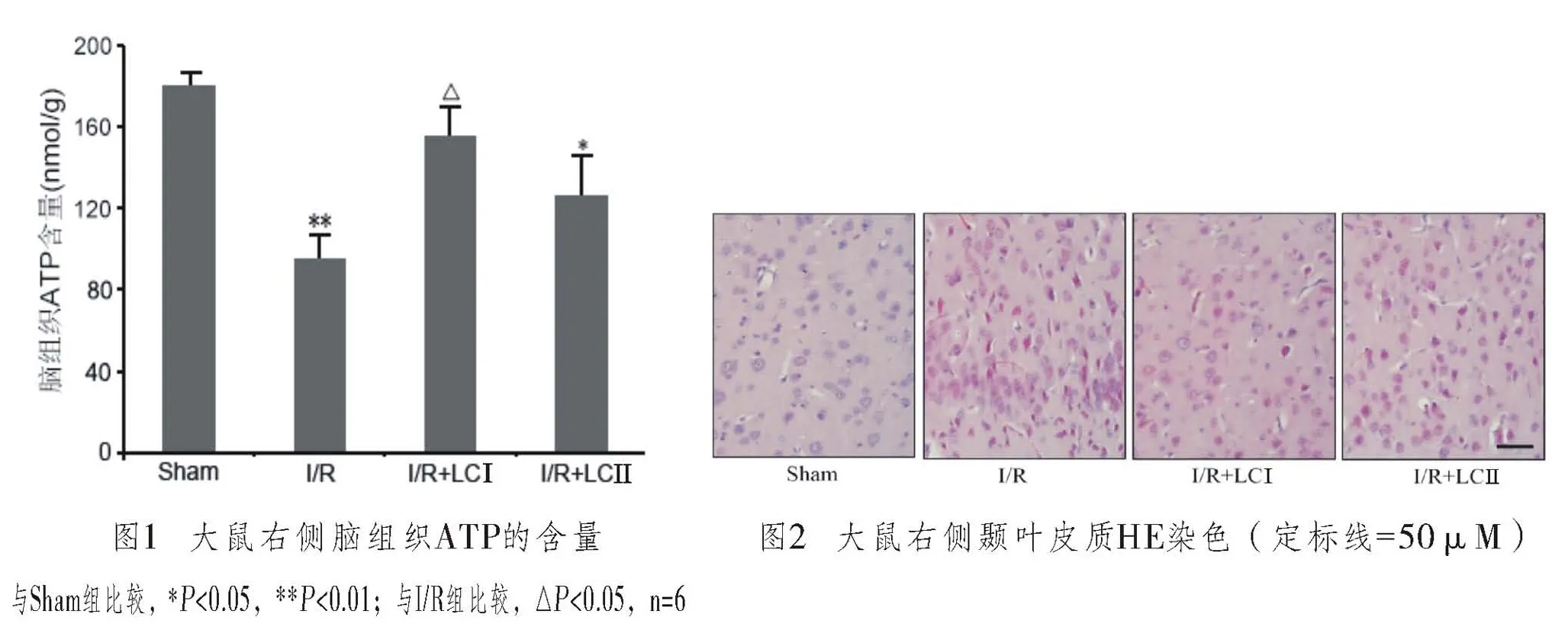
2.2 脑组织ATP含量
取右侧大脑皮质匀浆液,按试剂盒要求测定ATP的含量。经过右侧大脑中动脉缺血2h再灌注24h后,I/R组大鼠右侧脑组织ATP浓度下降,与Sham组相比,差异有显著性(P<0.01);I/R+LCⅠ组大鼠经过缺血前2h和再灌注前2h两次预防性注射左卡尼汀注射后,与I/R组相比,右侧脑组织ATP含量组显著性增高(P<0.05),与Con组相比,差异无显著性;但I/R+LCⅡ组大鼠经过缺血再灌注后两次卡尼汀注射,右侧脑组织内ATP含量增加不显著,与I/R组相比差异无显著性(P>0.05),但与Sham组相比差异仍有显著性(P<0.05),见图1(封二)。
2.3 脑梗死体积结果
大鼠经过缺血2h再灌注24h后取脑,进行TTC染色,通过Image J图形处理分析后,对梗死灶计算得出:假手术组无梗死灶,I/R组梗死灶体积百分比约为(32.30±4.12)%,与假手术组相比,差异有非常显著性意义(P<0.01);I/R+LCⅠ组大鼠脑梗死体积显著减少,约为(13.73±3.21)%,与I/R组相比差异有显著性(P<0.05);I/R+LC Ⅱ组大鼠脑梗死体积约为(24.27±4.77)%,与I/R组相比差异无显著性(P>0.05)。
2.4 血浆及脑组织SOD活性和MDA含量
将贮备好的血浆按照试剂盒的操作说明进行生化方法测定MDA含量和SOD活性。结果显示,大鼠经过脑缺血2h再灌注24h后,与Sham组相比,I/R组血浆中SOD活力显著性降低,MDA含量显著性升高(P<0.01);I/R+LCⅠ组与Sham组相比,SOD和MDA的变化无显著性,与I/R组相比两者都有显著性差异(P<0.05);I/R+LCⅡ组,血浆SOD活力和MDA含量变化与Sham组相比,差异无显著性(P>0.05),MDA含量的变化与I/R组相比有有显著性差异(P<0.05);见表2。
每组随机选取6只大鼠右侧大脑皮质,生理盐水制成10%的脑组织匀浆液,测定脑组织MDA含量和SOD活性。与假手术组相比,I/R组MDA含量显著升高,差异有非常显著性意义(P<0.01),SOD值显著降低(P<0.05);与I/R组相比,I/R+LCⅠ组MDA含量显著降低,SOD活性显著提高(P<0.05);I/R+LCⅡ组,脑组织MDA含量显著性升高,与Sham组相比差异有显著性(P<0.05),SOD变化不明显。见表2。
表2 血浆及脑组织MDA含量和SOD活性
与Sham组比较,*P<0.05,**P<0.01;与I/R组比较,△P<0.05
2.5 大鼠脑组织形态学变化
每组选取3只大鼠经过灌流固定后,多聚甲醛后固定24h,震荡切片,厚20μm,进行常规HE染色,观察右侧大脑的缺血区域并拍照分析。HE染色片光镜下可见:Sham组大鼠脑皮质神经元结构清晰完整,细胞排列密集整齐,神经元胞浆淡染,细胞核居中,核仁清楚,细胞浆无深红染色,细胞间隙致密无水肿。I/R组大脑皮层颞叶部位神经元数量减少逐渐明显,神经元结构紊乱,可见细胞肿胀,核固缩、碎裂、溶解等,部分细胞呈嗜酸性变;脑组织中凋亡细胞单个散在分布,表现为核染色质致密浓缩,核碎裂等;坏死细胞呈均质红染的无结构物质,核染色消失。I/R+LCⅠ组神经元损伤的神经元少见,大部分细胞结构较完整,但存在散在的坏死组织,细胞间轻微水肿。I/R+LCⅡ组,皮质细胞结构排列较整齐,但可见多个嗜酸性变细胞及散在的凋亡细胞,细胞间质水肿比较严重。见图2(封二)。
3 讨 论
脑缺血再灌注损伤(ischemia-reperfusion injury,I/R Ⅰ)是一个十分复杂的病理生理过程,I/R Ⅰ的发生机理涉[6]及能量代谢障碍、兴奋性氨基酸毒性、Ca2+超载、自由基损伤、炎症反应、细胞凋亡等,但具体机制仍未完全明了,目前仍是研究的热点。本实验通过线栓法复制大鼠右侧大脑中动脉脑缺血再灌注模型,缺血2h后再灌注24h。通过神经行为学评分,从2h开始,大鼠行为学显示皮质神经元损伤严重,右眼明显缩小,Hornor症典型,恢复血液灌注24h后,这种神经元损伤持续存在,这可能与再灌注性损伤有关。经检测发现脑组织ATP含量减少,脑组织和血液的MDA含量增加、SOD活力下降,HE染色发现大量的神经细胞发生变性和死亡,部分细胞呈现凋亡特征,另有部分细胞坏死溶解。这些结果说明本模型大鼠局灶性脑缺血后,脑组织能量代谢障碍,即使血液再灌注24h,能量代谢并没有相应提高,反而出现了氧化应激反应,而加重脑组织缺血性损伤。
左-卡尼汀(LC)是哺乳动物体内存在的天然化合物,主要功能是促进脂类代谢,提高组织器官的脂肪酸氧化供能。LC主要促进肌肉细胞尤其是心肌细胞脂肪酸的能量代谢,脑、肾等许多组织器官亦能脂肪酸氧化供能。LC还能增加细胞色素C还原酶、细胞色素氧化酶的活性,加速ATP的产生[7]。
本实验中,I/R+LC Ⅰ组大鼠脑缺血前2h和再灌注前2h分别腹腔注射200mg/kg的LC,相当于预防性给药。与I/R组相比,该组大鼠神经行为学评分发现在相对应的时间内,大鼠神经损伤显著减轻;检测血浆和脑组织各项指标发现,脑组织中ATP含量显著升高,血浆和脑组织中SOD活力增加,MDA的含量下降,说明大鼠脑组织能量产生增加,抗氧化应激的能力增强。通过形态学检测发现,LC能减少坏死的神经细胞数量和细胞凋亡的程度。这些结果表明LC对脑缺血再灌注性损伤有明显的预防作用。而I/R+LC Ⅱ组大鼠,在再灌注开始0h和再灌注2h分别腹腔给予200mg/kg的LC,相当于治疗性给药,该组大鼠所有的检测指标显示,LC对I/R I的改善作用不明显,说明LC对脑缺血再灌注性损伤的治疗效果不理想。
从本研究的上述结果综合推测,LC对脑缺血再灌注性损伤有预防作用,其机理可能涉及能量代谢的改善、抗氧化和抗凋亡等作用,是否还存在其它机制,尚需要进一步研究。
[1]王万铁.病理生理学[M].北京.人民卫生出版社,2011:141
[2]高宏民,李尚俭,朱火兰,等.左卡尼汀通过内质网应激ATF6通路抑制高糖诱导的HAECs凋亡[J].中国病理生理杂志,2017,33(8):1449
[3]NAJAFI M,GARJANI A.Short term administration of L-carnitine can be detrimental to the ischemic heart[J].Advanced Pharmaceutical Bulletin,2014,4(1):1
[4]LIU G,WANG T,WANG T,et al.Effects of apoptosis-related proteins caspase-3,Bax and Bcl-2 on cerebral ischemia rats[J].Biomedcial reports,2013 ,1(6):861
[5]曹勇军,程彦斌.线栓法建立大鼠局灶性脑缺血/再灌注模型的改进与探讨[J].中国应用生理学杂志,2001,17(2):198
[6]Eltzschig H K,Eckle T.Ischemia and reperfusion-from mechanism to translation[J].Nature Medicine,2011,17 (11):1391
[7]BAGETTA V,BARONE I,GHIGLIERI V,et al.Acetyl-L-Carnitine selectively prevents post-ischemic LTP via a possible action on mitochondrial energy metabolism[J].Neuropharmacology,2008,55(2):223