草鱼肝细胞原代培养的培养基选择与优化
张洪玉,王海波,,赵明军,吕永辉,胡鲲,杨先乐,夏磊,,*
(1.中国水产科学研究院,北京100141; 2.中国水产科学研究院无公害渔药创制中心,北京102488; 3.上海海洋大学水产 与生命学院,上海201306; 4.北京鑫洋水产高新技术有限公司,北京102488; 5.北京市房山区水产技术推广站,北京102488)
草鱼肝细胞原代培养的培养基选择与优化
张洪玉1,2,3,王海波2,4,赵明军1,吕永辉5,胡鲲3,杨先乐3,夏磊1,2,4*
(1.中国水产科学研究院,北京100141;2.中国水产科学研究院无公害渔药创制中心,北京102488;3.上海海洋大学水产 与生命学院,上海201306;4.北京鑫洋水产高新技术有限公司,北京102488;5.北京市房山区水产技术推广站,北京102488)
为寻找适宜培养草鱼原代肝细胞的培养基,本研究运用倒置相差显微镜形态学观察和CCK-8细胞活力实验,比较研究了DMEM/F12、α-MEM、RPMI-1640、M199和L-155种培养基,1μmol/L胰岛素、2mmol/L谷氨酰胺和10μmol/L氢化可的松3种添加剂以及热灭活血清对草鱼原代肝细胞形态和活力的影响。通过形态学和活力检测观察发现α-MEM、M199和L-15均可以较好地促进草鱼原代肝细胞贴壁以及维持较长活力,其中以L-15为最优;此外,胰岛素的添加有助于细胞活力的维持,而谷氨酰胺和氢化可的松的添加以及血清灭活与否对细胞贴壁和活力维持均无显著性差别。本研究可为草鱼原代肝细胞的培养基选择提供参考,同时为草鱼生理学、环境毒理学研究乃至药物筛选提供支持。[中国渔业质量与标准,2017,7(6):36-41]
草鱼;肝细胞;原代培养;培养基;细胞活力
自Bimbaum于1976年首次实现金鱼肝细胞的体外培养[1],已有40多种鱼的肝细胞被成功分离并进行体外培养[2]。鱼类原代肝细胞的培养不仅对生理学、环境毒理学研究具有重要意义,而且在药物筛选的研究中也发挥着举足轻重的作用[2]。2015年,中国学者殷国俊实验室就相继利用鲤的肝细胞筛选了多种中草药保肝药物[3-4]。但是鱼类肝细胞分离培养会因种属不同而不同,而且温度、pH、培养基以及生长因子等添加物也都会影响肝细胞的生长[2]。目前国际上鱼类肝细胞培养的相关研究以虹鳟的报道居多[2],这可能与其在欧美和日本等地养殖历悠久且十分普及,并较适合离体培养有关。
草鱼(Ctenopharyngodonidella)是中国养殖产量最高的淡水品种,且肝病爆发较为常见,故有必要对草鱼肝脏及细胞的生理、发病机理以及药物筛选进行研究。已有使用草鱼原代肝细胞研究药物药效和毒性的相关报道[5-7],这些研究中所用培养基有M199[8-9]、RPMI-1640[7]和DMEM/F12[5-6,10-12],所用添加剂除血清外,还有1μmol/L胰岛素和10μmol/L氢化可的松[11]。这些培养基和添加剂的选择主要参考了其他鱼类和哺乳动物肝细胞的培养方法,但对于各培养基在草鱼培养过程中的适应情况缺少相关的比较研究。鉴于不同种属来源的肝细胞对培养基的需求存在差异[2],本实验比较研究了5种常见培养基、3种添加剂和热灭活血清对细胞形态和活力的影响,以期为草鱼原代肝细胞的培养提供实验数据参考。
1 材料与方法
1.1 实验仪器
倒置相差显微镜(DMI3000B,LEICA);二氧化碳培养箱[MCO-18A/C(UV),SANYO];酶标仪(SPECTRA MAX 190,MP)。
1.2 实验材料
α-MEM(SH30265.01,HyClone);DMEM/F12(SH30023.01B,HyClone);RPMI-1640(SH30809.01,HyClone);M199(SH30253.01,HyClone);L-15(11415064,GIBCO);PBS缓冲液(SH30256.01,HyClone);Hank’s液(14175095,LIFE);青链霉素(15140122,LIFE);胎牛血清(11011-8611,四季青);0.25%胰蛋白酶(SH30042.02,HyClone);谷氨酰胺(25030081,GIBCO);氢化可的松(219456901,MP);牛胰岛素(I5500,Sigma);DMSO(196055,MP);增强型CCK-8试剂盒(C0042,碧云天)。
草鱼(Ctenopharyngodonidella)来自上海地方养殖池溏,用常规饲料在室内循环水系统中养殖1个月后,取150 g左右外观无异常的草鱼进行实验。
1.3 实验方法
1.3.1 草鱼原代肝细胞的分离与培养
解剖针破坏鱼脑以处死草鱼,75%乙醇擦拭鱼体进行消毒,超净工作台内迅速剥离肝胰脏,确认肝胰脏颜色质地正常后,切成1~2 mm3组织块,10倍体积的预冷PBS清洗5遍,5倍体积0.25%胰酶28 ℃摇床200 r/min消化10 min,添加含10%胎牛血清的预冷Hank’s液终止消化,70 μm孔径滤网过滤,100 g室温离心5min,预冷Hank’s液清洗一次,100 g室温离心5 min,重悬于预冷Hank’s液,计数后备用。使用L-15培养基的细胞培养于不通CO2的培养箱,使用其他培养基的细胞培养于含5% CO2培养箱,培养温度均为25 ℃[6,9]。
1.3.2 不同培养基对肝细胞形态和活力的影响
细胞以1×106个/mL分别重悬于含10%胎牛血清的DMEM/F12、α-MEM、RPMI-1640、M199和L-15的5种培养基。每孔接种200 μL于96孔板,4个重复。空白孔加入等量培养基。每天观察细胞形态,每3天更换一半培养基,于铺板后第0、2、7和14天检测细胞活力。
1.3.3 不同添加剂对肝细胞形态和活力的影响
胰岛素以PBS溶解,配制成100 μmol/L储存液,0.22 μm滤膜过滤。谷氨酰胺配制为200 mmol/L溶液。氢化可的松以DMSO溶解,配制成10 mmol/L储存液。用含10%未经热灭活胎牛血清的L-15作为基础培养基进行实验。细胞以1×106个/mL密度分别重悬于含1 μmol/L胰岛素、2 mmol/L谷氨酰胺和10 μmol/L氢化可的松的培养基中。每孔接种200 μL于96孔板,4个重复。空白孔加入等量培养基和添加剂。每3天更换一半培养基,新补充的培养基同样含有添加剂,于铺板后第0、 2、 7和14天检测细胞活力。
1.3.4 血清灭活对肝细胞形态和活力的影响
用L-15作为基础培养基进行实验。胎牛血清以56 ℃热灭活30 min。一组含10%未经热灭活的胎牛血清,另一组含10%热灭活后的胎牛血清。实验观察方法同上。
1.3.5 CCK-8细胞活力实验
实验孔和空白孔中加入20 μL的CCK-8试剂,继续培养3 h,测定OD450。实验孔和空白孔OD450的差值反映细胞活力的高低。
1.4 数据分析
用SPSS17.0进行数据分析,结果以平均数±标准差形式表示,n=4。采用单因素方差分析进行多组比较,采用LSD检验进行两两比较。
2 结果
2.1 不同培养基对肝细胞形态和活力的影响
草鱼原代肝细胞分别于DMEM/F12、α-MEM、RPMI-1640、M199和L-15这5种培养基中培养14 d,使用CCK-8法检测细胞活力,结果如图1所示。可见,无论培养于何种培养基,细胞活力均呈逐渐下降的趋势。第2天不同培养基间细胞活力区别并不明显,只有DMEM/F12的细胞活力较低(P<0.01)。培养7 d,L-15、α-MEM和 M199这3种培养基要明显优于DMEM/F12和RPMI-1640(P<0.01),但L-15、α-MEM和 M199之间无显著性差异(P>0.05)。培养14 d,L-15优于α-MEM和 M199(P<0.01),α-MEM和 M199优于DMEM/F12和RPMI-1640(P<0.01)。
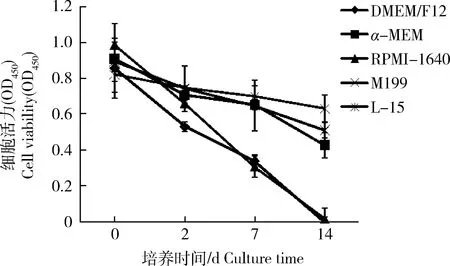
图1 不同培养基对草鱼原代肝细胞活力的影响Fig.1 Effects of diferent culture medium on cell viability of primary hepatocytes from Ctenopharyngodon idella
在细胞形态上(图2),可见L-15、α-MEM和 M199 3种培养基在第2天开始出现细胞聚集成条索,少量细胞展开贴壁,而DMEM/F12和RPMI-1640细胞聚集不及另3种培养基明显,贴壁的细胞也更少。第7天,这3种培养基中有更多的细胞展开贴壁,特别是L-15。而DMEM/F12和RPMI-1640中的细胞贴壁不明显,换液时细胞十分容易漂起。培养14 d后,L-15、α-MEM和 M199 3种培养基中的细胞贴壁成片层状,而DMEM/F12和RPMI-1640中的细胞不贴壁,且部分实验孔中的细胞在换液时出现片状脱落。总的来说,在促进细胞贴壁方面L-15最优,其次是M199和α-MEM,DMEM/F12和RPMI-1640最差。

图2 不同培养基对草鱼原代肝细胞形态的影响(标尺=100 μm)Fig.2 Effects of 5 culture medium on cell morphology of primary hepatocytes from Ctenopharyngodon idella (Scale bar =100 μm)
2.2 不同添加剂对肝细胞形态和活力的影响
草鱼原代肝细胞分别于含1 μmol/L胰岛素、2 mmol/L谷氨酰胺和10 μmol/L氢化可的松的L-15培养基中培养14 d,使用CCK-8法检测细胞活力(图3)。可见,前2天各添加剂组与对照组比较细胞活力区别不明显(P>0.05)。7 d后,胰岛素组细胞活力显著高于其他组(P<0.01)。
在细胞形态上(图4),各组细胞初始接种密度均偏低,培养7 d后细胞虽然有贴壁,但均没有连接成大片状。胰岛素使细胞表现出了更强的聚集倾向,但对细胞贴壁并没有明显促进作用,而其他各组之间也无明显区别。

图3 胰岛素、谷氨酰胺和氢化可的松对草鱼原代肝细胞活力的影响*表示:第7天和第14天,胰岛素组细胞活力高于对照组(P<0.01)。Fig.3 Effects of insulin, glutamine and hydrocortisone on cell viability of primary hepatocytes from Ctenopharyngodon idella* denotes: on day 7 and 14, cell viability of insulin group is higher than control group (P<0.01).
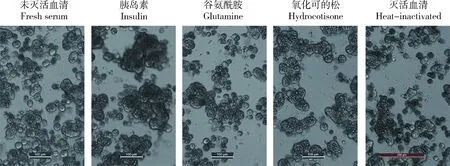
图4 胰岛素、谷氨酰胺、氢化可的松和血清灭活对草鱼原代肝细胞形态的影响细胞培养7天,标尺=100 μm(灭活血清组标尺=200 μm)。Fig.4 Effects of insulin, glutamine, hydrocortisone and heat inactivation of serum on cell morphology of primary hepatocytes from Ctenopharyngodon idella 7 days’ cell culture, scale bar= 100 μm (scale bar of heat-inactivated group = 200 μm).
2.3 血清灭活对肝细胞形态和活力的影响
草鱼原代肝细胞分别于含热灭活和未热灭活血清的L-15培养基中培养14 d,使用CCK-8法检测细胞活力(图5)。可见,血清灭活对细胞活力无明显影响(P>0.05)。在细胞形态上(图4),同样无明显区别。
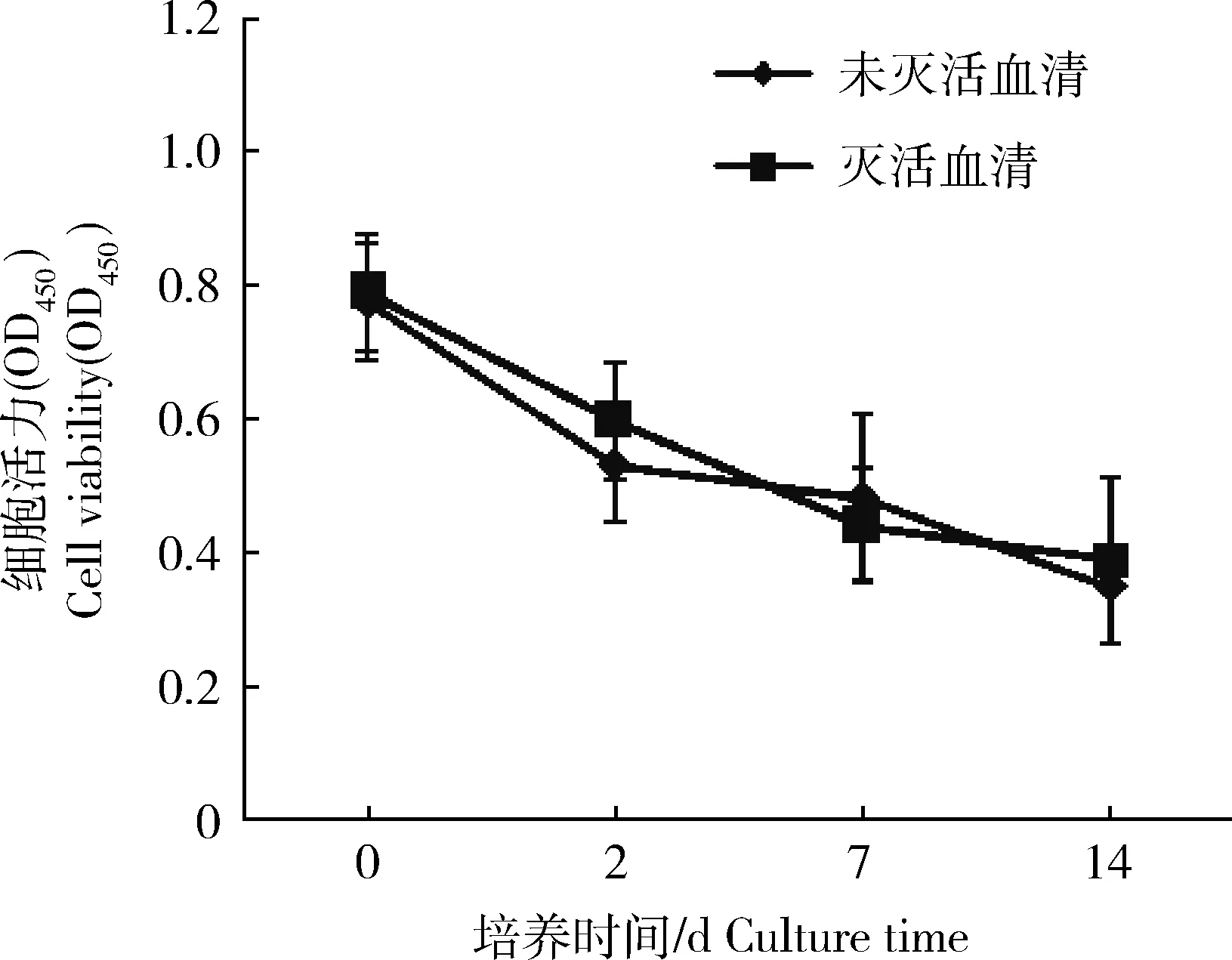
图5 血清灭活对草鱼原代肝细胞活力的影响Fig.5 Effects of heat inactivation of serum on cell viability of primary hepatocytes from Ctenopharyngodon idella
3 讨论
3.1 不同培养基对肝细胞形态和活力的影响
常用的真核细胞培养基均主要由无机盐、氨基酸、维生素和碳源等基本成分配比而成,但为适应不同种属和组织来源的细胞对营养的需求以及具体实验的要求,不同培养基在营养成分的具体种类、含量和配比上仍存有一定的差异。在鱼类原代细胞培养中,最常用的培养基是L-15和M199[2,13]。在草鱼肝细胞的原代培养中,除了M199[8-9],也有使用RPMI-1640[7]和DMEM/F12[5,6,10-12]的相关报道。本实验结果显示,L-15培养基最有利于草鱼原代肝细胞贴壁和活力维持,这可能与L-15培养基成分的特点有关。L-15使用半乳糖而不是葡萄糖作为碳源,且含有丙酮酸钠作为替代碳源。此外,L-15使用磷酸盐和高浓度的氨基酸来缓冲pH,而不是碳酸氢盐,所以不需要通CO2,这一特点不仅简化了培养条件,还适于需要长时间在培养箱外进行观察和操作的实验。M199和α-MEM也可以较好地维持肝细胞活力,而RPMI-1640和DMEM/F12则不推荐用于培养草鱼原代肝细胞,特别是需要进行2 d以上的培养时间。
3.2 不同添加剂对肝细胞形态和活力的影响
胰岛素参与糖类、脂质和蛋白质代谢的调控,促进细胞对葡萄糖的摄取和利用,可用做哺乳动物细胞培养时的添加剂[14-15],起到促进细胞贴壁和改善细胞状态的作用。在鱼类肝细胞培养上,牛胰岛素能促进鱼类肝细胞糖原的合成[16],也有研究者将其用做鱼类肝细胞原代培养时的添加剂[10-11]。本实验结果表明在L-15培养基中添加1μmol/L胰岛素有助于草鱼原代肝细胞活力的维持。此外,在实验中,胰岛素增加细胞聚集的倾向,其原因仍有待进一步的研究。
糖皮质激素如氢化可的松和地塞米松,具有广泛的生理作用,影响肝细胞白蛋白、细胞色素P450等基因的表达,也用做哺乳动物细胞培养的添加剂[14-15]。特别是上皮来源的细胞和肿瘤细胞,如人舌癌细胞细胞系SCC-9和小鼠肺上皮细胞系MLE-12的ATCC推荐培养基中均添加氢化可的松作为生长因子[17-18]。研究发现,氢化可的松和胰岛素、催乳素能够发挥协同作用促进奶牛乳腺上皮细胞增殖[19]。在鱼类肝细胞培养上,也有研究者联合使用10 μmol/L氢化可的松和1 μmol/L胰岛素作为草鱼原代肝细胞培养时的添加剂[11]。但本实验结果表明在L-15培养基中添加10 μmol/L氢化可的松对细胞活力和形态无明显影响。单独应用氢化可的松对于维持草鱼原代肝细胞活力可能并没有意义。至于氢化可的松在其他浓度下是否有益于草鱼原代肝细胞的培养,仍有待进一步的研究。
谷氨酰胺通常以2 mmol/L的浓度添加于细胞培养基中,有助于改善细胞代谢、促进细胞增殖。谷氨酰胺的这一作用在肿瘤细胞和一些快速增殖细胞中更为明显[20]。有些细胞培养基中常含有更高浓度的谷氨酰胺,如培养果蝇细胞的Schneider’s培养基的浓度是12 mmol/L,培养杂交瘤细胞的Gibco CD Hybridoma Medium的浓度是8 mmol/L。本实验在含有2 mmol/L谷氨酰胺的L-15培养基中额外添加了2 mmol/L,发现额外添加谷氨酰胺对维持草鱼原代肝细胞活力并无明显作用。至于更高浓度的谷氨酰胺是否有益于草鱼原代肝细胞的培养,仍有待进一步的研究。
3.3 血清灭活对肝细胞形态和活力的影响
很多实验室将热灭活作为胎牛血清的常规处理,但也有研究者认为除了涉及补体的免疫学方面的研究和培养昆虫细胞、平滑肌细胞外,热灭活这一操作是不必要的[21]。因为热灭活可能致使血清中部分生长因子失活、出现沉淀物,从而导致血清品质的下降,进而对细胞生长产生负面影响。本实验结果表明,血清灭活与否对草鱼原代肝细胞的形态和细胞活力无明显影响。
4 结论
综上所述,DMEM/F12、α-MEM、RPMI-1640、M199和L-15这5种培养基在促进草鱼原代肝细胞贴壁和活力维持方面,以L-15为最优,α-MEM和M199其次,而DMEM/F12和RPMI-1640效果最差。添加1 μmol/L胰岛素有助于细胞活力的维持并促进细胞聚集,而2 mmol/L谷氨酰胺、10 μmol/L氢化可的松和血清热灭活对细胞活力和形态均无明显影响。培养基的选择与优化为草鱼肝细胞的原代培养提供了实验数据参考。
[1] Bimbaum M J, Schultz J, Fain J N.Hormone-stimulated glycogenolysis in isolated goldfish hepatocytes [J]. Am J Physiol, 1976, 231(1):191-197.
[2] 贾睿,曹丽萍,丁炜东,等.鱼类肝细胞分离、原代培养与应用研究综述[J].江西农业大学学报, 2012,34(1):147-157.
[3] Liu Y J, Cao L P, Du J L, et al. Protective effects of Lyciumbarbarum polysaccharides against carbon tetrachloride-induced hepatotoxicity in precision-cut liver slices in vitro and in vivo in common carp (CyprinuscarpioL.)[J]. Comp Biochem Physiol C Toxicol Pharmacol, 2015,169:65-72.
[4] Liu Y J, Du J L, Cao L P, et al. Anti-inflammatory and hepatoprotective effects ofGanodermalucidumpolysaccharides on carbon tetrachloride-induced hepatocyte damage in common carp (CyprinuscarpioL.)[J]. Int Immuno Pharmacol, 2015, 25(1):112-120.
[5] 何春鹏,王恬,刘文斌.喹乙醇对草鱼肝细胞和胰腺外分泌部细胞的毒理研究[J].浙江大学学报(农业与生命科学版), 2006, 32(6):651-657.
[6] 万小琼,吴文忠,贺纪正.利用草鱼原代肝细胞培养评价二噁英毒性效应[J].中国环境科学, 2002, 22(2):114-117.
[7] 谢巧雄,朱心玲,卢全章.亚硒酸钠对四氯化碳损伤草鱼肝原代细胞与肝组织的保护作用[J].水生生物学报, 1996, 20(3):229-235.
[8] 杨端,周仁珍.致癌物对草鱼原代肝细胞培养物中DNA修复的诱导作用[J].环境科学学报, 1984, 4(4):368-375.
[9] 秦洁,叶元土,冷向军,等.草鱼肝细胞的分离与原代培养[J]. 中国实验动物学报, 2012, 20(3):33-39,95.
[10] Li H, Zhang X N, Qiu Q, et al. 2,4-dichlorophenol induces apoptosis in primary hepatocytes of grass carp (Ctenopharyngodonidella) through mitochondrial pathway[J].Aquat Toxicol, 2013, 140/141(18):117-122.
[11] Wan X Q, Ma T W, Wu W Z, et al. EROD activities in a primary cell culture of grass carp (Ctenopharyngodonidellus) hepatocytes exposed to polychlorinated aromatic hydrocarbonas[J].Ecotoxicol Environ Saf, 2004, 58(1):84-89.
[12] 王军,何文杰,马梅,等. 原代培养细胞法测试水中类二噁英物质[J].中国给水排水, 2005, 21(7):92-94.
[13] 张雪萍,曾令兵,陈倩,等. 青鱼鳍条组织细胞系的建立及其生物学特性[J]. 淡水渔业, 2016, 46(2):3-9.
[14] Li L, Li D, Heyward S, et al. Transcriptional regulation of CYP2B6 expression by hepatocyte nuclear factor 3βin human liver cells[J]. PloS One, 2016, 11(3):e0150587.
[15] Helgason C D, Miller C L. Methods in Molecular Biology. Basic cell culture protocols[M].Third Edition. New Jersey:Humana Press Inc, 2005:207-230.
[16] Plisetskaya E, Bhattacharya S, Dickhoff W W, et al. The effect of insulin on amino acid metabolism and glycogen content in isolated liver cells of juvenile coho salmon,Oncorhynchuskisutch[J].Comp Biochem Physiol A Comp Physiol, 1984, 78(4):773-778.
[17] ATCC. SCC-9(ATCC CRL-1629) Culture method[EB/OL]. [2017-06-20].https://www.atcc.org/products/all/CRL-1629.aspx#culturemethod.
[18] ATCC. MLE-12(ATCC CRL-2110) Culture method[EB/OL]. [2017-06-20].https://www.atcc.org/Products/All/CRL-2110.aspx#culturemethod.
[19] 田青,王洪荣. 胰岛素、催乳素和氢化可的松对奶牛乳腺上皮细胞增殖和凋亡的影响[J]. 中国饲料, 2013(2):8-12.
[20] Aledo J C. Glutamine breakdown in rapidly dividing cells: waste or investment?[J].BioEssays, 2004, 26(7): 778-785.
[21] 彭岳,赵铁建,谢海源,等. 细胞培养实验中一些细节问题的探讨[J]. 中华中医药学刊,2009,27(6):1189-1191.
Screeningandoptimizationofculturemediaforprimarycultureofhepatocytes fromgrasscarp(Ctenopharyngodonidella)
ZHANGHongyu1,2,3,WANGHaibo2,4,ZHAOMingjun1,LYNYonghui5,HUKun3,YANGXianle3,XIALei1,2,4*
(1.ChineseAcademyofFisherySciences,Beijing100141,China;2.Research&CreationCenterofGreenFisheryMedicineofChineseAcademyofFisherySciences,Beijing102488,China;3.CollegeofFisheriesandLifeShanghaiOceanUniversity,Shanghai201306,China;4.BeijingSeasunAquacultureBioTech.Co.Ltd.,Beijing102488,China;5.FangshanAquaticProductTechnologyPromotionDepartment,Beijing102488,China)
To optimize culture media for primary hepatocytes fromCtenopharyngodonidella,5kinds of culture media (DMEM/F12、α-MEM、RPMI-1640、M199and L-15),3additives (1μmol/L insulin,2mmol/L glutamine and10μmol/L hydrocortisone), and heat inactivation of serum were adopted to assess their impacts on cell morphology and viability by inverted phase contrast microscope and CCK-8cell viability assay for2weeks . As a result, cells cultured inα-MEM, M199and L-15, especially in L-15, exhibited better cell adherence and viability than that in DMEM/F12and RPMI-1640. And this effect was enhanced by insulin complement. In contrast, glutamine and hydrocortisone had no significant effects on prompting cell adherence and viability. Moreover, there were no differences in cell adherence and viability between heat-inactivated serum group and fresh serum group. The study may provide technical supports for primary culture of grass carp hepatocytes, even for grass carp physiology, environmental toxicology as well as drug screening.[Chinese Fishery Quality and Standnds,2017,7(6):36-41]
Ctenopharyngodonidella; hepatocytes; primary culture; culture media; cell viability
XIA Lei,xialei@126.com
10.3969/j.issn.2095-1833.2017.06.006
S917.4
A
2095-1833(2017)06-0036-06
2017-04-06;接收日期2017-09-21
中国水产科学研究院中央级公益性科研院所基本科研业务费专项资金项目(2015C004)
张洪玉(1981-),男,博士,副研究员,研究方向为无公害渔药研发与推广,zhanghy@cafs.ac.cn
夏磊,副研究员,研究方向为无公害渔药物研发与推广,xialei666@126.com

