海水中副溶血弧菌的可视化LAMP快速检测方法
黄梦诗,杨倩倩,张艳,谷阳光,赵俊,张旭志,丁东生,曲克明*
(1.上海海洋大学海洋科学学院, 上海 201306; 2.中国水产科学研究院黄海水产研究所,青岛海洋科学与技术国家实验室, 青岛 266071; 3.中国水产科学研究院南海水产研究所, 广州 510300)
海水中副溶血弧菌的可视化LAMP快速检测方法
黄梦诗1,2,杨倩倩1,2,张艳2,谷阳光3,赵俊2,张旭志2,丁东生2,曲克明2*
(1.上海海洋大学海洋科学学院, 上海201306;2.中国水产科学研究院黄海水产研究所,青岛海洋科学与技术国家实验室, 青岛266071;3.中国水产科学研究院南海水产研究所, 广州510300)
副溶血弧菌(Vibrioparahaemolyticus)是沿海地区常见的食源性致病菌之一,评估其在海洋环境中的存在状况对渔业生产与环境监测具有重要意义,但传统方法操作复杂或者设备繁重,往往不适合于现场快速检测。本实验采用环介导等温基因扩增法(loop-mediatedisothermalamplification,LAMP),以tlh基因作为其标识基因,建立了海水中该菌的可视化快速检测方法。采用过滤法收集海水中的细菌,以细菌悬液为扩增模板,直接加入LAMP反应液中(免DNA提取与纯化步骤),以羟基萘酚蓝(hydroxynaphtholblue,HNB)为扩增结果指示剂,通过肉眼观察LAMP反应液颜色变化判断阴性、阳性结果。优化条件下,该方法反应约1h可获得的最低检测限为167CFU/mL。较之于传统PCR方法,所建立的方法分析周期短(从开始预处理样品到得出检测结果只需~2h);灵敏度高(~10×PCR)。在验证实验中,应用该方法对青岛近岸海水中副溶血弧菌的检测,所获结果与经典培养方法和PCR方法结果一致。结果表明:该方法使用仪器简单,响应快,操作简易,可为现场快检海水中副溶血弧菌提供技术支持。[中国渔业质量与标准,2017,7(6):58-65]
副溶血弧菌;海水;LAMP;免DNA提取;快速检测
副溶血弧菌(Vibrioparahaemolyticus)为革兰氏阴性菌,呈弧状、杆状、丝状等多种形状,具有嗜盐、耐热特征,主要存在于海洋、河口环境及鱼、虾、贝等生物体中,是沿海地区主要食源性致病菌之一[1-3]。多种分析检测副溶血弧菌的方法已经建立并应用,比如经典的培养法、免疫法以及基于分子生物学技术而成的生物传感器法、PCR法、环介导等温基因扩增法(LAMP)等[4]。近年来基于基因分析的方法发展迅速,尤其是基于LAMP的各种自动化(荧光、浊度等)和半自动化(凝胶电泳等)方法[3-8]。基因分析方法较于PCR法具有更高的灵敏度和特异性,而且扩增过程对模板溶液中的血浆、细胞残渣等干扰物质耐受能力强[9],因此成为应用研究热点之一。目前评估水产品中副溶血弧菌情况是主要研究方向,但对环境中该菌的检测报道鲜有。鉴于水产品中的副溶血弧菌与其生长环境密切相关[1,10],海洋、河口等水环境中该菌的检测能为水产养殖企业提供有效预警数据[11],从而从源头上减少被污染水产品对人类健康带来的损害。此外,水体中的副溶血弧菌也是人类健康威胁之一[12]。因此,研发海水中副溶血弧菌的准确、高效检测方法具有重要现实意义,但尚未见报道。本研究以tlh基因作为副溶血弧菌的标识基因,通过系列优化,建立了海水中该菌的可视化LAMP快速检测方法,旨在为进一步建立现场快检技术提供理论依据和技术支撑。
1 实验部分
1.1 方法与材料
1.1.1 LAMP法
LAMP体系采用美国NEB提供的Bst2.0等温扩增酶,1.6 μmol/L的FIP和BIP,0.2 μmol/L F3和B3,0.8 μmol/L的LF和LB,BstDNA聚合酶0.80 U(美国NEB),6 mmol/L MgSO4, 1.4 mmol/L dNTPs, 2.5 μL 10×Buffer,以基因组DNA(1 μL)或者菌悬液(5 μL)为模板。tlh基因常被用作检测副溶血弧菌的靶基因[3,5,7,13]。本实验所用3对引物见表1,已由Yamazaki等[3]证实有特异性识别能力。引物产品由北京赛百盛生物技术有限公司合成,模板为从副溶血弧菌中提取的基因组DNA或者菌悬液。参照文献[14-15],除非特殊说明,实验采用羟基萘酚蓝(HNB)作为LAMP扩增结果指示剂,通过肉眼观察LAMP反应液颜色变化判断阴性、阳性结果;对照实验中,采用琼脂凝胶电泳仪(DYY-11型,北京市六一仪器厂)结合DNR凝胶成像系统(MF-ChemiBis 3.2,以色列)分析扩增结果。在LAMP体系初始阶段(扩增反应发生前),Mg2+与HNB结合,溶液的颜色为紫罗兰色。扩增反应过程产生副产物焦磷酸根,该产物易于与Mg2+结合生成焦磷酸镁沉淀,使得HNB因失去络合Mg2+而变为天蓝色,因而可以用来指示LAMP反应结果[9,15-16]。水浴时间为60 min,温度为65 ℃。
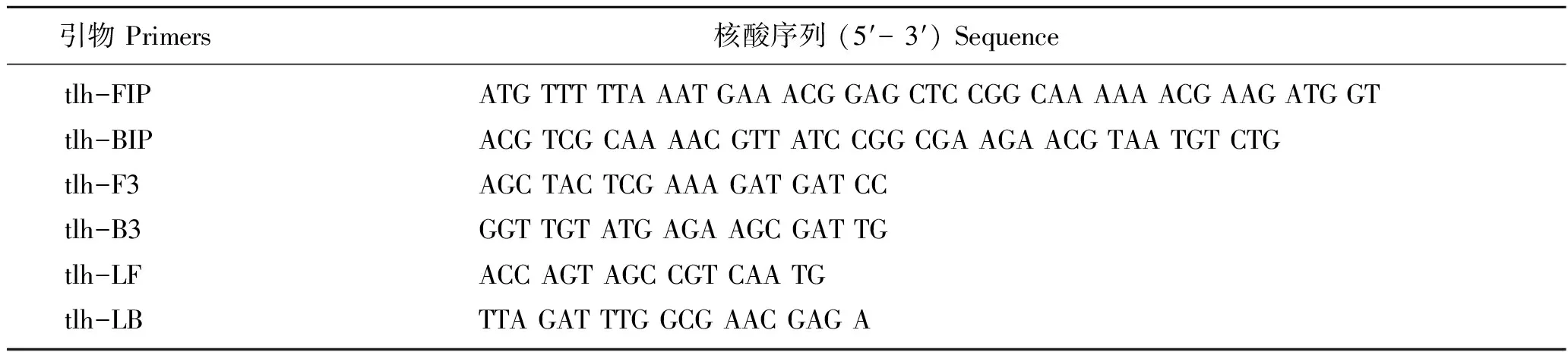
表1 tlh基因引物序列Tab.1 The primer sequences for tlh gene
1.1.2 PCR法
PCR法在Wang等[17]的方法基础上进行改进: 25 μL反应体系包括2.5 μL 10×Buffer、6 mmol/L MgCl2、1.4 mmol/L dNTPs,各40 umol/L LF3和B3引物、1 μL DNA模板、8 U Taq酶(宝生物工程大连有限公司)。其中引物为tlh-F3和tlh-B3。反应程序: 预变性 95 ℃ 5 min;95 ℃ 30 s;58 ℃ 30 s;72 ℃ 45 s;30 个循环,72 ℃延伸 10 min。扩增产物用1.2%的琼脂凝胶电泳进行分析。其中所用梯度PCR仪型号为5331(德国Dr. Eppendorf公司),凝胶电泳所用仪器同上。
1.1.3 副溶血弧菌的培养与计数
将本实验室于-80 ℃冰箱中保藏的菌种(#ATCC17802)活化,在TCBS固体培养基中30 ℃培养24 h。挑取菌落接种至碱性蛋白胨水(APW)中,30 ℃振荡过夜。将过夜培养后的菌液10倍梯度稀释,进行平板计数。
1.1.4 模板DNA提取
实验采用购自美国TIAN GEN公司的细菌基因组提取试剂盒进行模板DNA的提取,用BD-1000超微量核酸蛋白分析仪(北京五洲东方科技发展有限公司)测定DNA浓度。
1.1.5 含副溶血弧菌模拟污染海水的制备
将纯培养的副溶血弧菌收集于50 mL离心管中,10 397 g离心2 min,去上清液,将底部菌体用双蒸水重悬浮,将1 mL原菌液加入99 mL灭菌海水中,获得含副溶血弧菌的模拟污染海水。
1.2 海水样品中副溶血弧菌的检测
1.2.1 样品采集
参照文献[18],实验于2017年4月在青岛市近岸Q1~Q15共15个站点(图1),用洁净加仑桶采集海水样品,每点3个平行样品,每个样品1.0 L。装有海水样品的加仑桶立刻放入内置冰块的保温箱内运回实验室。
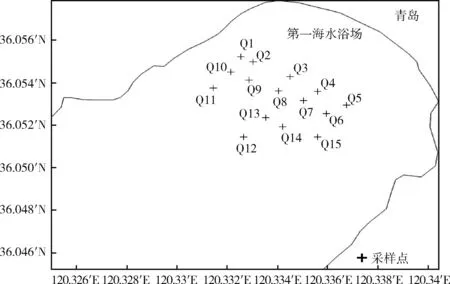
图1 青岛近岸海域采样站点分布Fig.1 Sampling sites of Qingdao coastal area
1.2.2 样品预处理与检测
首先通过定性中速滤纸过滤1 L海水样品,除去泥沙及其他不溶物,然后采用0.22 μm醋酸纤维素微孔滤膜过滤。将滤膜剪碎,放入50 mL离心管中,加入5 mL超纯水,剧烈振荡5 min,将滤膜取出,放入另外一个离心管中,加入2 mL超纯水振荡后合并到第一个离心管中。常温离心4 min(3 743 g),保留底部细菌沉淀,再加入1 mL灭菌超纯水,混匀,获得菌悬液。以该菌悬液作为模板,进行可视化LAMP法检测,或者提取基因组DNA作为PCR反应模板,其中所用振荡器型号为QL-901(海门市其林贝尔仪器制造有限公司)。
2 结果与分析
2.1 可视化LAMP法检测DNA模板和菌悬液模板中tlh基因
如图2(A)所示,实验选择HNB作为可视化LAMP法的指示剂,采用基因组DNA作为模板,当模板量不低于13.8 fg时,60 min后反应液即变成天蓝色,说明本实验条件下对应检测限为13.8 fg;凝胶电泳条带所获结果也证实了这一点,如图2(B)。

图2 HNB指示LAMP检测基因组DNA灵敏度(A)和 LAMP反应液的凝胶电泳结果(B)1~10号中基因组DNA模板的量分别为0.00(阴性对照)、1.38×106、1.38×105、1.38×104、1.38×103、1.38×102、1.38×101、1.38×100、1.38×10-1和1.38×10-2 fg。条件:水浴时间60 min,温度65 ℃。Fig.2 Indicating the sensitivity of LAMP with HNB (A), and electrophoretic analysis of LAMP (B)The concentration of the template DNA in 1-10 reaction tube was 0.00(negative control), 1.38×106, 1.38×105, 1.38×104,1.38×103,1.38×102, 1.38×101, 1.38×100, 1.38×10-1 and 1.38×10-2 fg, respectively.Reaction conditions: incubation at 65 ℃ for 60 min.
研究表明,LAMP反应对模板溶液中的血浆、细胞残渣等干扰物质耐受能力强[9,19],不但对所提取的DNA模板纯化要求较低,而且菌悬液(甚至是含有目标细菌的尿液等[20])也可以直接作为模板,本实验对此也进行了验证。将菌悬液于漩涡仪上振荡2 min,使菌体分布均匀,取100 μL菌悬液加入到固体培养基上,利用平板计数法测得菌液浓度为1.67×107CFU/mL;同时将该菌悬液稀释制备出系列浓度,混匀,分别取5 μL作为模板直接加入到LAMP混合液中进行反应,结果如图3所示:当模板浓度不低于167 CFU/mL时,60 min后反应液即变成天蓝色,说明本实验条件下对该细菌的检测限为167 CFU/mL。这就意味着利用本实验所建立的LAMP法检测海水中副溶血弧菌时,其结果能够直接可视化,而无需经繁琐的DNA提取等处理步骤,也不需使用多种大型贵重仪器(比如离心机),方法更加简易方便。
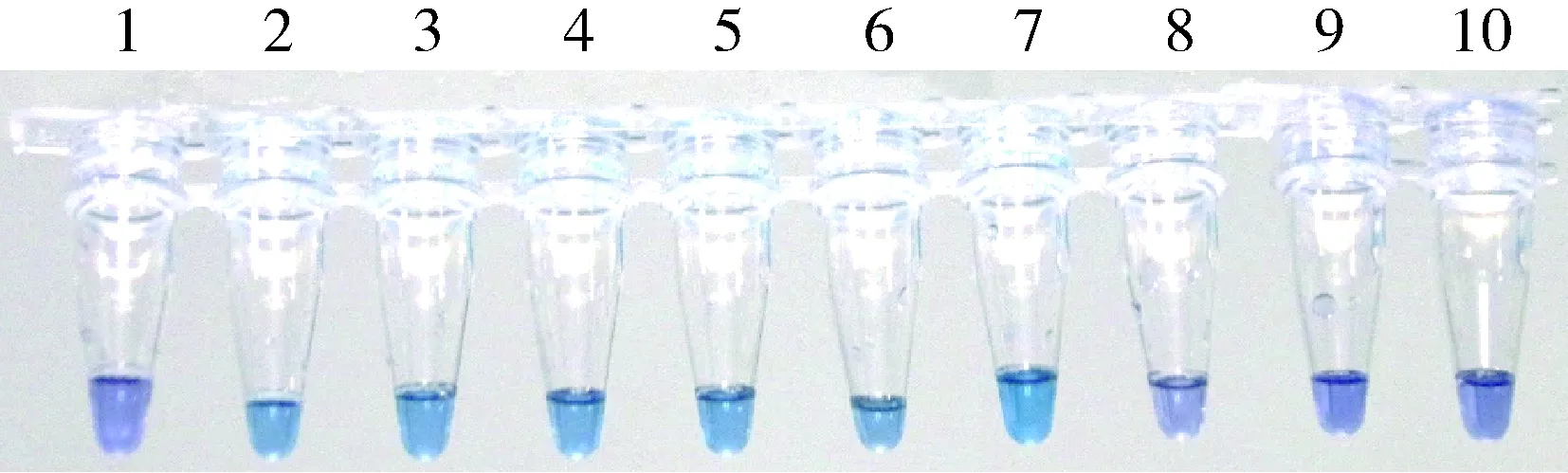
图3 HNB指示不同副溶血弧菌模板(菌悬液)量情况下LAMP反应结果1~10号中副溶血弧菌模板的浓度分别为0.00(阴性对照)、1.67×107、1.67×106、1.67×105、1.67×104、1.67×103、1.67×102、1.67×101、1.67×100和1.67×10-1CFU·mL-1。Fig.3 The results of visual LAMP depend on theinitial quantity of template (bacteria suspension) with HNBThe concentration of the template V. parahaemolyticusin 1-10 reaction cell was 0.00(negative control), 1.67×107, 1.67×106, 1.67×105, 1.67×104, 1.67×103,1.67×102,1.67×101, 1.67×100 and 1.67×10-1 CFU·mL-1, respectively.
2.2 可视化LAMP法的可靠性与灵敏性
以超纯水为阴性模板,以1.38×103fg副溶血弧菌基因组DNA为阳性模板进行LAMP扩增,其中一组采用HNB指示,结果显示扩增良好,如图4(A);另外一组采用凝胶电泳法,结果也显示扩增良好,如图4(B),因此排除了实验体系被污染的可能性。
目前,基于特定识别基因,采用PCR法检测副溶血弧菌已经得到了广泛的应用[3,7]。本实验采用该法对LAMP法的可靠性进行了验证,凝胶电泳结果见图4(B)。LAMP法可视化结果、LAMP法凝胶电泳结果和PCR法凝胶电泳结果吻合良好,说明上述可视化LAMP法检测tlh基因具有一定可靠性。此外,以超纯水为阴性模板,以副溶血弧菌悬液为阳性模板进行LAMP扩增,其可视化结果与凝胶电泳结果亦吻合良好。

图4 LAMP(A)和PCR(B)扩增凝胶电泳结果A: M—Marker;1—阴性对照; 2—阳性对照。B: M—Marker;1—阳性对照(以基因组DNA为模板);2—以副溶血弧菌菌悬液为模板;3—阴性对照。Fig.4 Electrophoresis of LAMP (A) and PCR (B)A: M—Marker; 1— negative control, 2—positive reaction.B: M—Marker;1—positive reaction (with DNA template);2—positive reaction (with V. parahaemolyticus bacterial suspension template); 3—negative control.
相关研究证实LAMP法比普通PCR法灵敏度高约一个数量级[17,21]。实验采用基因组DNA作为扩增模板,考察了本实验条件下LAMP灵敏度与PCR法灵敏度之间的关系。如图5所示,优化条件下,当模板量浓度<138 fg时,采用DNR凝胶成像系统表征,结果发现PCR反应液电泳条带上没有明显的DNA产物,说明本实验条件下对应检测限为138 fg/管。对照上面结果可知,LAMP法灵敏度是PCR法的10倍,该结论与文献[17,21]报道相一致。如上所示,LAMP法操作过程较PCR法更为简易,且仪器更易小型化[9],因而在构建现场快速检测方法上具有明显优势。
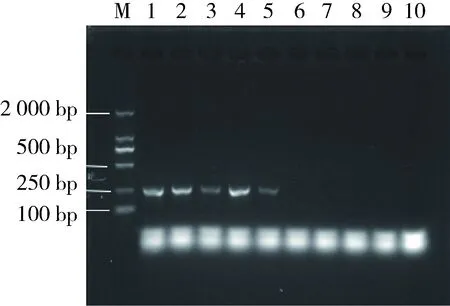
图5 PCR检测基因组DNA的凝胶电泳结果1~10号中模板DNA量分别为1.38×106、1.38×105、 1.38×104、1.38×103、1.38×102、1.38×101、 1.38×100、1.38×10-1、1.38×10-2和1.38×10-2fg。Fig.5 Electrophoresis of genome DNA with PCR The concentration of template DNA in 1-10 reaction tube was 1.38×106, 1.38×105,1.38×104, 1.38×103, 1.38×102,1.38×101, 1.38×100, 1.38×10-1, 1.38×10-2 and 1.38×10-2fg, respectively.
2.3 可视化LAMP法检测条件的优化
为了获得高灵敏度、高稳定性检测方法,实验对样品采集和LAMP操作相关的主要条件进行了优化,在此基础上确定了最佳参数。
实验考察了水系微孔滤膜孔径对富集副溶血弧菌效能的影响。对于同一份模拟海水样品,分别采用0.45和0.22 μm孔径的微孔滤膜过滤,将获得的总菌菌悬液作为模板进行LAMP检测。结果发现:采用0.45 μm孔径时,LAMP反应80 min后方可见紫罗兰色向天蓝色转变,如图6(A);采用0.22 μm孔径时,LAMP反应60 min后即可见紫罗兰色向天蓝色转变,如图6(B),说明采用较小孔径的滤膜可以富集更多的微生物。因此,为了较好的富集性能,其他富集细菌的实验都没有采用常用0.45 μm孔径的滤膜[22-23],而是统一选用了0.22 μm孔径的微孔滤膜。
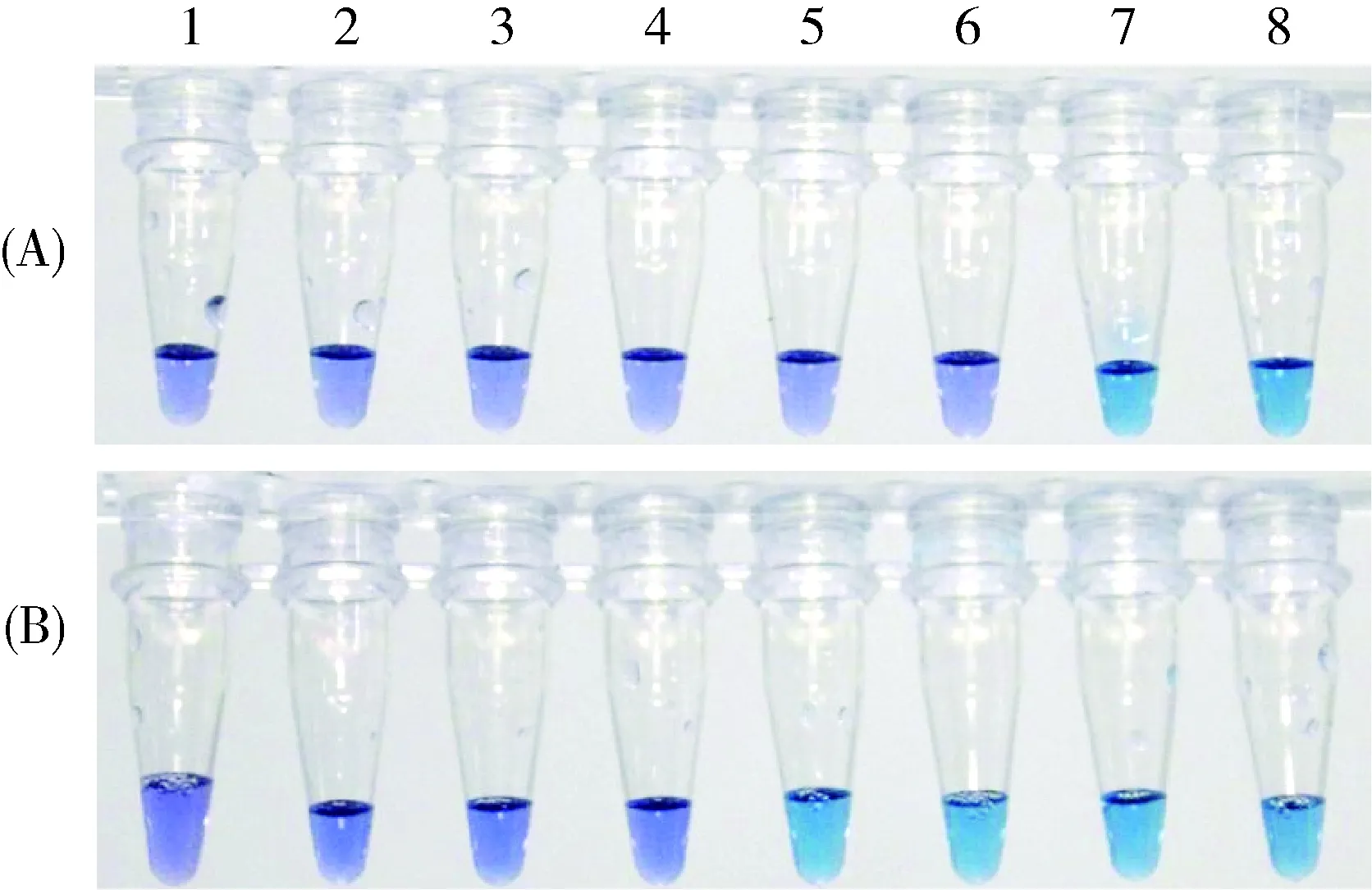
图6 以0.45 μm孔径(A)和0.22 μm孔径(B)微孔滤膜过滤所得总细菌菌悬液为扩增模板时LAMP反应结果1~8号反应时间分别为20、30、40、50、60、70 、80和90 min。其他条件与参数同图2。Fig.6 The results of LAMP with bacteria suspension as the template. (A)bacteria obtained with 0.45 μm filter; (B)bacteria obtained with 0.22 μm filter The reaction time of from NO.1 to NO.8 was 20, 30, 40, 50, 60, 70, 80 and 90 min, respectively. Other conditions and parameters were the same as that stated in Fig.2.
将细菌富集在微孔滤膜上以后,需要将其洗脱到溶液中去以方便用作LAMP模板或者提取DNA。洗脱剂的选取有3%生理盐水[24]或超纯水[25]。实验对洗脱剂的影响也进行了研究。在相同情况下,分别过滤相同的模拟海水样品(副溶血弧菌的浓度为1.67×105CFU/mL)各100 mL,将滤膜剪碎后分别放于离心管中,用10 mL生理盐水或超纯水分别按1.2.2进行洗脱处理,制得菌悬液并按照10倍梯度稀释。各取5 μL菌悬液作为LAMP模板进行检测,结果表明,当稀释10 000倍以内时,60 min后皆可扩增成功(图7),但超过这个倍数后皆不能成功,意味着本条件下生理盐水和超纯水的洗脱效果没有差别。因此,其他洗脱实验中一律采用超纯水。

图7 不同洗涤模式对LAMP检测结果影响1:阴性对照;2和3:超纯水洗涤;4和5:生理盐水洗涤。其他条件与参数同图2。Fig.7 The effect of elution method on the results of LAMP 1: negative control; 2 and 3: elution with ultra-pure water; 4 and 5: elution with 3% NaCl solution. Other conditions and parameters were the same as that stated in Fig.2.
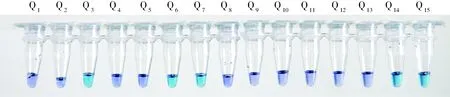
图8 青岛近岸15份海水样品中副溶血弧菌的可视化LAMP检测结果Fig.8 The detection results of V. parahaemolyticus in 15 seawater samples from Qingdao coastal area
2.4 可视化LAMP法应用于海水样品中副溶血弧菌的检测
利用建立的可视化LAMP检测方法对青岛近岸15份海水进行检测(每个样品3组平行实验)。结果表明,从5个站点(Q3、Q6、Q7、Q14和Q15)所取海水中可以检出目标细菌,检出率为33.3%(图8)。根据上述检测灵敏度研究结果,如果不考虑共存物(如微生物、微藻等)以及运输过程带来的影响,在15份海水样品中, 来自Q3、Q6、Q7、Q14和Q15等5个站点的海水中副溶血弧菌含量≥1.67 CFU/mL。每个样品3个平行样检测结果一致性较好,说明本方法具有良好的重现性。同时对15份海水样品进行LAMP方法、PCR检测和经典培养法对比检测,3种方法所得结果一致,检出率均为33.3%(表2)。
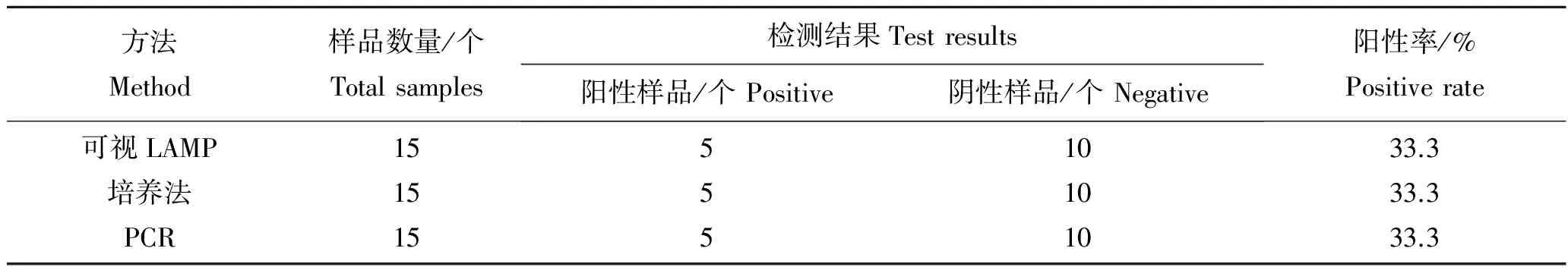
表2 可视化LAMP方法、PCR法和培养法检测海水样品结果Tab.2 Detection results of V. parahaemolyticus in seawater samples by visual LAMP, PCR and culture method
3 讨论
海洋环境中存在多种可同时感染人和水生动物的致病微生物,这些致病微生物不但会引起生态灾难,而且还给公共卫生安全和人类健康带来巨大威胁[26],其中副溶血弧菌的危害目前已经得到了广泛的研究[1-3]。对生产环境中该病原菌进行高效、准确检测是有效保证水产品质量的重要可行措施。本研究团队近年来致力于LAMP方法及其在渔业环境微生物检测中的应用研究,先后构建了“LAMP-伏安分析”模式基因检测方法[27]和“LAMP-电导传感器”模式基因检测方法[28-29],其中后者应用于大肠杆菌O26-wzy基因的分析,检出限可达12.5 copy/μL。在上述研究基础上,本实验基于膜过滤富集方法及LAMP技术,建立了海水中副溶血弧菌的可视化快速检测方法。
较之于PCR技术,本实验建立的可视化LAMP法具有更好的适用性:1)灵敏度较高。LAMP法检测海水中副溶血性弧菌的灵敏度约为PCR技术的10倍;2)低耗高效。在恒温条件下进行目标DNA片段的复制,不需要模板的热变性和温度循环,有效避免了制冷制热装备的应用——既能精简仪器结构,又能降低能耗和提高效率[9];3)操作简便。生化反应对模板溶液中的血浆、细胞残渣等干扰物质耐受能力强,从海水中富集到的总菌菌悬液即可直接作为模板,免去提取DNA的步骤,大大减少了预处理步骤,也进一步降低对大型贵重仪器的依赖;4)特异性强。采用3对特异性引物识别8个部位碱基序列[8-9],因而比采用1对引物识别2个部位碱基序列具有更高的特异性。
一般情况下,SYBR Green I[30]、EvaGreen[31]、GeneFinder[32]等荧光染料常被用于扩增产物的表征。但这些染料对LAMP扩增的抑制作用不能忽略,因此一般用于电泳,或者反应结束后再加入,通过光学仪器或肉眼观察来判断反应结果。加入这些核酸染料的操作中往往需要打开反应管盖子,使得反应产物暴露在空气中,极易形成气溶胶,严重影响后续实验的准确性,导致实验结果假阳性率急剧增加[9,33-34]。EvaGreen等[31,35]核酸染料在用于检测LAMP产物时,需要额外使用光学设备,不能直接观察到结果。本实验中采用的HNB染料不会对LAMP反应产生抑制作用[9,36],因此可以在反应前混合在反应液中[37],而且无需专用仪器即可直接用肉眼观察结果,因而更加简便易行,极大提高了分析效率。实验建立的可视化LAMP方法应用于海水样品中副溶血弧菌的检测时,从开始采集并预处理样品到得出检测结果总共需约2 h,效率明显高于目前所知同类方法[13,38];灵敏度可达167 CFU/mL,虽然与Prompamorn等[13]所建立的LAMP-LFD方法检测灵敏度为同一个数量级,但本方法不需要提取DNA,因而操作更简易、效率更高。
综上所述,本实验所建立的可视化LAMP法具有响应快、仪器简单、操作简易等突出特点。目前成果为进一步建立“检出信号与海水中副溶血弧菌浓度之间的定量关系”打下了基础,也为构建海洋环境微生物快检技术提供理论依据和实验方法。
[1] Vengadesh L C, Kok-Gan C, Learn-Han L.Vibrioparahaemolyticus: a review on the pathogenesis,prevalence, and advance molecular identificationtechniques[J]. Front Microbiol, 2014,5:705.
[2] Ham H, Orth K. The role of type III secretion system 2 inVibrioparahaemolyticuspathogenicity[J]. J Microbiol, 2012, 50(5): 719-725.
[3] Yamazaki W, Kumeda Y, Uemura R, et al. Evaluation of a loop-mediated isothermal amplification assay for rapid and simpledetection ofVibrioparahaemolyticusin naturally contaminated seafood samples[J]. Food Microbiol, 2011, 28(6): 1238-1241.
[4] Bledar B, Janet S, Marlene J, et al. A review of the current status of cultural and rapid detection ofVibrioparahaemolyticus[J]. Int J Food Sci Tech, 2012, 47(5):885-899.
[5] Wang R, Xiao X, Chen Y, et al. A loop-mediated, isothermal amplification-based method for visual detection ofVibrioparahaemolyticuswithin only 1 h, from shrimp sampling to results[J]. Anal Meth, 2017, 9(11): 1695-1701.
[6] Zeng J, Wei H, Zhang L, et al. Rapid detection of Vibrio parahaemolyticus in raw oysters using immunomagnetic separation combined with loop-mediated isothermal amplification[J]. Int J Food Microbiol, 2014,174(9):123-128.
[7] Zhong Q, Tian J, Wang B, et al. PMA based real-time fluorescent LAMP for detection ofVibrioparahaemolyticusin viable but nonculturable state[J]. Food Contr, 2016, 63: 230-238.
[8] Chen S, Ge B. Development of a toxR-based loop-mediated isothermal amplification assay for detectingVibrioparahaemolyticus[J]. BMC Microbiol, 2010, 10(1): 41.
[9] Zhang X, Lowe S B, Gooding J J. Brief review of monitoring methods for loop-mediated isothermal amplification (LAMP)[J]. Biosens Bioelectron, 2014, 61(20): 491-499.
[10] Su Y C, Liu C.Vibrioparahaemolyticus: a concern of seafood safety[J]. Food Microbiol, 2007, 24(6): 549-558.
[11] Tey Y H, Jong K J, Fen S Y, et al. Occurrence ofVibrioparahaemolyticus,Vibriocholerae, andVibriovulnificusin the aquacultural environments of Taiwan[J]. J Food Prot, 2015, 78(5): 969-976.
[12] Machado A, Bordalo A A. Detection and quantification ofVibriocholerae,Vibrioparahaemolyticus, andVibriovulnificusin coastal waters of Guinea-Bissau (West Africa)[J]. Eco Health, 2016, 13(2): 339-349.
[13] Prompamorn P, Sithigorngul P, Rukpratanporn S, et al. The development of loop‐mediated isothermal amplification combined with lateral flow dipstick for detection ofVibrioparahaemolyticus[J]. Lett Appl Microbiol, 2011, 52(4): 344-351.
[14] Safavieh M, Ahmed M U, Sokullu E, et al. A simple cassette as point-of-care diagnostic device for naked-eye colorimetric bacteria detection[J]. Analyst, 2014, 139(2): 482-487.
[15] Luo L, Nie K, Yang M J, et al. Visual detection of high-risk human papillomavirus genotypes 16, 18, 45, 52, and 58 by loop-mediated isothermal amplification with hydroxynaphthol blue dye[J]. J Clin Microbiol, 2011, 49(10): 3545-3550.
[16] Goto M, Honda E, Ogura A, et al. Colorimetric detection of loop-mediated isothermal amplification reaction by using hydroxy naphthol blue[J]. Biotechniques, 2009, 46: 167-172.
[17] Wang Y, Li D, Wang Y, et al. Rapid and sensitive detection ofVibrioparahaemolyticusandVibriovulnificusby multiple endonuclease restriction real-time loop-mediated isothermal amplification technique[J]. Molecules, 2016, 21(1): 111.
[18] DePaola A, Hopkins L H, Peeler J T, et al. Incidence ofVibrioparahaemolyticusin US coastal waters and oysters[J]. Appl Environ Microbiol, 1990, 56(8): 2299-2302.
[19] Kaneko H, Kawana T, Fukushima E, et al. Tolerance of loop-mediated isothermal amplification to a culture medium and biological substances[J]. J Biochem Bioph Meth, 2007, 70(3): 499-501.
[20] Hill J, Beriwal S, Chandra I, et al. Loop-mediated isothermal amplification assay for rapid detection of common strains of Escherichia coli[J]. J Clin Microbiol, 2008, 46(8): 2800-2804.
[21] Hara-Kudo Y, Nemoto J, Ohtsuka K, et al. Sensitive and rapid detection of Vero toxin-producingEscherichiacoliusing loop-mediated isothermal amplification[J]. J Med Microbiol, 2007, 56(3): 398-406.
[22] Geissler K, Manafi M, Amoros I, et al. Quantitative determination of total coliforms andEscherichiacoliin marine waters with chromogenic and fluorogenic media[J]. J Clin Microbiol, 2000, 88(2): 280-285.
[23] Cheung P K, Yuen K L, Li P F, et al. To swim or not to swim? A disagreement between microbial indicators on beach water quality assessment in Hong Kong[J]. Mar Pollut Bull, 2015, 101(1): 53-60.
[24] 谢昭聪, 谈书勤, 容清, 等. 三种选择性培养基在滤膜法检测染菌海水中大肠杆菌的效果比较[J]. 中国卫生检验杂志, 2013 (7): 1789-1792.
[25] 张艳,李秋芬,成钰. 水体中盐单胞菌属(Halomonas)细菌实时荧光定量PCR检测方法的建立及应用[J]. 应用与环境生物学报, 2017, 22(1): 140-145.
[26] 张振冬, 王秀娟, 朱琳.海洋环境中病原微生物不同检测方法的比较研究[J]. 海洋环境科学, 2011, 30(4): 292-295.
[27] Zhang X, Qu K, Li Q, et al. Recording the reaction process of loop-mediated isothermal amplification (LAMP) by monitoring the voltammetric response of 2′-deoxyguanosine 5′-triphosphate[J]. Electroanal, 2011, 23(10): 2438-2445.
[28] Zhang X, Liu W, Lu X, et al. Monitoring the progression of loop-mediated isothermal amplification using conductivity[J]. Anal Biochem, 2014, 466: 16-18.
[29] Zhang X, Li Q, Jin X, et al. Quantitative determination of target gene with electrical sensor[J]. Sci Rep, 2015, 5: 12539.
[30] Noble R T, Fuhrman J A. Use of SYBR Green I for rapid epifluorescence counts of marine viruses and bacteria[J]. Aquatic Micro Ecol, 1998, 14(2): 113-118.
[31] Mao F, Leung W Y, Xin X. Characterization of EvaGreen and the implication of its physicochemical properties for qPCR applications[J]. BMC Biotechnol, 2007, 7(1): 76.
[32] Almasi M A, Manesh M E, Jafary H, et al. Visual detection of potato leafroll virus by loop-mediated isothermal amplification of DNA with the GeneFinderTMdye[J]. J Virol Methods, 2013, 192(1): 51-54.
[33] Hong M, Zha L, Fu W, et al. A modified visual loop-mediated isothermal amplification method for diagnosis and differentiation of main pathogens fromMycobacteriumtuberculosiscomplex[J]. World J Microbiol Biotechnol, 2012, 28(2): 523-531.
[34] Denschlag C, Vogel R F, Niessen L,et al. Hyd5 gene based analysis of cereals and malt for gushing-inducingFusariumspp. by real-time LAMP using fluorescence and turbidity measurements[J]. Int J Food Microbiol, 2013, 162(3): 245-251.
[35] Rane T D, Chen L, Zec H C, et al. Microfluidic continuous flow digital loop-mediated isothermal amplification (LAMP)[J]. Lab Chip, 2015, 15(3): 776-782.
[36] Wastling S L, Picozzi K, Kakembo A S L, et al. LAMP for human African trypanosomiasis: a comparative study of detection formats[J].PloS Negl Trop Dis, 2010, 4(11): e865.
[37] Almasi M A, Moradi A, Nasiri J, et al. Assessment of performance ability of three diagnostic methods for detection of potatoleafrollvirus (PLRV) using different visualizing systems[J]. Appl Biochem Biotechnol, 2012, 168(4): 770-784.
[38] Wang L, Zhong Q, Li Y. Ethidium monoazide-loop mediated isothermal amplification for rapid detection ofVibrioparahaemolyticusin viable but non-culturable state[J]. Energy Proc, 2012, 17: 1858-1863.
RapiddetectionmethodofVibrioparahaemolyticusinseawater basedonvisualLAMP
HUANGMengshi1,2,YANGQianqian1,2,ZHANGYan2,GUYangguang3,ZHAOJun2,ZHANGXuzhi2,DINGDongsheng2,QUKeming2*
(1.CollegeofMarineSciences,ShanghaiOceanUniversity,Shanghai201306,China;2.YellowSeaFisheriesResearchInstitute,ChineseAcademyofFisherySciences;QingdaoNationalLaboratoryforMarineScienceandTechnology,Qingdao266071,China;3.SouthSeaFisheriesResearchInstitute,ChineseAcademyofFisheryScience,ChineseAcademyofFisherySciences,Guangzhou510300,China)
Vibrioparahaemolyticus(V.parahaemolyticus) is one of the major foodborne pathogenic bacteria in coastal areas. The evaluation of the current status of this kind of bacteria is extremely significant for both aquaculture and marine environment management. However, the traditional detection methods are unqualified for providing timely detection due to the slow response and expensive equipment. Herein a rapid method was constructed based on a visual loop-mediated isothermal amplification (LAMP) technology to detectV.parahaemolyticus, which has highly conserved genes oftlh. Briefly, bacteria in seawater samples were collected with filtration, the collected bacteria were subsequently used as reaction templates to perform LAMP, without the step of DNA extraction. Positive or negative results were identified finally by the color change of hydroxy naphthol blue with naked eyes. Under the optimized conditions, the detection limit was167CFU/mL (~1h). In comparison with traditional PCR methods, the visual LAMP proposed here has the advantage of distinguish efficiency. Including the consumption of sample pretreatment, the whole performance of detection took2h . Meanwhile, its sensitivity is about10-fold higher than PCR’s. The visual LAMP method was also applied to detectV.parahaemolyticusin real seawater samples collected from Qingdao coastal area in this study. The results were in good agreement with those obtained with classical culture method and PCR method. Without the involvement of bulky instrumentation, plus the rapid response and simple operation, this proposed method is favorable to use on-site surveys of target marine microorganisms. [Chinese Fishery Quality and Standards,20177(6):58-65]
Vibrioparahaemolyticus; seawater; LAMP; without DNA extraction; rapid detection
QU Keming, qukm@ysfri.ac.cn

10.3969/j.issn.2095-1833.2017.06.009
S917.1
A
2095-1833(2017)06-0058-08
2017-06-22;接收日期2017-10-19
中国水产科学研究院基本科研业务费(2016RC-BR02);黄海水产研究所基本科研业务费(20603022016003);青岛海洋科学与技术国家实验室鳌山科技创新计划项目(2015ASKJ02);山东省重点研发计划项目(2016GSF120008)
黄梦诗(1991-),女,硕士研究生,研究方向为渔业生态环境检测技术,m15800715082@163.com
曲克明,研究员,研究方向为渔业生态环境,qukm@ysfri.ac.cn

