微生物降解三苯甲烷类染料的研究进展
宋金龙,穆迎春,阮志勇,李乐,王亚妮,,韩刚*
(1.中国水产科学研究院质量与标准研究中心,农业部水产品质量安全控制重点实验室,北京 100141;2. 中国农业科学院农业资源与农业区划研究所,北京100081; 3.上海海洋大学食品学院,上海 201306)
微生物降解三苯甲烷类染料的研究进展
宋金龙1,穆迎春1,阮志勇2,李乐1,王亚妮1,3,韩刚1*
(1.中国水产科学研究院质量与标准研究中心,农业部水产品质量安全控制重点实验室,北京100141;2. 中国农业科学院农业资源与农业区划研究所,北京100081;3.上海海洋大学食品学院,上海201306)
三苯甲烷类染料生产量大、应用范围广,长期的大量使用对人类健康和生态环境构成极大危害。微生物降解技术被公认为是消除该类染料残留污染的有效途径之一。文章对目前已报道的主要降解三苯甲烷类染料的菌种、降解后的产物和降解的代谢途径进行了汇总,对微生物降解三苯甲烷类染料技术的发展前景进行了展望。[中国渔业质量与标准,2017,7(6):10-16]
微生物降解;三苯甲烷类染料;降解酶;代谢机理
合成染料的大量生产使用在创造经济效益、提高人类生活品质的同时也危害生态环境和人类健康。据统计,全球大约每年生产染料10000多种、200余万t,其中10%直接随废水排放到自然界中[1]。这些有色废水的排放不仅污染环境,而且对人和动物生命安全也构成了极大的威胁[2]。中国是染料生产大国,生产数量、贸易数量和消费份额占全球30%以上,多年来稳居世界第1位,带来的环境污染风险压力十分巨大,如何处理染料生产废水和环境中的染料残留已成为现代工农业生产中亟待解决的重大问题之一[3]。
三苯甲烷类染料是合成染料中的一大类,在中国曾广泛地应用于纺织印染、医药、造纸、制革等工业,以及作为杀菌剂运用于农业、渔业当中。然而,早在20世纪70年代,该类染料已证实对哺乳类动物细胞具有极高的毒害作用[4],于2002年被禁止用于渔业生产中。近年来的研究表明,微生物降解是治理该类染料残留的有效手段。本文主要从三苯甲烷类染料的降解微生物种类、相关代谢通路等方面对该领域的研究进行综述,并对该类染料微生物降解技术的发展进行展望。
1 三苯甲烷类染料概述
三苯甲烷类染料(triphenylmethanedyes)是在全世界范围内使用量居第3位的染料类型[5]。孔雀石绿和结晶紫是该类染料中的两种典型代表(图1)。其中,孔雀石绿既是常见染料,同时又对鱼类水霉病、原虫病等具有良好控制效果,曾在中国被广泛用于水产养殖业中。结晶紫与甲基紫组成的混合物龙胆紫是一种常用的消毒防腐剂,还可作为饲料添加剂以控制霉变[6]。
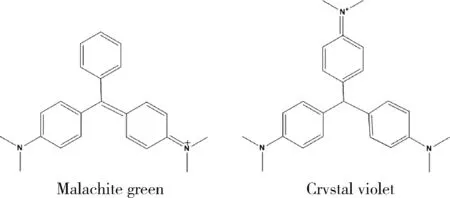
图1 孔雀石绿和结晶紫结构式Fig.1 Structures of malachite green and crvstal violet
自20世纪70年代末以来,大量的研究报道表明三苯基甲烷类染料对哺乳动物细胞具有致畸、致癌和致突变的作用,且由于特殊的化学结构,该类染料在自然环境中很难被降解,毒性还会随环境温度升高、在环境中暴露时间延长和浓度的上升而增加[7]。鉴于三苯甲烷类染料的危害性,许多国家颁布法规禁止其在畜禽、鱼类养殖过程中使用,中国也明确将孔雀石绿列为禁用渔药。然而,由于价格低廉、易获得等原因,在近年来中国开展的“三鱼两药”专项整治行动中,仍有样本检出。此外,在对外贸易中,由于染料残留问题导致许多产品不能达到出口标准,成为中国水产品出口贸易面临的技术壁垒之一[8]。与以农用投入品投入到自然环境中的数量相比,三苯甲烷类染料生产过程产生的大量废水更令人担忧,数以万吨计的未经处理或处理不彻底的废水排入河流、湖泊,转而在土壤中长期滞留,最终进入食物链,在生物体内富集,对自然界生物安全和人类健康构成了巨大威胁。
2 降解三苯甲烷类染料的微生物
微生物遗传变异较快,容易获得新的降解基因,因此具有很强的分解代谢能力。尽管三苯甲烷类染料是一类极为稳定的难降解物质,但受其诱导,环境中的一些微生物进化形成了对该类染料进行脱色、代谢分解的能力,因此成为治理环境中三苯甲烷类染料污染最有效的“武器”[9]。迄今为止,科研人员已从土壤、湖泊、废水处理池等各类环境样品中分离到可脱色或降解三苯甲烷类染料的微生物,涉及细菌、放线菌、真菌中不同的属种。已发现的具有此功能的细菌、放线菌包括芽孢杆菌属(Bacillus)、假单胞菌属(Pseudomonas)、气单胞菌属(Aeromonas)、柠檬酸杆菌属(Citrobacter)、希瓦氏菌属(Shewanella)、微小杆菌属(Exiguobacterium)、库特氏菌属(Kurthia)和诺卡氏(Nocardia)菌属等[10-17](表1)。其中,BacillussubtilisIFO13719和Kurthiasp.对10 mg/L的孔雀石绿脱色率可达100%,AeromonashydrophilaDN322对50 mg/L的结晶紫,脱色率达90%,兼性厌氧菌Shewanellasp.可耐受高达1 500 mg/L的结晶紫,并对其脱色。[17-20]真菌降解菌主要包括白腐真菌、霉菌等 (Phanerochaetechrysosporium、Irpexlacteus、Cunninghamellaelegans),对多种三苯基甲烷类染料同样具有较强的脱色能力(表1)。丰富的微生物菌种为三苯基甲烷类染料的生物脱色降解及污染环境的生物修复提供了大量的资源。

表1 已报道的可降解三苯基甲烷类染料的微生物Tab.1 The reported microorganisms degrading triphenyl methane dyes
3 微生物降解三苯甲烷类染料的代谢途径
目前,国内外对微生物降解三苯甲烷类染料的研究主要集中在脱色菌的筛选、脱色产物的鉴定及脱色途径的推断,大多只涉及降解过程的上游脱色途径,对三苯甲烷类染料微生物降解代谢的完整途径至今还尚未明确[21]。
已有研究表明,不同种类细菌对三苯甲烷类染料的脱色途径可能是相似的,如对结晶紫的初步降解产物均为二甲氨基苯酚和米氏酮[22]。20世纪90年代,Ioth等[10]利用薄层层析结合气质联用的方法鉴定出B.subtilisIF0 13719 和N.corallina降解结晶紫的主要代谢产物分别为米氏酮和二甲氨基苯酚。Chen等[15]分析Shewanellasp.厌氧脱色结晶紫的产物时,同样检测到这两种代谢产物。Wang等[16]利用气-质、液-质联用的方法鉴定了Exiguobacteriumsp. MG2降解孔雀石绿的6个产物,并推断了可能的代谢途径(图2)。该途径中孔雀石绿先经加氢反应生成无色孔雀石绿,后经脱甲基反应转化为脱甲基无色孔雀石绿,再经脱苯环反应生成4-dimethylamino-phenyl)-phenyl-methano,进一步的C-C 键断裂使其转化为3-Dimethylamino-phenol 和Benzaldehyde,该研究虽然对三苯甲烷类染料的代谢途径作出进一步推测,但仍不涉及中间产物苯衍生物的开环途径。与细菌代谢途径相比,已发现的真菌降解三苯甲烷类染料的代谢途径有所不同,Cha等[18]利用液质联用的方法鉴定CunninghamellaeleganATCC36112降解孔雀石绿的产物时,仅发现了孔雀石绿和无色孔雀石绿的脱甲基产物。Bumpus和Brock[19]研究白腐真菌P.chrysosporium对结晶紫的脱色产物时,检测到了3个无色的依次去甲基化产物(五甲基副品红、四甲基副品红和三甲基副品红)。由此可见真菌对三苯基甲烷类染料的降解主要是通过去甲基化过程实现的。

图2 推断的Exiguobacterium sp.MG2降解孔雀石绿的代谢途径[16]Fig.2 The hypothetic metabolic pathway of degradation of malachite green byExiguobacterium sp.MG2
4 微生物降解三苯甲烷类染料相关酶系
微生物对环境污染物的降解过程实际上是一系列酶促反应的过程,编码这些酶的相关基因位于染色体上或质粒上,随着降解底物和降解菌种的不同,降解相关基因也不尽相同。由于三苯甲烷类染料完整的降解途径尚不清楚,目前报道的降解基因和降解酶主要涉及上游的脱色途径,包括柠檬酸杆菌中的三苯基甲烷类染料还原酶TMR、分枝杆菌中的细胞色素P450单加氧酶、嗜水气单胞菌中的三苯基甲烷类染料脱色酶TpmD及真菌中木质素酶系。
Jang 等[14]运用Tn5 随机突变的方法在Citrobactersp. KCTC 18061P获得了孔雀石绿脱色相关基因tmr,进一步异源表达和纯化到了TMR,该酶是由2个31 kDa的亚基组成的同型二聚体,通过去甲基的方式将结晶紫和孔雀石绿转化为无色产物。随后,Wang等[16]在另一株孔雀石绿降解菌Exiguobacteriumsp. MG2中也发现TMR的存在。Cha等[18]通过甲吡酮抑制脱色反应发现了细胞色素P450单加氧酶可能参与了CunninghamellaelegansATCC36112对降解孔雀石绿的脱色。任随周等[12]对AeromonashydrophilaDN322克隆并在大肠杆菌中表达了三苯甲烷类染料降解酶TpmD,发现甲吡酮可以抑制该酶的降解活性,据此推断其亦属细胞色素P450酶系。真菌三苯甲烷类染料降解大多与木质素降解酶系有关,如过氧化物酶、锰过氧化物酶和漆酶。木质素酶系中的过氧化物酶和锰过氧化物酶均依赖H2O2为电子受体,在有氧条件下经过一系列非酶促反应生成两个具有攻击染料分子活性的中间物,并将三苯甲烷类染料氧化脱色,过程涉及C-C 键断裂、开环反应及侧链裂解[23]。吕聪[24]发现Poriacocos发酵产生的锰过氧化物酶可对结晶紫脱色,该反应依赖H2O2介导的非酶催化反应,证实该酶对三苯甲烷类染料的脱色同为自由基催化反应。木质素酶中研究最为广泛的是漆酶,该酶以O2作为受体,并以链式反应传递自由基,使三苯甲烷类染料氧化而脱色[25]。Coriolusversicolor产漆酶对初始质量浓度为6 mg/L的孔雀石绿的脱色率可达88%。Yang等[20]对漆酶及其介体系统对孔雀石绿的脱色研究中发现,该酶对孔雀石绿的脱色机制为脱甲基反应。近年来发现细菌漆酶也可降解三苯甲烷类染料,相较于真菌漆酶,细菌漆酶具有更好的稳定性、高耐热性以及底物的广谱性,对包括对苯二酚、对氨基苯酚在内的200多种芳香化合物均具有催化作用[26]。
5 讨论与展望
综上所述,国内外已有研究证明微生物的降解代谢作用是三苯甲烷类染料降解的有效手段,已经获得了很多能降解三苯甲烷类染料的细菌和真菌,并对该类染料的微生物代谢途径有了一定的了解,但仍有很多基本问题没有得到阐明:1)大多数的研究都局限于微生物对三苯甲烷类染料的脱色能力,忽视了三苯甲烷类染料的一些中间代谢产物往往更具毒性;2)目前尚未能分离到完全矿化三苯甲烷类染料的微生物;3)由于所获得的降解微生物的降解能力有限,已有的代谢途径方面的研究大多只局限于上游的脱色途径,对代谢中间产物或无色产物的去向乃至完整的降解途径尚待明确。这些问题如不能加以解决,无疑会影响微生物降解三苯甲烷类染料技术的实际应用效果。近年来,随着微生物分离培养新技术、新方法的出现,极大地提高了降解菌的分离效率,也使获得完全矿化该类染料的菌种以及进一步解析微生物降解三苯甲烷类染料的途径成为可能。据此,本文对未来微生物降解三苯甲烷类染料技术的进展提出了以下设想和展望。
5.1 运用微生物复合菌群降解三苯甲烷类染料
近期的研究报道中,在一些复杂环境污染物的降解上,科研人员已将关注点放在了运用环境样品构建复合高效降解菌群。Satsuma[27]通过富集驯化获得一个能完全降解阿特拉津的菌群AN4,利用PCR-DGGE分析了群落组成,并分离得到两株新的降解菌。李晓明等[28]发现在以芘为唯一碳源时,获得了一个高效的多环芳烃降解菌群,并从中分离到了7株对芘具有降解效果的菌株。Posman等[29]对煤矿富集的地下水样品进行了富集,在富集物中分离到一株Variovorax菌属的苯酚降解菌,并在该菌的基因组中克隆了芳环羟基化双加氧酶的基因。一方面利用微生物的协同作用以期实现对污染物残留的完全降解。另一方面,也将这些具有稳定降解效果的菌群视作一个小型功能微生物资源库,通过对菌群的定向分析,从中发掘新的微生物、基因及酶资源。因此,对于三苯甲烷类染料这一类结构复杂的化合物同样可以运用构建复合菌群的方法进行处理。
5.2 通过新技术确定不同菌株中三苯甲烷类染料的代谢途径
目前,科研工作者已经分离到了一些对三苯甲烷类染料具有降解效果的菌株,随着比较基因组学、转录组学、蛋白组学、代谢组学技术的快速发展,使得获得完整的微生物降解三苯甲烷类染料的代谢途径成为可能。本课题组在前期的研究中[1],分离到了一株对孔雀石绿具有降解效果的菌株KurthiahuakuiiLAM0618,该菌7 d可将100 mg/L孔雀石绿降解90%以上,对该菌进行全基因组分析,发现5个可能与降解相关的基因(表2)。对其中的laclK基因进行了表达和酶活测定,结果表明该酶对多种三苯甲烷类染料均有较好的降解效果。在未来的研究中,拟设置不同的培养条件并对该菌进行比较转录组分析,以期获得更多该菌中与孔雀石绿降解相关的基因。随着高通量测序技术的不断发展以及新技术的不断出现,相信未来还会有更多的三苯甲烷类染料降解基因和降解酶被发现,不同菌株中三苯甲烷类染料的代谢途径也会越来越清晰。

表2 K. huakuii LAM0618中可能与孔雀石降解相关的基因Tab.2 The deduced malachite green degradinggenes of K. huakuii LAM0618
5.3 运用新方法分离降解三苯甲烷类染料的微生物
越来越多的研究发现,一些未培养微生物在复杂化合物降解的过程中可能发挥着重要作用。王楠希[30]通过连续富集驯化,获得了一个12 d可完全矿化100 mg/L 1,3,5-三嗪的菌群,尝试了很多方法却没有能分离具有降解效果的菌株,结合对该菌群16S rDNA文库结果,提出极有可能是菌群中的一些难以分离的未培养微生物发挥着降解作用。Fuentes 等[31]在研究石油微生物降解时同样发现,与Alkanindiges属关联的一些分类单元,在以石油烃为底物时,其丰度在短时间内由最初的0.1%上升到60%。Ji等[32]以2-4D滴丁酯为唯一碳源,对森林土壤样品和活性污泥样品进行连续富集,通过元基因组构建的方法,分析了富集菌群中微生物群落变化,结果发现经过连续富集后,两个菌群中的TM-7分类单元的数量获得了大幅增加,均上升到50%以上,并推测该类微生物对2-4D的降解发挥至关重要的作用。这些研究报道都表明,一些未培养、难培养的微生物同样对降解起着至关重要的作用,此前未能分离到更高效率的降解微生物很可能是受传统的分离技术方法所限。
针对传统分离培养方法的缺陷,研究者们在培养装置及分离策略方面进行了改良,在一定程度上提高了未培养微生物的可培养性。Ma等[33]采用靶向微流控培养技术(gene-targeted microfluidic cultivation)分离出人类微生物组项目最希望获得的人类肠道微生物Ruminococcaceae。Jiang等[34]则利用微流控平板(microfluidic streak plate)划线的方法,实现了多环芳烃降解复合系中稀有降解菌种的高通量分离,大幅提高了环境样品中微生物筛选效率。近期,Oberhardt等[35]建立了一个重要的KOMODO数据库(the Known Media Database),该数据库将德国菌种保藏中心(DSMZ)培养基数据和NCBI的微生物分类数据相互结合,包含了18 049种不同微生物和3 335个培养基配方的信息,能够让研究人员根据从含有目标微生物的任何环境样本中轻松获得的一条遗传信息(16S rRNA信息)来预测新微生物生长所需的合适培养基配方。这些新技术、新方法的出现,无疑为三苯甲烷类染料降解菌的分离提供新的思路,也使将来获得具有更好甚至完全矿化三苯甲烷类染料微生物成为可能。
[1] 郭翔,阮志勇,宋金龙,等.KurthiahuakuiiLAM0618T重组酚氧化酶LaclK对乙基紫脱色的研究[J]. 生物技术进展, 2016, 6(4):255-260.
[2] 谯建军. 三苯甲烷类染料废水微生物降解研究[D]. 西安:西安理工大学, 2005.
[3] 王晓丽,三苯甲烷类染料的氧化降解反应研究及其应用[D]. 太原:山西大学, 2014.
[4] 张培培,任随周,许玫英,等. 微生物对三苯基甲烷类染料脱色的研究进展[J]. 微生物学通报, 2009, 32(9):1410-1417.
[5] Rajabi H R, Khani O, Shamsipur M, et al. High-performance pure and Fe3+-ion doped ZnS quantum dots as green nanophotocatalysts for the removal of malachite green under UV-light irradiation[J]. J Hazard Mater,2013,250/251:370-378.
[6] 王纪爱,乔敏,余珊,等. 三苯甲烷类染料脱色细菌降解途径及其机制研究进展[J]. 云南大学学报(自然科学版), 2014, 36(2):281-289.
[7] Wang J,Qiao M,Wei K,et al. Decolorizing activity of malachite green and its mechanisms involved in dye biodegradation byAchromobacterxylosoxidansMG1[J]. J Mol Microbiol Biotechnol, 2011, 20(4): 220-227.
[8] Ruan Z,Zhai Y,Song J,et al. Molecular cloning and characterization of a newly isolated pyrethroid-degrading esterase gene from a genomic library ofOchrobactrumanthropiYZ-1[J]. PLoS One, 2013, 8(10):e77329.
[9] Song J,Wang Y,Song Y,et al.Brevibacillushalotoleranssp. nov.,isolated from saline soil sample collected from paddy field[J]. INT J Syst Evol Mico, 2017, 67(4):773-776.
[10] Itoh K,Yatome C, Ogawa T. Biodegradation of anthraquinone dyes byBacillussubtilis[J]. Bull Environ Contam Toxicol, 1993, 50(4):522-527.
[11] 林少芳,余萍,林玉满. 一株绿脓假单胞菌对碱性孔雀石绿脱色的初步研究[J]. 福建师范大学学报(自然科学版), 2004, 20(4):72-75.
[12] 任随周,郭俊,王亚丽,等. 细菌脱色酶TpmD的酶学特性研究[J]. 微生物学报, 2006, 46(5):823-826.
[13] Sharma D K,Saini H S,Singh M,et al. Isolation and characterization of microorganisms capable of decolorizing various triphenylmethanedyes[J]. J Basic Microbiol, 2004, 44(1):59-65.
[14] Jang M S,Lee Y M, Kim C H,et al. Triphenylmethane reductase fromCitrobactersp. strain KCTC 18061P: purification,characterization,gene cloning,and overexpression of a functional protein inEscherichiacoli[J]. Appl Environ Microbiol, 2005, 71(12):7955-7960.
[15] Chen C H,Chang C F, Ho C H,et al. Biodegradation of crystal violet by aShewanellasp. NTOU1[J]. Chemosphere, 2008, 72(11):1712-1720.
[16] Wang J,Gao F,Liu Z,et al. Pathway and molecular mechanisms for malachite green biodegradation inExiguobacteriumsp.MG2[J].PloS One, 2012, 7(12):e51808.
[17] Yatome C,Yamada S,Ogawa T,et al.Degradation of crystal violet byNocardiacorallina[J]. Appl Environ Microbiol, 1993, 38(4): 565-569.
[18] Cha C J,Doerge D R,Cerniglia C E. Biotransformation of malachite green by the fungusCunninghamellaelegans[J]. Appl Environ Microbiol, 2001, 67(9): 4358-4360.
[19] Bumpus J A,Brock B J. Biodegradation of crystal violet by the white rot fungusPhanerochaetechrysosporium[J]. Appl Environ Microbiol, 1988, 54(5): 1143-1150.
[20] Yang X,Zheng J,Lu Y,et al. Degradation and detoxification of the triphenylmethane dye malachite green catalyzed by crude manganese peroxidase fromIrpexlacteusF17[J]. Environ Sci Pollut Res Int, 2016, 23(10):9585-9597.
[21] Diao Z,Li M,Zeng F,et al. Degradation pathway of malachite green in a novel dual-tank photoelectrochemical catalytic reactor[J]. J Hazard Mater,2013,260:585-592.
[22] Harrelson W J,Mason R P. Microsomal reduction of gentian violet. Evidence for cytochrome P-450-catalyzed free radical formation[J]. Mol Pharmacol, 1982, 22(2):239-242.
[23] 堵国成,赵政,陈坚. 真菌漆酶的酶活测定及其在织物染料生物脱色中的应用[J]. 江南大学学报,2003(1):83-86.
[24] 吕聪.茯苓菌产锰过氧化物酶及其应用的研究[D]. 长沙:中南林业科技大学,2008.
[25] Murugesan K,Kim Y M, Jeon J R,et al. Effect of metal ions on reactive dye decolorization by laccase fromGanodermalucidum[J]. J Hazard Mater,2009,168(1): 523-529.
[26] Nguyen L N,van de Merwe J P,Hai F I,et al. Laccase-syringaldehyde-mediated degradation of trace organic contaminants in an enzymatic membrane reactor: removal efficiency and effluent toxicity[J]. Bioresour Technol, 2016, 200:477-484.
[27] Satsuma K. Complete biodegradation of atrazine by a microbial community isolated from a naturally derived river ecosystem (microcosm) [J]. Chemosphere,2009,77(4):590-596.
[28] 李晓明,张明江,金京华,等. 芘降解菌群驯化过程中的演变[J]. 微生物学报, 2012,52(10):1260-1267.
[29] Posman K,Derito C,Madsen E. Benzene degradation by avariovoraxspecies within a coal tar-contaminated ground water Microbial Community[J]. Appl Environ Microb, 2017, 83(4): AEM. 02658-16.
[30] 王楠希.微生物降解除草剂苯磺隆的相关研究[D].合肥:中国科学技术大学, 2013.
[31] Fuentes S,Barra B,Caporaso J G,et al. From rare to dominant: a fine-tuned soil bacterial bloom during petroleum hydrocarbon bioremediation[J]. Appl Environ Microbiol, 2015, 82(3):888-896.
[32] Ji H,Jey R,Ick T,et al. Structural and kinetic characteristics of 1,4-dioxane-degrading bacterial consortia containing the phylum TM7 [J]. J Microbiol Biotechnol, 2016, 26(11):1951-1962.
[33] Ma L,Kim J,Hatzenpichler R,et al. Gene-targeted microfluidic cultivation validated by isolation of a gut bacterium listed in Human Microbiome Project’s Most Wanted taxa [J]. Proc Nation Acad Sci, 2014, 111(27):9768-9773.
[34] Jiang C Y,Dong L,Zhao J,et al. High throughput single-cell cultivation on microfluidic streak plates[J]. Appl Environ Microbiol, 2016, 82(7):2210.
[35] Oberhardt M A,Zarecki R,Gronow S,et al. Harnessing the landscape of microbial culture media to predict new organism-media pairings [J]. Nat Commun, 2015. doi:10.1038/ncomms9493.
Researchadvancesonmetabolicpathwaysandmechanismsof biodegradationoftriphenylmethanedyes
SONGJinlong1,MUYingchun1,RUANZhiyong2,LILe1,WANGYani1,3,HANGang1*
(1.QualityandStandardsResearchCenter,ChineseAcademyofFisherySciences;KeyLaboratoryofControlofQualityandSafetyforAquaticProducts,MinistryofAgriculture,Beijing100141,China;2.InstituteofAgriculturalResourcesandRegionalPlanning,ChineseAcademyofAgriculturalSciences,Beijing100081,China;3.CollegeofFoodScience,ShanghaiOceanUniversity,Shanghai201306,China)
Some of triphenylmethane dyes, though have been proved to be teratogenic, carcinogenic and mutagenic, they are still widely used to date. The long-term exposure and extensive use of triphenylmethane dyes poses great threats to human health and ecological environment. Microbial degradation of dye residues is widely considered to be an effective strategy to eliminate the dye pollution. In this paper, the triphenylmethane-dye-degrading microorganisms reported recently, the potential metabolic pathways and biodegradation mechanisms are summarized. Moreover, the further development of the microbial degradation of triphenylmethane dyes is prospected. [Chinese Fishery Quality and Standards,2017,7(6):10-16]
microbial degradation; triphenylmethane dyes; metabolites; biodegradation mechanisms
HAN Gang, hangang@cafs.ac.cn
欢迎订阅2018年《农产品质量与安全》
主管单位:中华人民共和国农业部;
主办单位:中国农业科学院;
支持单位:农业部农产品质量安全监管局;
协办单位:农业部农产品质量安全中心 中国绿色食品发展中心;
承办单位:中国农业科学院农业质量标准与检测技术研究所。
主要栏目:本刊特稿、本刊专稿、政策法规、质量安全监管、无公害农产品、绿色食品、有机农产品、农产品地理标志、农业标准化、检验检测、学科建设与发展、研究与探讨、安全生产技术、地方经验交流、海外博览、农业标准公告、信息与动态等。
读者对象:与农产品质量安全、农业质量标准和检验检测有关的各级行政管理、科研教学、检验监测、技术推广、生产企业等部门的相关人员。
本刊为中国科技核心期刊,双月刊,逢双月10日出版。大16开本,彩色四封,80页。全国各地邮局(所)均可订阅,也可直接到本刊编辑部办理订阅手续。邮发代号:82-223。每册定价:10.00元,全年共60.00元。
通讯地址:北京市中关村南大街12号中国农科院质标所《农产品质量与安全》编辑部,邮政编码:100081。
联系电话/传真:(010)82106521、82106522E-mail:aqs@caas.cn
10.3969/j.issn.2095-1833.2017.06.002
S98
A
2095-1833(2017)06-0010-07
2017-05-26;接收日期2017-10-19
国家自然科学基金(31371730)
宋金龙(1983-),男,博士,助理研究员,研究方向为水产品质量安全,songjl@cafs.ac.cn
韩刚,副研究员,研究方向为水产品质量安全,hangang@cafs.ac.cn

